DOi:10.13590/j.cjfh.2017.01.002
鲜活贝类中单核细胞增生李斯特菌的分离鉴定及毒力基因与耐药性分析
作者单位:(1.中国水产科学研究院黄海水产研究所 农业部水产品质量安全检测与评价重点实验室 农业部水产品质量 安全风险评估实验室(青岛),山东 青岛266071; 2.獐子岛集团股份有限公司,辽宁 大连116001; 3.上海海洋大学,上海201306)
通信作者: 王联珠女研究员研究方向为水产品质量安全与标准化E-mail:wanglz@ysfri.ac.cn
收稿日期: 2016-11-09
基金项目: 国家科技支撑计划(2015BAD17B03);科技部科技基础性工作专项(2013FY113300)
摘要:目的 研究采自产地的鲜活贝类中单核细胞增生李斯特菌(单增李斯特菌)的污染状况、毒力基因分布与耐药性。方法对采自产地的200份鲜活贝类,按照GB/T 4789.30—2010《食品安全国家标准 食品卫生微生物学检验 单核细胞增生李斯特氏菌检验》进行单增李斯特菌的分离与鉴定;采用Kirby-Bauer纸片扩散法测定分离株的耐药性;通过PCR法分析分离株9个毒力基因(包括prfA、plcB、hly、actA、iap、inlA、plcA、mpl、inlB)。结果在200份鲜活贝类中,共检出阳性样品4份(2.0%);有1株缺失inlB基因,1株缺失mpl基因;分离株对氨苄青霉素、庆大霉素等一线临床治疗药物敏感,但有2株对四环素和复方新诺明同时耐药,1株对复方新诺明和氧氟沙星耐药。结论采自产地的鲜活贝类存在单增李斯特菌的污染,分离株毒力基因有一定程度缺失,提示初级水产品中的单增李斯特菌污染需引起关注,并且需要继续加强食品中该菌的耐药性监测。
关键词:
单核细胞增生李斯特菌; 食源性致病菌; 贝类; 水产; 产地; 毒力基因; 耐药特性; 分离鉴定
文章编号:1004-8456(2017)01-0005-04 中图分类号: R155.5 文献标识码:A
Identification, virulence gene determination and antibiotic resistance of Listeria monocytogenes in fresh shellfish from shellfish beds
(1.Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Testing and Evaluation for Aquatic Product Safety and Quality,Ministry of Agriculture, P. R. China; Laboratory of Quality and Safety Risk Assessment for aquatic products (Qingdao), Ministry of Agriculture, P. R. China,Shandong Qingdao 266071,China; 2.Zoneco Group Company Limited, Liaoning Dalian 116001,China; 3.Shanghai Ocean University,Shanghai 201306,China)
Abstract:Objective To study the contamination of Listeria monocytogenes in fresh shellfish collected from shellfish beds, and to analyze their virulence genes and antibiotic resistance.MethodsPresumptive Listeria monocytogenes were isolated from 200 shellfish samples using the national food safety standard, Food Microbiological Examination: Lisiteria monocytogenes (GB/T 4789.30-2010). The antimicrobial resistance was performed by Kirby-Bauer method and the virulence genes were determined by PCR amplification. ResultsAmong 4 (2.0%) Listeria monocytogenes isolates, 2 strains lacked inlB gene or mpl gene respectively. All the 4 strains were susceptible to the first-line therapeutic antibiotics including ampicillin and gentamicin. Two strains were resistant to tetracycline and trimethoprim-sulfamethoxazol and 1 strain was resistant to trimethoprim-sulfamethoxazol and ofloxacin. ConclusionSamples collected from the shellfish beds were contaminated with Listeria monocytogenes, of which some isolates were lack of virulence genes and were resistant to several important antibiotics. It was necessary to strengthen the contamination and drug resistance monitoring of Listeria monocytogenes in fresh primary aquatic products.
Key words:
Listeria monocytogenes; foodborne pathogens; shellfish; aquatic products; shellfish beds; virulence genes; antibiotic-resistant characteristics; isolation and identification
单核细胞增生李斯特菌(Listeria monocytogenes,以下简称单增李斯特菌)是危害公共卫生和食品安全的一种重要人畜共患致病菌,可引起脑膜炎、败血症和流产等,孕妇、新生儿、老年人和免疫缺陷病人是该菌的易感人群。发病率虽然不高,但死亡率可高达30%。该菌被世界卫生组织(WHO)列为四大重要食源性致病菌之一,也被列为21世纪对中国人卫生健康具有重大影响的12种病原微生物之一。近年来国内开展多项针对生肉、熟肉制品、即食食品、冷冻水产品等食品中单增李斯特菌的监测[1-3],但鲜见鲜活海产贝类污染状况报道。海产贝类作为我国重要的水产品,多生活在近海、河口附近,生存环境较易受到污染,贝类在滤食水体中饵料的同时也增加了富集有害因子的风险;另一方面,部分消费者为了追求口感与鲜味,往往将贝类稍微加热就食用,甚至完全生食,增加了受污染贝类传播食源性疾病的隐患。开展贝类中单增李斯特菌的检测、毒力分析与耐药性的研究,有利于进一步明确该菌在食品中的污染状况,了解食品分离株的毒力分布与耐药趋势,为贝类中危害因子的风险监测及临床治疗提供参考依据。
根据单增李斯特菌感染临床治疗常用抗生素的应用,结合研究需要,选择如下药敏纸片:链霉素、庆大霉素、亚胺培南、丁胺卡那霉素、氨苄青霉素、环丙沙星、卡那霉素、氯霉素、美罗培南、氟甲砜霉素、四环素、氧氟沙星、哌拉西林、舒巴坦-氨苄青霉素、他唑巴坦、诺氟沙星、利福平、红霉素、复方新诺明、万古霉素均购自美国OXOID。
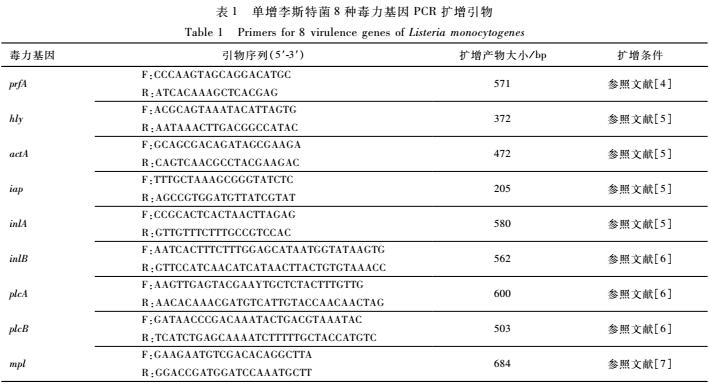
单增李斯特菌毒力基因(包括prfA、plcB、hly、actA、iap、inlA、plcA、mpl、inlB)扩增用引物由上海生工生物工程有限公司合成,引物名称、序列等见表1。细菌基因组DNA提取试剂盒[天根生化科技(北京)有限公司],Taq酶、DNA分子量DL2000均购自宝生物工程(大连)有限公司。
1材料与方法
1.1材料
1.1.1样品及标准菌株
栉孔扇贝、太平洋牡蛎、紫贻贝、四角蛤蜊、菲律宾蛤仔、青蛤、文蛤等样品共200份,采自辽宁、河北、山东三省部分贝类养殖区,冷藏条件下24 h内运到实验室。单增李斯特菌标准菌株(ATCC 19116)、药敏试验质控菌株大肠埃希菌(ATCC 25922)、金黄色葡萄球菌(ATCC 25923)均购自美国模式培养物集存库。
1.1.2主要仪器与试剂
胰酪胨大豆肉汤、李氏增菌肉汤LB、脑心浸液肉汤、1%盐酸吖啶黄、1%萘啶酮酸盐、PALCAM琼脂、羊血琼脂平板、单增李斯特菌生化鉴定套装、M-H培养基均购自北京陆桥技术股份有限公司,单增李斯特菌显色培养基(郑州博赛生物技术股份有限公司)。根据单增李斯特菌感染临床治疗常用抗生素的应用,结合研究需要,选择如下药敏纸片:链霉素、庆大霉素、亚胺培南、丁胺卡那霉素、氨苄青霉素、环丙沙星、卡那霉素、氯霉素、美罗培南、氟甲砜霉素、四环素、氧氟沙星、哌拉西林、舒巴坦-氨苄青霉素、他唑巴坦、诺氟沙星、利福平、红霉素、复方新诺明、万古霉素均购自美国OXOID。
单增李斯特菌毒力基因(包括prfA、plcB、hly、actA、iap、inlA、plcA、mpl、inlB)扩增用引物由上海生工生物工程有限公司合成,引物名称、序列等见表1。细菌基因组DNA提取试剂盒[天根生化科技(北京)有限公司],Taq酶、DNA分子量DL2000均购自宝生物工程(大连)有限公司。
|
表1单增李斯特菌8种毒力基因PCR扩增引物
Table 1Primers for 8 virulence genes of Listeria monocytogenes
|
1.2方法
1.2.1菌株的分离与鉴定
按照国家标准GB/T 4789.30—2010《食品安全国家标准 食品卫生微生物学检验 单核细胞增生李斯特氏菌检验》[8]进行单增李斯特菌的分离与鉴定。
1.2.2毒力基因检测
将分离、鉴定、纯化后的单增李斯特菌接种于脑心浸液肉汤中,30 ℃过夜培养。培养物基因组DNA提取按试剂盒操作说明进行。各毒力基因PCR扩增条件见表1。试验设置单增李斯特菌标准菌株(ATCC 19116)为阳性对照,灭菌去离子水作为阴性对照。PCR产物经1.0%琼脂糖凝胶电泳分析,阳性PCR产物由上海生工生物工程有限公司测序做进一步确认。
1.2.3药敏试验
按我国出入境检验检疫行业标准SN/T 1944—2007《动物及其制品中细菌耐药性的测定 纸片扩散法》[9]进行分离株的药敏试验及判定。
2结果
2.1鲜活贝类样品中单增李斯特菌检测结果
对本研究采集的200份贝类样品进行单增李斯特菌检测,在2份四角蛤蜊、1份紫贻贝、1份菲律宾蛤仔样品中分离出目标菌,阳性检出率为2.0%。将4份阳性样品中分离得到的单增李斯特菌分别编号为2015SF44、2015SF48、2015SF148、2015SF198。
2.2分离菌株药敏试验结果
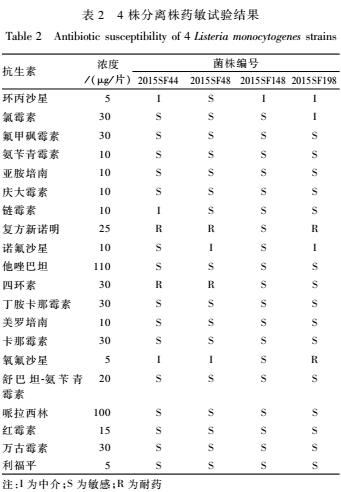
4株单增李斯特菌分离株的药敏试验结果见表2。有2株菌同时对复方新诺明和四环素耐药,有1株菌对复方新诺明和氧氟沙星耐药。
|
表2 4株分离株药敏试验结果
Table 2Antibiotic susceptibility of 4 Listeria monocytogenes strains
注:I为中介;S为敏感;R为耐药
|
2.3分离菌株毒力基因检测结果
4株单增李斯特菌分离株的主要毒力基因PCR检测结果见表3。有2株菌分别缺失inlB和mpl基因。
|
|
表3 4株单增李斯特分离株毒力基因分析
Table 3Virulence gene analysis of 4 Listeria monocytogenes strains
|
3讨论
通过多年的监测,我国在生畜禽肉、肉制品、蔬菜、冷饮、乳制品等多种食品中分离到了单增李斯特菌,水产品中也有检出报道,主要为冻鱼等冷冻水产加工品[1-3]。由于单增李斯特菌是一种典型的耐冷性细菌,因此冷冻水产品在加工、储藏等环节更容易污染单增李斯特菌。养殖、捕捞环节的污染状况目前鲜有报道,本文针对较易受污染的鲜活贝类开展研究,分离到4株单增李斯特菌,表明在贝类养殖或捕捞环节中也存在单增李斯特菌的污染情况,提示水产品原材料、养殖捕捞环境中单增李斯特菌污染也需要关注,建议消费者在食用贝类时,应当充分加热,摒弃生食、半生食贝类的饮食习惯,避免引发食源性疾病。
单增李斯特菌的致病性与毒力基因密切相关,缺失一个或多个毒力基因将导致其致病性的下降甚至完全消失。单增李斯特菌的毒力基因主要分布于LIPI-1与LIPI-2两个毒力岛上,其中LIPI-1包含prfA、plcA、hly、mpl、actA、plcB共6个毒力基因,LIPI-2包含ilnA、ilnB共2个毒力基因。本研究从鲜活贝类中分离到的4株单增李斯特菌中,有2株分离株检测到8个目标毒力基因,有研究表明[1], 毒力基因的检测结果与溶血试验、小鼠致病力没有必然联系,毒力基因的表达水平与致病力的关联性更强[10],因此这2株分离株是否具有致病力还需进一步验证。分离株2015SF198缺失inlB基因,该基因编码表面蛋白内化素B(internalin B),它的缺失将导致菌体丧失对宿主细胞黏附与侵入的能力[11];分离株2015SF148缺失mpl基因,该基因编码锌依赖金属蛋白酶(zinc metallopro tease)参与单增李斯特菌在细胞间的直接传递,避免被体液免疫系统清除,并且可以激活磷脂酶C(PC-PLC),该基因的缺失将使菌体丧失在细胞间传递的能力,并间接导致PC-PLC功能的缺失[12]。有研究表明[13],食品中分离到的单增李斯特菌,mpl基因缺失情况十分普遍;inlB基因在前几年的研究中尚未见缺失情况[13],但近年来该基因缺失的报告逐渐增多[14]。对在自然界中广泛分布的单增李斯特菌而言,某些毒力基因也许并不是其生存与繁殖所必须的,在长期的进化过程中,部分单增李斯特菌可能会采取自动清除部分毒力基因的策略,从而保证这类菌株能更好地适应其生存环境[15]。
单增李斯特菌在发现之初,对大多抗生素均敏感。但随着抗生素在医疗及畜牧业的广泛使用甚至滥用,导致单增李斯特菌的耐药状况日趋严重。本研究分离到的4株单增李斯特菌对氨苄青霉素、庆大霉素等临床一线治疗药物均敏感,对二线治疗药物中的红霉素、万古霉素敏感,但有3株对复方新诺明耐药,4株对氧氟沙星、环丙沙星、诺氟沙星出现中介,这也与前期发现的单增李斯特菌对沙星类药物中介率高的情况吻合[16-17],说明存在一定耐药情况。研究表明[18],甲氧苄啶耐受基因由质粒pIP823携带,该质粒在金黄色葡萄球菌、枯草芽胞杆菌、大肠埃希菌中广泛存在,并且可在上述细菌中传递,这也可能是近年来单增李斯特菌对复方新诺明耐药率增加的原因。虽然本研究结果表明分离株对多数抗生素耐药性不高,临床用药前景比较乐观,但结合近几年食品中单增李斯特菌耐药性分析结果,仍然需要密切监测耐药性的变化趋势。四环素极少用于治疗李斯特菌病,但单增李斯特菌耐四环素的比例很高,本研究也发现在4株分离株中有2株耐受四环素,这与四环素曾长期作为动物生长促进剂在动物饲料中添加有关,从而导致细菌对四环素类的耐药情况日趋严重。细菌主要是编码外输泵蛋白、核糖体保护蛋白、灭活或钝化四环素的酶来实现耐受四环素,目前已知的四环素耐药基因有20余种。接合转座子Tn916是散播tet(M)介导的四环素耐药的重要载体,能在不同的菌间转移[19]。本课题组也将进一步分析分离株的耐药基因,以期解析其耐药分子机制。
参考文献
[1]王连秀,赵维勇,牛恒彩,等.食品中单核细胞增生李斯特氏菌调查及毒力研究[J].中国食品卫生杂志,2001,13(2):16-18.
[2]贾静,毕振旺,陈玉贞,等.2009—2010年山东省食品中单核细胞增生李斯特菌的耐药性和分子分型研究[J].中华预防医学杂志,2011,45(12):1065-1067.
[3]遇晓杰,苏华,张剑峰,等.黑龙江省食品中单核细胞增生李斯特氏菌污染监测[J].中国公共卫生管理,2010,44(12):652-654.
[4]Cooray K J,Nishibofi T,XIONG H,et al.Detection of multiple virulence-associated genes of Listeria monocytogenes by PCR in artificially contaminated milk samples[J].Applied Environmental Microbiology,1994,60(8):3023-3026.
[5]宫照龙,祝仁发,叶长芸.118株单核细胞增生李斯特菌的毒力基因检测[J].疾病监测,2007,22(5):299-301.
[6]Volokhov D,Rasooly A,Chumakov K,et al.Identification of Listeria species by microarray-based assay[J].Journal of Clinical Microbiology,2002,40(12):4720-4728.
[7]Marquis H,Goldfine H,Portnoy D A,et al.Proteolytie pathways of activation and degradation of a bacterial phospholipase C during intracellular infection by Listeria monocytogenes[J].Journal of Cell Biology,1997,137(6):1381-1392.
[8]中华人民共和国卫生部.GB/T 4789.30—2010 食品安全国家标准 食品卫生微生物学检验 单核细胞增生李斯特氏菌检验[S].北京:中国标准出版社,2010.
[9]中华人民共和国国家质量监督检验检疫总局.SN/T 1944—2007 动物及其制品中细菌耐药性的测定 纸片扩散法[S].北京:中国标准出版社,2007.
[10]白帆,陈健舜,程昌勇,等.单核细胞增生李斯特菌弱毒株主要毒力基因表达水平分析[J].动物医学进展,2010,31(S):108-111.
[11]Bonazzi M,Lecuit M,Cossart P.Listeria monocytogenes internalin and E-cadherin:from structure to pathogenesis[J].Cellular Microbiology,2009,11(5):693-702.
[12]Forster B M,Zemansky J,Portnoy D A,et al.Posttranslocation chaperone PrsA2 regulates the maturation and secretion of Listeria monocytogenes proprotein virulence factors[J].Journal of Bacteriology,2011,193(21):5961-5970.
[13]杨洋,付萍,郭云昌,等.2005年中国食源性单核细胞增生李斯特菌毒力基因分布[J].中华预防医学杂志,2010,44(12):1097-1101.
[14]于丰宇,李林,王红,等.应用PCR技术快速测定食品中单核细胞增生李斯特氏菌毒力[J].食品科学,2010,31(23):164-168.
[15]Velge P,Roche S M.Variability of Listeria monocytogenes virulence:a result of the evolution between saprophytism and virulence[J].Future Microbiology,2010,5(12):1799-1821.
[16]赵悦,付萍,裴晓燕,等.中国食源性单核细胞增生李斯特菌耐药特征分析[J].中国食品卫生杂志,2012,24(1):5-8.
[17]王丽丽,陈倩.北京市人源性单核细胞增生李斯特菌耐药特征及分子分型研究[J].中国食品卫生杂志,2016,28(4):426-430.
[18]Charpentier E,Gerbaud G,Courvalin P.Conjugative mobilization of the rolling-circle plasmid pIP823 from Listeria monocytogenes BM4293 among gram-positive and gram-negative bacteria[J].Journal of Bacteriology,1999,181(11):3368-3374.
[19]Chopra I,Roberts M.Tetracycline antibiotics:mode of action, applications, molecular biology, and epidemiology of bacterial resistance[J].Microbiology and Molecular Biology Reviews,2001,65(2):232-260.
[2]贾静,毕振旺,陈玉贞,等.2009—2010年山东省食品中单核细胞增生李斯特菌的耐药性和分子分型研究[J].中华预防医学杂志,2011,45(12):1065-1067.
[3]遇晓杰,苏华,张剑峰,等.黑龙江省食品中单核细胞增生李斯特氏菌污染监测[J].中国公共卫生管理,2010,44(12):652-654.
[4]Cooray K J,Nishibofi T,XIONG H,et al.Detection of multiple virulence-associated genes of Listeria monocytogenes by PCR in artificially contaminated milk samples[J].Applied Environmental Microbiology,1994,60(8):3023-3026.
[5]宫照龙,祝仁发,叶长芸.118株单核细胞增生李斯特菌的毒力基因检测[J].疾病监测,2007,22(5):299-301.
[6]Volokhov D,Rasooly A,Chumakov K,et al.Identification of Listeria species by microarray-based assay[J].Journal of Clinical Microbiology,2002,40(12):4720-4728.
[7]Marquis H,Goldfine H,Portnoy D A,et al.Proteolytie pathways of activation and degradation of a bacterial phospholipase C during intracellular infection by Listeria monocytogenes[J].Journal of Cell Biology,1997,137(6):1381-1392.
[8]中华人民共和国卫生部.GB/T 4789.30—2010 食品安全国家标准 食品卫生微生物学检验 单核细胞增生李斯特氏菌检验[S].北京:中国标准出版社,2010.
[9]中华人民共和国国家质量监督检验检疫总局.SN/T 1944—2007 动物及其制品中细菌耐药性的测定 纸片扩散法[S].北京:中国标准出版社,2007.
[10]白帆,陈健舜,程昌勇,等.单核细胞增生李斯特菌弱毒株主要毒力基因表达水平分析[J].动物医学进展,2010,31(S):108-111.
[11]Bonazzi M,Lecuit M,Cossart P.Listeria monocytogenes internalin and E-cadherin:from structure to pathogenesis[J].Cellular Microbiology,2009,11(5):693-702.
[12]Forster B M,Zemansky J,Portnoy D A,et al.Posttranslocation chaperone PrsA2 regulates the maturation and secretion of Listeria monocytogenes proprotein virulence factors[J].Journal of Bacteriology,2011,193(21):5961-5970.
[13]杨洋,付萍,郭云昌,等.2005年中国食源性单核细胞增生李斯特菌毒力基因分布[J].中华预防医学杂志,2010,44(12):1097-1101.
[14]于丰宇,李林,王红,等.应用PCR技术快速测定食品中单核细胞增生李斯特氏菌毒力[J].食品科学,2010,31(23):164-168.
[15]Velge P,Roche S M.Variability of Listeria monocytogenes virulence:a result of the evolution between saprophytism and virulence[J].Future Microbiology,2010,5(12):1799-1821.
[16]赵悦,付萍,裴晓燕,等.中国食源性单核细胞增生李斯特菌耐药特征分析[J].中国食品卫生杂志,2012,24(1):5-8.
[17]王丽丽,陈倩.北京市人源性单核细胞增生李斯特菌耐药特征及分子分型研究[J].中国食品卫生杂志,2016,28(4):426-430.
[18]Charpentier E,Gerbaud G,Courvalin P.Conjugative mobilization of the rolling-circle plasmid pIP823 from Listeria monocytogenes BM4293 among gram-positive and gram-negative bacteria[J].Journal of Bacteriology,1999,181(11):3368-3374.
[19]Chopra I,Roberts M.Tetracycline antibiotics:mode of action, applications, molecular biology, and epidemiology of bacterial resistance[J].Microbiology and Molecular Biology Reviews,2001,65(2):232-260.
 姚琳,江艳华,李风铃,张媛,张奇,朱文嘉,郭莹莹,王联珠,翟毓秀.鲜活贝类中单核细胞增生李斯特菌的分离鉴定及毒力基因与耐药性分析[J].中国食品卫生杂志,2017,29(1):5-8.
姚琳,江艳华,李风铃,张媛,张奇,朱文嘉,郭莹莹,王联珠,翟毓秀.鲜活贝类中单核细胞增生李斯特菌的分离鉴定及毒力基因与耐药性分析[J].中国食品卫生杂志,2017,29(1):5-8.