DOi:10.13590/j.cjfh.2017.01.005
转基因牛肉食用安全性的初步评价
(国家食品安全风险评估中心 卫生部食品安全风险评估重点实验室,北京100021)
通信作者: 刘珊女研究员研究方向为食品毒理 E-mail:liushan78@hotmail.com
收稿日期: 2016-12-02
基金项目: 转基因生物新品种培育科技重大专项(2014ZX08011-005)
摘要:目的 通过90 d喂养试验初步评价转人α-乳清白蛋白基因牛肉的食用安全性。方法将普通牛肉和转基因牛肉分别制成牛肉粉,按照5%的比例掺入基础饲料并调整配方使之与啮齿类实验动物纯化饲料AIN93G相一致。将Wistar大鼠按体质量随机分为3组,分别以转基因牛肉饲料、普通牛肉饲料和基础饲料AIN93G喂养90 d。每日观察动物体征,每周记录动物体质量和进食量,试验结束时对动物进行尿液检查、血液细胞学和血液生化学分析,对重要脏器称重并进行组织病理学检查。结果进食含有转基因牛肉的饲料对大鼠体质量、进食量、尿液、血液细胞学和血液生化学、脏器重量及组织病理学均未产生明显改变,差异均无统计学意义(P>0.05)。结论大鼠的90 d喂养试验结果提示转基因牛肉的食用安全性与普通牛肉无差别。
关键词:
关键词: 人α-乳清白蛋白基因; 转基因; 转基因食品; 牛肉; 90 d喂养试验; 食品安全; 食用安全性
中图分类号: R155文 献标识码:A 文章编号:1004-8456(2017)01-0019-07
Safety assessment of meat from transgenic cattle by 90-day feeding study in rats
(Key Laboratory of Food Safety Risk Assessment of Ministry of Health,China National Center for Food Safety Risk Assessment,Beijing 100021,China)
Abstract:Objective The research was conducted to evaluate the safety of beef derived from human α-lactalbumin gene-modified cattle by 90-day feeding study in male and female Wistar rats.MethodsTransgenic beef or conventional beef was processed into powder. Five percent of beef powder was incorporated into diet and other ingredients were adjusted to simulate AIN93G purified diets for laboratory rodents. Rats were randomly assigned into three groups with approximately similar initial mean body weights, which were transgenic beef group, conventional beef group, and AIN93G diet group. Clinical observations were conducted daily during the 90-day study, and body weight and food consumption were weighed weekly. At the end of the study, urinary examination, hematology and blood biochemistry examination, macroscopic and microscopic examinations were conducted. ResultsThere were no biologically significant differences between the transgenic beef group and the conventional beef group in all items observed(P>0.05).ConclusionThe present 90-day feeding study suggested that transgenic beef might be as safe as conventional beef.
Key words:
Human α-lactalbumin gene; transgene; genetically modified food; beef; 90-day feeding study; food safety; edible safety
20世纪70年代DNA重组技术的诞生使外源核酸分子能够跨越天然物种屏障进入新的生物中,经过几十年的发展,转基因技术不断成熟和完善。转基因技术和体细胞核转移克隆技术的完美结合使得转基因克隆动物的问世成为可能。1997年英国PPL公司与罗斯林研究所联手合作,率先在世界上制作了第一例转基因绵羊[1],即成功表达人凝血因子Ⅸ蛋白的转基因绵羊,之后携带不同外源基因的转基因克隆动物成为研究热点[2-6]。与此同时,转基因动物及其产品的安全性评价研究也飞快地发展着,2008年国际食品法典委员会(Codex Alimentarius Commission,CAC)发布了转基因动物源食品的安全评价规范,认为运用“实质等同性”概念可建立有效的安全评估框架,即识别转基因动物及其传统对照物在食用安全及营养方面的共同点和不同点,对转基因食品的评价并不是对其本身的绝对安全性进行评价,而是主要针对其与传统对照物的不同之处进行评估[7]。本研究评价的转人α-乳清白蛋白基因牛为中国农业大学开发的高效表达转人α-乳清白蛋白的转基因生物,作为乳腺生物反应器主要用于生产人α乳-清白蛋白。本课题组前期已经对该转基因牛生产的牛奶的食用安全性进行了初步评价,未发现任何有生物学意义的改变[8]。考虑到转基因的公牛以及不再用作产奶的母牛最终有被人类食用的可能,本次研究将以转基因牛的牛肉为评价对象,通过主要营养成分分析和90 d喂养试验初步评价其食用安全性,为转基因牛肉的安全性评价提供基础资料。
淋巴细胞免疫分型试剂(美国BD),生化试剂由中生北控生物科技股份有限公司提供,血球稀释液及溶血液由上海东湖仪器试剂科技有限责任公司提供。
血液学检查:测定白细胞计数(WBC)及其分类、淋巴细胞免疫分型、红细胞计数(RBC)、血红蛋白(Hb)、血小板计数(Plt)、血浆凝血酶原时间(PT)和活化部分凝血活酶时间(APTT)。
血生化指标: 测定血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、乳酸脱氢
酶(LDH)、肌酸激酶(CK)、胆碱酯酶(ChE)、肌酐(Cr)、尿素氮(BUN)、血糖(GLU)、总胆固醇(CHO)、甘油三酯(TG)、总蛋白(TP)、白蛋白(ALB)、球蛋白(G)、白 球比(A/G)、无机磷(P)、氯(Cl)、钠(Na)、钾(K)、钙(Ca)。
尿液检查: 测定白细胞、酮体、亚硝酸盐、尿胆原、胆红素、蛋白质、葡萄糖、尿比重、pH值、隐血、肌酐、尿钙、尿微球蛋白。
脏器系数: 试验结束处死动物前称体质量,取脑、心脏、肝脏、肾脏、肾上腺、脾脏、胸腺、睾丸附睾称重,计算相应的脏器系数(以100 g体质量计算)。
组织病理学检查: 试验结束时处死动物,除肉眼观察外,取大脑、小脑、垂体、胸主动脉、心脏、肺脏(包括主支气管)、气管、胸腺、甲状腺(部分包括甲状旁腺)、唾液腺(包括下颌腺、舌下腺)、食管、含骨髓的胸骨、含骨髓的股骨、脊髓、胰腺、肝、肾、肾上腺、脾、胃、十二指肠、空肠、回肠、盲肠、结肠、直肠、肠系膜淋巴结、膀胱、乳腺、皮肤、骨骼肌、坐骨神经、眼球、哈德氏泪腺、腮腺、前列腺、睾丸、附睾、精囊腺或卵巢(附带输卵管)、子宫、阴道等组织,进行组织病理学检查。
2结果
这种差异无生物学意义。转基因牛肉组的雄性大鼠血清肌酸激酶的降低亦无毒理学意义。转基因牛肉组其他血生化指标与普通牛肉组比较,差异无统计学意义(P>0.05)。
组织病理学检查发现部分动物脏器出现非特异性病理损伤,包括肝细胞脂肪变性、点状坏死,心肌坏死,肠系膜淋巴结点状出血、坏死,垂体Rathke’s囊肿,垂体点状出血、坏死,骨骼肌肌纤维点状溶解,转基因牛肉组和普通牛肉组大鼠组织器官病理改变的病变程度和发生率差异无统计学意义(P>0.05),考虑为动物自发的基础性病变,详见表8。其他组织器官大脑、小脑、主动脉、肺脏(包括主支气管)、气管、胸腺、甲状腺(部分包括甲状旁腺)、唾液腺(包括下颌腺、舌下腺)、食管、含骨髓的胸骨、含骨髓的股骨、脊髓、胰腺、肾、肾上腺、脾、胃、十二指肠、空肠、回肠、盲肠、结肠、直肠、膀胱、乳腺(雌性)、皮肤、坐骨神经、眼球、哈德氏泪腺、腮腺、前列腺、睾丸、附睾、精囊或卵巢、输卵管、子宫、阴道等均未见有意义的病理改变。
1 近年来对转基因动物食用安全性的研究也逐渐增多。2012年欧洲食品安全署(European Food Safety Anthority,EFSA)发布了转基因动物健康福利及食用饲用风险评估的指导原则。虽然各个国家对转基因生物的安全性评价要求不尽相同,但关于转基因生物产品的食用安全性评价原则是比较一致的,主要包括主要成分分析和动物喂养试验。就目前发表的研究结果来看,转基因动物及其产品的食用安全性与非转基因对照动物无明显差异[19-21]。
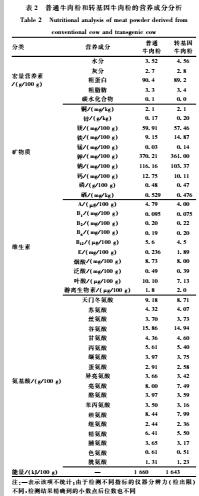
本研究通过成分分析对比发现,两种牛肉粉的宏量营养素、维生素、矿物质、氨基酸组成以及能量均相似,提示两种牛肉的营养价值没有差异。但是与其他文献比较发现本研究中两种牛肉蛋白质含量高而脂肪含量低,这与牛肉粉的制备过程有关。Yamaguchi等[12]直接用生牛肉切块后冷冻干燥,考虑到煮熟后食用更接近中国人的饮食习惯,本研究将牛肉煮熟后再通过冷冻干燥技术制成牛肉粉。
出于饲料营养均衡的考虑,喂养试验中设计牛肉粉掺入剂量为5%,大鼠90 d喂养过程中平均每日饲料消费量约为80 g/kg BW,则每日摄入的牛肉粉约为4 g/kg BW。样品处理过程中制成1 kg牛肉粉需约4.5 kg牛肉,大鼠每日摄入的牛肉粉折成鲜牛肉为18 g/kg BW。中国居民膳食指南推荐成人每人每日畜禽肉类摄入量为50~75 g(以成人体重60 kg计,则推荐量上限为1.25 g/kg BW)[22],本试验剂量为畜禽肉类总摄入推荐量的14.4倍。2012年牛肉的人均牛肉消费量为5.16 kg(每日0.24 g/kg BW)[23],试验剂量为2012年牛肉消费量的75倍。此外,由于转人α-乳清白蛋白基因主要用于生产高品质牛奶,转基因牛肉实际进入人群食物链对牛肉总摄入量的贡献比例较低,因此转基因牛肉的实际暴露限值远高于75。但试验计量与传统毒理学试验对安全系数的要求相去甚远,这也是全食物喂养试验普遍存在的问题[12-13]。
90 d喂养试验结果表明,进食转基因牛肉对大鼠的体质量和进食量均无影响,血液细胞学、血液生化学、尿液分析及组织病理学检查结果均未见有生物学意义的改变。血液学检查中白细胞分类指标是以所有白细胞计为100%,一部分的比例增高必然伴随另一部分的比例下降,本试验中发现的转基因组白细胞分类中的中间细胞降低,可能与淋巴细胞比例的轻微增加(但无统计学意义)有关。同时,与血液细胞学相关的骨髓及脾脏等组织器官亦无组织病理学改变也佐证了转基因牛肉对动物的血液学无不良影响。
本研究结果表明转基因牛肉的食用安全性与传统方法养育的牛肉相同。
1材料与方法
1.1材料
1.1.1受试样品
转人α-乳清白蛋白基因牛肉和非转基因普通牛肉均由中国农业大学提供,分别来自1头转基因牛和3头非转基因牛,牛肉煮熟后制成干粉。
1.1.2实验动物和饲料
健康SPF级Wistar大鼠60只,雌雄各半,由中国人民解放军军事医学科学院实验动物中心提供[许可证号:SCXK(军)2007-004]。使用中国医学科学院实验动物研究所清洁级动物房[合格证号:SYXK(京)2010-0029],饲料由北京华阜康生物科技股份有限公司配制[合格证号:SCXK(京)2009-0008]。AIN93G作为基础饲料,将非转基因牛肉和转人α-乳清白蛋白基因牛肉煮熟后制成冻干粉,按5%的比例掺入基础饲料作为普通牛肉组和转基因牛肉组饲料,并根据牛肉粉的营养分析结果调整饲料原料比例使之与AIN93G一致[9]。各种饲料组分配比见表1。

|
表1各种饲料的配方成分组成 Table 1Composition of test diets supplemented with meat powder derived from conventional cow and transgenic cow |
1.1.3主要仪器与试剂
Hitachi 7080全自动生化分析仪(日本日立),MEK-6318K全自动血球计数仪(日本光电),VIP-E150F脱水机(日本樱花),AS620石蜡切片机(英国Shandon),Autostainer XL染色机(德国Leica),Calibur流式细胞仪(美国BD),Uritest-50尿液分析仪和Uritest 13G试纸条均购自中国优利特,电子天平,离心机,显微镜,包埋机,SCA-5600封片机。淋巴细胞免疫分型试剂(美国BD),生化试剂由中生北控生物科技股份有限公司提供,血球稀释液及溶血液由上海东湖仪器试剂科技有限责任公司提供。
1.2方法
1.2.1受试样品处理
将牛不同部位牛肉去除脂肪和结缔组织后切成小块,常压下煮沸30 min后绞碎,真空冷冻干燥15 h,过40目筛网待用。制得牛肉粉为浅黄色粉末,冰箱-20 ℃冻存。试验前对两种牛肉粉的主要营养成分进行了分析,结果见表2。
1.2.2动物处理与分组
选用体质量50~60 g健康断乳Wistar大鼠60只,雌雄各半,适应3 d。参照NY/T 1102—2006《转基因植物及其产品食用安全检测 大鼠90 d喂养试验》[10]和欧洲食品安全局《转基因动物的健康与福利及其产品的食用饲用风险评估导则》[11]设计试验,按体质量随机分为3组,即基础饲料组、普通牛肉组和转基因牛肉组,每组20只,雌雄各半。基础饲料组喂饲AIN93G饲料,普通牛肉组喂饲含5%非转基因牛肉的饲料,转基因牛肉组喂饲含5%转基因牛肉的饲料,连续喂养观察90 d。试验期间,动物单笼喂养,自由饮食,观察动物生长状况,每周记录大鼠体质量及进食量一次。试验结束,收集尿液并分析,取尾血测血常规,动物禁食过夜,1%戊巴比妥钠腹腔注射麻醉后腹主动脉取血、离心分离血清测各项血生化指标,同时取脏器进行大体、组织病理学检查。
1.2.3观察指标
一般观察:记录动物的一般表现、体质量和食物利用率(每摄入100 g饲料的体质量增长数)。血液学检查:测定白细胞计数(WBC)及其分类、淋巴细胞免疫分型、红细胞计数(RBC)、血红蛋白(Hb)、血小板计数(Plt)、血浆凝血酶原时间(PT)和活化部分凝血活酶时间(APTT)。
血生化指标: 测定血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、乳酸脱氢
|
表2普通牛肉粉和转基因牛肉粉的营养成分分析 Table 2Nutritional analysis of meat powder derived from conventional cow and transgenic cow 注:—表示该项不统计;由于检测不同指标的仪器分辨力(检出限)不同,检测结果精确到的小数点后位数也不同 |
尿液检查: 测定白细胞、酮体、亚硝酸盐、尿胆原、胆红素、蛋白质、葡萄糖、尿比重、pH值、隐血、肌酐、尿钙、尿微球蛋白。
脏器系数: 试验结束处死动物前称体质量,取脑、心脏、肝脏、肾脏、肾上腺、脾脏、胸腺、睾丸附睾称重,计算相应的脏器系数(以100 g体质量计算)。
组织病理学检查: 试验结束时处死动物,除肉眼观察外,取大脑、小脑、垂体、胸主动脉、心脏、肺脏(包括主支气管)、气管、胸腺、甲状腺(部分包括甲状旁腺)、唾液腺(包括下颌腺、舌下腺)、食管、含骨髓的胸骨、含骨髓的股骨、脊髓、胰腺、肝、肾、肾上腺、脾、胃、十二指肠、空肠、回肠、盲肠、结肠、直肠、肠系膜淋巴结、膀胱、乳腺、皮肤、骨骼肌、坐骨神经、眼球、哈德氏泪腺、腮腺、前列腺、睾丸、附睾、精囊腺或卵巢(附带输卵管)、子宫、阴道等组织,进行组织病理学检查。
1.3统计学分析
数据经Excel建立数据库,计算均数和标准差,用SPSS统计软件进行方差分析,以α=0.05,P<0.05为差异有统计学意义,采用均数两两比较方法统计,方差不齐者,数据进行适当的变量转换,待满足方差齐要求后,用转换后的数据进行统计,若变量转换后仍未达到方差齐的目的,采用非参数分析。 2结果
2.1生长状况及食物利用率
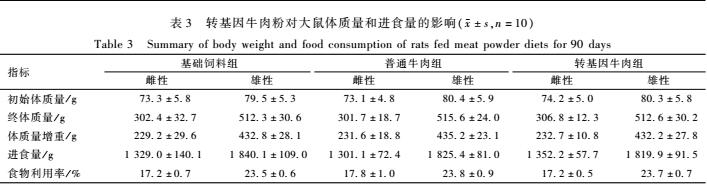
用5%的普通牛肉和转基因牛肉饲料喂养大鼠90 d,试验期间各组动物活动、生长正常,被毛浓密有光泽。由表3可见,转基因牛肉组大鼠的初始体质量、90 d体质量、总进食量和总食物利用率与基础饲料组和普通牛肉组比较,差异无统计学意义(P>0.05)。未见转人α-乳清白蛋白基因牛肉粉对大鼠体质量和食物利用率产生不良影响。
2.2血液学指标
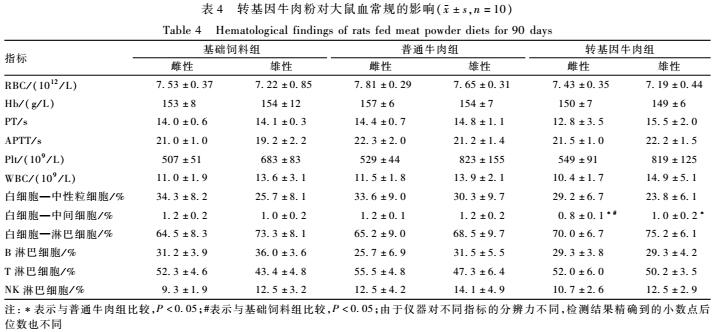
由表4可见,转基因牛肉组雄性大鼠的中间细胞低于普通牛肉组且差异有统计学意义(P<0.05),与基础饲料组比较,差异无统计学意义(P>0.05);转基因牛肉组雌性大鼠的中间细胞低于普通牛肉组和基础饲料组且差异有统计学意义(P<0.05),但在正常范围内(0.2%~2.9%),因此认为这种差异无生物学意义。转基因牛肉组其他血液学指标与普通牛肉组相比,差异均无统计学意义(P>0.05)。
2.3血生化指标
由表5可见,转基因牛肉组雄性大鼠的氯离子浓度、雌性大鼠的血清钾离子浓度均低于普通牛肉组和基础饲料组,且差异有统计学意义(P<0.05),但这些指标均在正常值范围内(氯离子97~115 mmol/L;钾离子3.6~5.9 mmol/L),因此认为
|
表3转基因牛肉粉对大鼠体质量和进食量的影响(±s,n=10) Table 3Summary of body weight and food consumption of rats fed meat powder diets for 90 days |
|
表4转基因牛肉粉对大鼠血常规的影响(±s,n=10) Table 4Hematological findings of rats fed meat powder diets for 90 days 注:*表示与普通牛肉组比较,P<0.05;#表示与基础饲料组比较,P<0.05;由于仪器对不同指标的分辨力不同,检测结果精确到的小数点后位数也不同 |

|
表5转基因牛肉粉对大鼠部分血生化指标的影响(±s,n=10) Table 5Blood biochemical findings of rats fed meat powder diets for 90 days注:*表示与普通牛肉组比较,P<0.05;#表示与基础饲料组比较,P<0.05;由于仪器对不同指标的分辨力不同,检测结果精确到的小数点后位数也不同 |
2.4尿液指标
由表6可见,转基因牛肉组雌雄大鼠的尿液指标与普通牛肉组比较,差异无统计学意义(P>0.05)。

|
表6转基因牛肉粉对大鼠尿液指标的影响(n=10) Table 6Urinalysis findings of rats fed meat powder diets for 90 days 注:括号中的数值表示该分级中的指标范围的最大值 |
2.5脏器系数及组织病理学检查
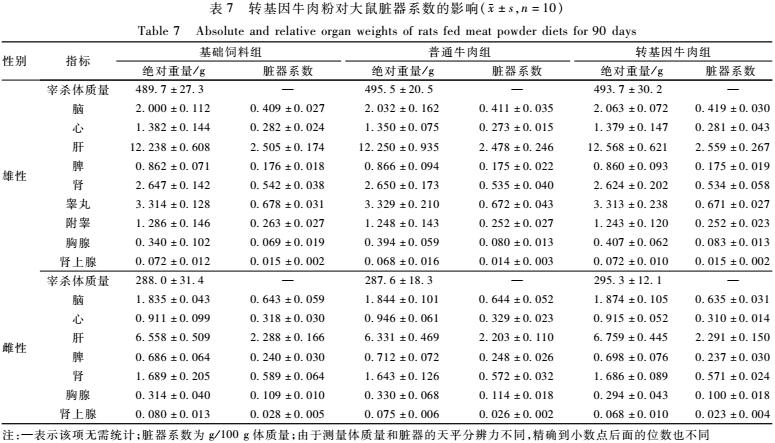
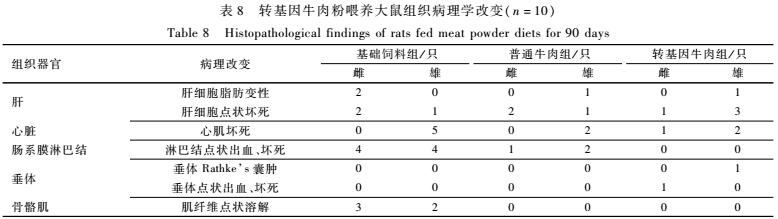
由表7可见,转基因组各脏器的绝对质量及脏器系数与普通牛肉组比较,差异均无统计学意义(P<0.05)。大体解剖观察各组织器官均未见明显异常。组织病理学检查发现部分动物脏器出现非特异性病理损伤,包括肝细胞脂肪变性、点状坏死,心肌坏死,肠系膜淋巴结点状出血、坏死,垂体Rathke’s囊肿,垂体点状出血、坏死,骨骼肌肌纤维点状溶解,转基因牛肉组和普通牛肉组大鼠组织器官病理改变的病变程度和发生率差异无统计学意义(P>0.05),考虑为动物自发的基础性病变,详见表8。其他组织器官大脑、小脑、主动脉、肺脏(包括主支气管)、气管、胸腺、甲状腺(部分包括甲状旁腺)、唾液腺(包括下颌腺、舌下腺)、食管、含骨髓的胸骨、含骨髓的股骨、脊髓、胰腺、肾、肾上腺、脾、胃、十二指肠、空肠、回肠、盲肠、结肠、直肠、膀胱、乳腺(雌性)、皮肤、坐骨神经、眼球、哈德氏泪腺、腮腺、前列腺、睾丸、附睾、精囊或卵巢、输卵管、子宫、阴道等均未见有意义的病理改变。
3讨论
转基因动物的研究至今已有近30年的历史,体细胞核转移和基因修饰是转基因动物培育依赖的两项基本技术。相对于转基因动物,早期对克隆动物产品的食用安全性开展的研究相对较多[12-16],美国食品和药物管理局(FDA)和欧洲食品安全局分别于2008年1月就克隆动物及其产品的食用安全性发表评估报告,认为就目前的研究结果来看,克隆动物及其产品的食用安全性与传统方法培育的动物不存在差异[17-18]。1 近年来对转基因动物食用安全性的研究也逐渐增多。2012年欧洲食品安全署(European Food Safety Anthority,EFSA)发布了转基因动物健康福利及食用饲用风险评估的指导原则。虽然各个国家对转基因生物的安全性评价要求不尽相同,但关于转基因生物产品的食用安全性评价原则是比较一致的,主要包括主要成分分析和动物喂养试验。就目前发表的研究结果来看,转基因动物及其产品的食用安全性与非转基因对照动物无明显差异[19-21]。
本研究通过成分分析对比发现,两种牛肉粉的宏量营养素、维生素、矿物质、氨基酸组成以及能量均相似,提示两种牛肉的营养价值没有差异。但是与其他文献比较发现本研究中两种牛肉蛋白质含量高而脂肪含量低,这与牛肉粉的制备过程有关。Yamaguchi等[12]直接用生牛肉切块后冷冻干燥,考虑到煮熟后食用更接近中国人的饮食习惯,本研究将牛肉煮熟后再通过冷冻干燥技术制成牛肉粉。
|
表7转基因牛肉粉对大鼠脏器系数的影响(±s,n=10) Table 7Absolute and relative organ weights of rats fed meat powder diets for 90 days 注:—表示该项无需统计;脏器系数为g/100 g体质量;由于测量体质量和脏器的天平分辨力不同,精确到小数点后面的位数也不同 |
|
表8转基因牛肉粉喂养大鼠组织病理学改变(n=10) Table 8Histopathological findings of rats fed meat powder diets for 90 days |
90 d喂养试验结果表明,进食转基因牛肉对大鼠的体质量和进食量均无影响,血液细胞学、血液生化学、尿液分析及组织病理学检查结果均未见有生物学意义的改变。血液学检查中白细胞分类指标是以所有白细胞计为100%,一部分的比例增高必然伴随另一部分的比例下降,本试验中发现的转基因组白细胞分类中的中间细胞降低,可能与淋巴细胞比例的轻微增加(但无统计学意义)有关。同时,与血液细胞学相关的骨髓及脾脏等组织器官亦无组织病理学改变也佐证了转基因牛肉对动物的血液学无不良影响。
本研究结果表明转基因牛肉的食用安全性与传统方法养育的牛肉相同。
参考文献
[1]Schnieke A E,Kind A J,Ritchie W A,et al.Human factor IX transgenic sheep produced by transfer of nuclei from transfected fetal fibroblasts[J].Science,1997,278(5346):2130-2133.
[2]Baguisi A,Behboodi E,Melican D T,et al.Production of goats by somatic cell nuclear transfer[J].Nature Biotechnology,1999,17(5):456-461.
[3]Cibelli J B,Stice S L,Golueke P J,et al.Cloned transgenic calves produced from nonquiescent fetal fibroblasts[J].Science,1998,280(5367):1256-1258.
[4]Onishi A,Iwamoto M,Akita T,et al.Pig cloning by microinjection of fetal fibroblast nuclei[J].Science,2000,289(5482):1188-1190.
[5]Chesné P,Adenot P G,Viglietta C,et al.Cloned rabbits produced by nuclear transfer from adult somatic cells[J].Nat Biotechnol,2002,20(4):366-369.
[6]Wilmut I,Schnieke A E,McWhir J,et al.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997,385:810-813.
[7]CAC.CAC/GL 68-2008 Guideline for the conduct of food safety assessment of foods derived from recombinant DNA animals [EB/OL].(2008)[2016-10-14].http://www.codexalimentarius.net/download/standards/11023/CXG_068e.pdf.
[8]支媛,刘海波,耿桂英,等.转人α-乳清白蛋白基因奶粉亚慢性毒性试验[J].卫生研究,2011,40(4):426-430.
[9]Philip G R,Forrest H N,George C F.AIN-93 purified diets for laboratory rodents: final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet[J].J Nutr,1993,123(11):1939-1951.
[10]中华人民共和国农业部.NY/T 1102—2006 转基因植物及其产品食用安全检测 大鼠90 d喂养试验[S].北京:中国标准出版社,2006.
[11]EFSA Panels on GMO and AHAW.Scientific opinion on the guidance on the risk assessment of food and feed from genetically modified animals and animal health and welfare aspects[J].EFSA Journal,2012,10(1):2501.
[12]Yamaguchi M,Itoh M,Ito Y,et al.A 12-month feeding study of reproduction/development in rats fed meat/milk powder supplemented diets derived from the progeny of cloned cattle produced by somatic cell nuclear transfer[J].J Reprod Dev,2008,54(5):321-334.
[13]Yamaguchi M,Ito Y,Takahashi S.Fourteen-week feeding test of meat and milk derived from cloned cattle in the rat[J].Theriogenology,2007,67(1):152-165.
[14]Heyman Y,Chavatte-Palmer P,Berthelot V,et al.Assessing the quality of products from cloned cattle:an integrative approach[J].Theriogenology,2007,67(1):134-141.
[15]Heyman Y,Chavatte-Palmer P,Fromentin G,et al.Quality and safety of bovine clones and their products[J].Animal,2007,1(7):963-972.
[16]Tome D,Dubarry M,Fromentin G.Nutritional value of milk and meat products derived from cloning[J].Cloning Stem Cells,2004,6(2):172-177.
[17]Center for Veterinary Medicine U.S. Food and Drug Admini-stration.Animal cloning:a risk assessment[EB/OL].(2008-01-14)[2016-10-14].http://www.fda.gov/AnimalVeterinary/SafetyHealth/AnimalCloning/ucm055489.htm.
[18]Susan B,Andrew C,Jan S,et al.Food safety,animal health and welfare and environmental impact of animals derived from cloning by somatic cell nucleus transfer(SCNT)and their offspring and products obtained from those animals[J].The EFSA Journal,2008,767:1-49.
[19]ZOU S Y,TANG M,HE X Y,et al.A 90-day subchronic study of rats fed lean pork from genetically modified pigs with muscle-specific expression of recombinant follistatin[J].Regul Toxicol Pharmacol,2015,73(2):620-628.
[20]TANG M X,QIAN L L,JIANG S W,et al.Functional and safety evaluation of transgenic pork rich in omega-3 fatty acids[J].Transgenic Res,2014,23(4):557-571.
[21]XIAO G J,JIANG S W,QIAN L L,et al.A 90-day feeding study in rats to assess the safety of genetically engineered pork[J].PLoS One,2016,11(11):e0165843.
[22]中国营养学会.中国居民膳食指南[M].拉萨:西藏人民出版社,2011:44.
[23]曲春红.未来5年中国牛肉市场形势展望[J].农业展望,2014,10(7):19-22.
[2]Baguisi A,Behboodi E,Melican D T,et al.Production of goats by somatic cell nuclear transfer[J].Nature Biotechnology,1999,17(5):456-461.
[3]Cibelli J B,Stice S L,Golueke P J,et al.Cloned transgenic calves produced from nonquiescent fetal fibroblasts[J].Science,1998,280(5367):1256-1258.
[4]Onishi A,Iwamoto M,Akita T,et al.Pig cloning by microinjection of fetal fibroblast nuclei[J].Science,2000,289(5482):1188-1190.
[5]Chesné P,Adenot P G,Viglietta C,et al.Cloned rabbits produced by nuclear transfer from adult somatic cells[J].Nat Biotechnol,2002,20(4):366-369.
[6]Wilmut I,Schnieke A E,McWhir J,et al.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997,385:810-813.
[7]CAC.CAC/GL 68-2008 Guideline for the conduct of food safety assessment of foods derived from recombinant DNA animals [EB/OL].(2008)[2016-10-14].http://www.codexalimentarius.net/download/standards/11023/CXG_068e.pdf.
[8]支媛,刘海波,耿桂英,等.转人α-乳清白蛋白基因奶粉亚慢性毒性试验[J].卫生研究,2011,40(4):426-430.
[9]Philip G R,Forrest H N,George C F.AIN-93 purified diets for laboratory rodents: final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet[J].J Nutr,1993,123(11):1939-1951.
[10]中华人民共和国农业部.NY/T 1102—2006 转基因植物及其产品食用安全检测 大鼠90 d喂养试验[S].北京:中国标准出版社,2006.
[11]EFSA Panels on GMO and AHAW.Scientific opinion on the guidance on the risk assessment of food and feed from genetically modified animals and animal health and welfare aspects[J].EFSA Journal,2012,10(1):2501.
[12]Yamaguchi M,Itoh M,Ito Y,et al.A 12-month feeding study of reproduction/development in rats fed meat/milk powder supplemented diets derived from the progeny of cloned cattle produced by somatic cell nuclear transfer[J].J Reprod Dev,2008,54(5):321-334.
[13]Yamaguchi M,Ito Y,Takahashi S.Fourteen-week feeding test of meat and milk derived from cloned cattle in the rat[J].Theriogenology,2007,67(1):152-165.
[14]Heyman Y,Chavatte-Palmer P,Berthelot V,et al.Assessing the quality of products from cloned cattle:an integrative approach[J].Theriogenology,2007,67(1):134-141.
[15]Heyman Y,Chavatte-Palmer P,Fromentin G,et al.Quality and safety of bovine clones and their products[J].Animal,2007,1(7):963-972.
[16]Tome D,Dubarry M,Fromentin G.Nutritional value of milk and meat products derived from cloning[J].Cloning Stem Cells,2004,6(2):172-177.
[17]Center for Veterinary Medicine U.S. Food and Drug Admini-stration.Animal cloning:a risk assessment[EB/OL].(2008-01-14)[2016-10-14].http://www.fda.gov/AnimalVeterinary/SafetyHealth/AnimalCloning/ucm055489.htm.
[18]Susan B,Andrew C,Jan S,et al.Food safety,animal health and welfare and environmental impact of animals derived from cloning by somatic cell nucleus transfer(SCNT)and their offspring and products obtained from those animals[J].The EFSA Journal,2008,767:1-49.
[19]ZOU S Y,TANG M,HE X Y,et al.A 90-day subchronic study of rats fed lean pork from genetically modified pigs with muscle-specific expression of recombinant follistatin[J].Regul Toxicol Pharmacol,2015,73(2):620-628.
[20]TANG M X,QIAN L L,JIANG S W,et al.Functional and safety evaluation of transgenic pork rich in omega-3 fatty acids[J].Transgenic Res,2014,23(4):557-571.
[21]XIAO G J,JIANG S W,QIAN L L,et al.A 90-day feeding study in rats to assess the safety of genetically engineered pork[J].PLoS One,2016,11(11):e0165843.
[22]中国营养学会.中国居民膳食指南[M].拉萨:西藏人民出版社,2011:44.
[23]曲春红.未来5年中国牛肉市场形势展望[J].农业展望,2014,10(7):19-22.
 冯晓莲,汪会玲,李晨汐,支媛,刘海波,刘珊.转基因牛肉食用安全性的初步评价[J].中国食品卫生杂志,2017,29(1):19-25.
冯晓莲,汪会玲,李晨汐,支媛,刘海波,刘珊.转基因牛肉食用安全性的初步评价[J].中国食品卫生杂志,2017,29(1):19-25.