DOi:10.13590/j.cjfh.2017.01.006
动脉粥样硬化动物模型筛选
(中国农业科学院油料作物研究所 油料脂质化学与营养湖北省重点实验室,湖北 武汉430062)
作者简介: 田光晶女硕士研究方向为脂质营养E-mail:773221786@qq.com
通信作者: 许继取男副研究员研究方向为脂质营养E-mail:xujiqu@caas.cn
收稿日期: 2016-10-19
基金项目: 国家自然科学基金(NSFC-31171681);现代农业产业技术体系胡麻体系(CARS-17);中国农业科学院科技创新工程(CAAS-ASTIP-2013-OCRI)
摘要:目的 以SD大鼠和ApoE基因敲除(ApoE-/-)小鼠为背景建立4种动脉粥样硬化(AS)模型,通过血浆脂质、炎症水平和病理学检测,筛选出AS研究的最佳动物模型。方法8周龄的雄性健康SD大鼠60只,随机分成正常组(对照组1)、高脂组(模型组1)和高脂+维生素D3组(模型组2);60只8周龄雄性C57BL/6小鼠,其中20只为野生型小鼠(对照组2)、40只为ApoE-/-小鼠,随机分为正常基础饲料喂养组(模型组3)和高脂饲料喂养组(模型组4);6个月后观察体质量变化,检测血浆脂质和炎症水平,分离主动脉进行油红O和苏木精-伊红(HE)染色。结果与对照组1相比,模型组1和模型组2大鼠的血浆总胆固醇( TC)、白介素6(IL-6)和C反应蛋白(CRP)水平明显升高,差异有统计学意义(P<0.05),但是甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)没有明显变化,差异无统计学意义(P>0.05),而且模型组1和模型组2大鼠均未能产生AS斑块和AS的前期表现。另外,与对照组2相比,模型组3和模型组4小鼠血浆TC、TG和LDL-C以及炎症因子IL-6和CRP水平均明显升高,差异有统计学意义(P<0.05),并且其血浆TC、LDL-C、IL-6和CRP水平明显高于模型组3,差异有统计学意义(P<0.05)。此外,模型组4小鼠血浆HDL-C水平明显降低,差异有统计学意义(P<0.05),但是模型组3仅有部分脂质沉积和AS斑块出现,而模型组4表现为典型的AS特点。结论以模型组1和模型组2方法建立的大鼠AS模型不适合作为AS研究的对象;模型组3仅出现部分AS病理特点,而模型组4则发展为典型的AS病理特点,较为适合作为AS研究的对象。
关键词:
动脉粥样硬化; 动物模型; 大鼠; 小鼠
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)01-0026-06
The selection of animal model for the study of atherosclerosis
(Oil Crops Research Institute of Chinese Academy of Agriculture Sciences,Hubei Key Laboratory of Lipid Chemistry and Nutrition,Hubei Wuhan 430062,China)
Abstract:Objective In this study, four kinds of atherosclerotic models with SD rats and ApoE-/- mice were established to select the best animal model for atherosclerosis.MethodsSixty male SD rats were randomly divided into three groups: the first group was fed on normal diets as control group; the second group was fed on high cholesterol diets as model 1 group; the third group was injected with a single dose of vitamin D3 and fed on high fat diet,which was model 2 group. Sixty C57BL/6 male mice including 20 wild type mice and 40 ApoE-/- mice which was divided into normal diet fed group as model 3 and high fat diet group as model 4. After 6 months, plasma lipids and inflammatory factors were detected, and the aorta was separated for oil red O and hematoxylin-eosin (HE) staining. ResultsCompared with the normal group, plasma total cholesterol (TC), interleukin 6 (IL-6) and C reactive protein (CRP) levels were significantly elevated(P<0.05). But theres no difference between the three groups in plasma triglyceride (TG), low density lipoprotein cholesterol (LDL-C) and high density lipoprotein cholesterol (HDL-C) levels(P>0.05), and both of the two models didnt have atherosclerotic plaques and the characteristics of the early stages of atherosclerosis. In addition, compared with the normal group, plasma TC, TG, LDL-C, IL-6 and CRP levels of model 3 and model 4 were significantly elevated(P<0.05), and were significantly higher in model 4 than model 3(P<0.05). But plasma HDL-C levels of model 4 were significantly reduced(P<0.05). Oil red O and HE staining showed that model 3 only had lipid deposition and small atherosclerotic plaques in aortic arch; but the model 4 had developed typical characteristics of atherosclerosis.ConclusionBoth the two models of SD rats established with high cholesterol diets and high cholesterol diets + vitamin D3 were not suitable for atherosclerosis research;Model 3 only had the early stage atherosclerotic characteristics;Model 4 mice had developed typical characteristics of atherosclerosis and were more suitable for atherosclerosis research.
Key words:
Atherosclerosis; animal model; rat; mice
心血管疾病是当今世界造成死亡的最主要原因之一,2013年全球疾病负担研究估计心血管疾病导致的死亡人数约占总死亡人数的30%[1],预计到2030年心血管疾病死亡人数将高达2 300万人[2]。在我国心血管疾病造成的死亡率高达42%,目前估计全国共有心血管疾病患者2.9亿[3-4]。动脉粥样硬化(atherosclerosis,AS)是心血管疾病的病理基础,其发病机制非常复杂[5],目前尚不明确,因此尚无有效的根治方法,所以其预防及减缓显得尤为重要。随着医疗保健水平的提高,越来越多的具有抗AS作用的天然活性成分如木酚素[6]、绿原酸[7]和芎芍[8]等被相继开发出来,以此为原料的功能性食品也相继问世,对这些功能性食品的抗AS功效进行评价需要建立并选择合适的动物模型。目前用于建立AS模型的动物有大鼠、小鼠、猪、兔和灵长类动物等,其中猪类和猴类能够形成最接近于人类的AS病理特点,但是由于其个体大、成本高、造模时间长以及遗传研究困难等使其应用受到了限制[9]。兔类可由高脂和酪蛋白等不规则膳食诱导产生AS,而且高脂虽然能够诱导泡沫细胞产生,但是诱导AS晚期病变所需时间较长,而长期的高脂饮食诱导大量炎症反应和肝脏毒性,引起兔死亡率增加,而且这种大量炎症反应与人类AS的慢性炎症反应的发病机制相差较大[10]。而鼠类由于成本低、易于繁殖、基因操作方便以及能够定期监测AS等优点,是应用最多的动物模型[9]。本研究主要以SD大鼠和ApoE基因敲除(ApoE-/-)小鼠为研究对象建立AS模型,并通过相关生理指标检测选择最优的动物模型。
(鄂)2010-0028]。试验期间所有动物分笼饲养,其中大鼠每笼3只,小鼠每笼1只,室温(22±2) ℃,相对湿度50%~60%,自然昼夜节律,自由进食、饮水,试验周期为6个月。
对照组1为正常SD大鼠饲以正常基础饲料;模型组1为正常SD大鼠饲以AS饲料;模型组2为正常SD大鼠,试验开始时,将维生素D3溶于精炼植物油,一次性腹腔注射(600 000 IU/kg),然后饲以AS模型饲料。
对照组2为正常C57BL/6小鼠饲以正常基础饲料;模型组3为ApoE-/-小鼠饲以正常基础饲料;模型组4为ApoE-/-小鼠饲以AS模型饲料。
试验6个月后,各组动物禁食不禁水12 h,异氟烷麻醉,小鼠眼眶静脉丛取血,大鼠心脏取血,4 ℃下3 500 r/min离心15 min,分离血浆,-80 ℃保存备用。
如图2所示,模型组3和模型组4小鼠初始体质量差异无统计学意义(P>0.05),对照组2小鼠的体质量稍高,但三组间差异无统计学意义(P>0.05)。对照组2与模型组3小鼠的体质量随喂养时间的增长而出现递增的趋势,模型组4小鼠从第13周开始体质量明显高于C57BL/6对照小鼠,差异有统计学意义(P<0.05),并保持到试验结束。
如表3所示,与对照组2比较,模型组3和模型组4小鼠的血浆TC、TG和LDL-C均明显增高,差异有统计学意义(P<0.05);模型组4小鼠血浆HDL-C明显降低,差异有统计学意义(P<0.05);并且模型组4的血浆TC和LDL-C水平明显高于模型组3,差异有统计学意义(P<0.05)。
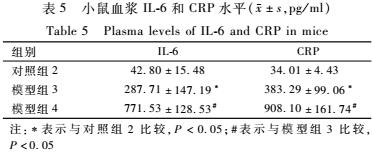
如表5所示,与对照组2比较,模型组3和模型组4动物的血浆IL-6和CRP均明显增高,差异有统计学意义(P<0.05);并且模型组4的血浆IL-6和CRP水平明显高于模型组3,差异有统计学意义(P<0.05)。
小鼠主动脉油红O染色(见图6)的结果表明:对照组2小鼠的主动脉未见脂质沉积现象,模型组3仅见少量的脂质沉积,而模型组4的主动脉可见极为明显的AS斑块,并且以主动脉弓和下腹部主动脉最为明显。小鼠主动脉圆管腔和主动脉根部HE染色(见图7、8)也显示对照组2小鼠成正常的管腔结构,内膜完整,未见泡沫细胞聚集,未见AS病变;模型组3的管腔内膜不完整,有少量的动脉粥样硬化斑块沉积,有少量的泡沫细胞。而模型组4的管腔可见血管壁明显增厚,内膜完整性破坏,内膜下有大量泡沫细胞浸润,形成明显的AS斑块。
研究表明钙离子可以作为平滑肌细胞的迁移和增殖以及细胞外基质分泌过程中的第二信使,促进AS的发展[11]。过量维生素D能够引起血钙升高,破坏动脉内膜完整性,诱导炎症细胞和脂质的聚集[12]。本研究主要采用高脂和高脂+维生素D3联合诱导建立模型组1和模型组2大鼠AS模型。Aubin等[13]采用高脂喂养SD大鼠8周后,其血浆TC、LDL-C、HDL-C和TG没有明显变化,这与本研究中模型组1大鼠血浆LDL-C、HDL-C和TG变化一致,但是模型组1大鼠血浆TC水平明显升高,可能与喂养时间较长有关系。有研究学者指出单纯的高脂饲料无法诱导大鼠AS产生,这在本研究中也得到证实。PANG等[14]采用7 000 000 IU/kg剂量的维生素D3连续灌胃4 d并以由4%胆固醇、1%胆酸、0.5%丙基硫氧嘧啶以及色拉油制成的乳剂连续喂养SD大鼠3个月后,SD大鼠主动脉内膜有明显的脂质沉积和AS斑块形成,其血浆TC、LDL-C水平明显升高。温进坤等[15]采用相同剂量的维生素D3连续灌胃3 d,并用含1%胆固醇、0.35%胆酸、5%猪油和0.61%丙基硫氧嘧啶的高脂饲料连续喂养SD大鼠21 d,结果大鼠主动脉出现内膜增生和脂质沉积、中膜平滑肌细胞增殖等AS病变。赵娟等[16]采用7 000 000 IU/kg剂量的维生素D3大鼠腹腔注射3次联合高脂饲料喂养4周,成功快速地复制了大鼠AS模型。本研究中采用一次性腹腔注射6 000 000 IU/kg维生素D3联合高脂饲料喂养SD大鼠6个月后,未能产生明显的AS病变,而且大剂量的维生素D3导致大鼠死亡率升高,体质量大幅度降低,组内个体差异增大,表明该方法可能不能建立稳定的SD大鼠AS模型,因此模型组2不适合用作AS研究的对象。
早在1992年,Plump等[17]成功建立了ApoE-/-小鼠AS模型并发现含4.5%脂肪的常规饲料即诱导ApoE-/-小鼠AS病变。刘剑刚等[18]分别采用普通饲料和高脂饲料诱导ApoE-/-小鼠AS模型,并分别研究15、19、24、28和36周龄ApoE-/-小鼠AS发展情况,结果表明随着时间的推移ApoE-/-小鼠AS程度逐渐加重,经历了从脂肪条纹到斑块形成的AS病理过程,但高脂组ApoE-/-小鼠AS病变程度严重。现在,ApoE-/-小鼠已经被广泛应用于各种AS相关研究[19-21]。本研究中,模型组3和模型组4动物的血浆TC、TG和LDL-C均明显增高,模型组4动物的血浆HDL-C明显降低,并且模型组4的血浆TC和LDL-C水平明显高于模型组3,差异均有统计学意义(P<0.05)。模型组3和模型组4的血浆炎症因子IL-6和CRP均明显增加,差异有统计学意义(P<0.05),但模型组4增加更为明显。此外,模型组3小鼠仅出现部分AS模型特点,而模型组4则发展为典型AS病理特点,而且在整个生长过程中体质量增长趋势平稳,个体间差异较小,适合作为AS研究的对象。
1材料与方法
1.1材料
1.1.1饲料
正常基础饲料和AS模型饲料均购自江苏省协同医药生物工程有限责任公司[许可证号:苏饲证(2014)01008]。饲料配方见表1。
1.1.2实验动物
60只8周龄雄性SD大鼠(225~250 g)、40只8周龄ApoE-/-雄性小鼠和20只相同遗传背景下野生型雄性8周龄C57BL/6小鼠(10~15 g),均购自于北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2012-0001]。所有动物饲养于华中科技大学同济医学院SPF屏障系统[许可证号:SYXK

|
表1动物饲料成分表(%) Table 1Contents of animal feed |
1.1.3主要仪器与试剂
1575洗板机(美国Bio-Rad)、Enspire酶标仪(美国PerkinElmer)、GT-X980扫描仪(日本Epson)。维生素D3、油红O和多聚甲醛均购自美国Sigma,甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)测定试剂盒均购自南京建成生物科技有限公司,白介素6(IL-6)和C反应蛋白(CRP)酶联免疫吸附测定试剂盒均购自美国Abcam。
1.2方法
1.2.1分组及处理
所有动物饲喂正常基础饲料,适应性喂养7 d后,根据体质量随机分组,每组20只。对照组1为正常SD大鼠饲以正常基础饲料;模型组1为正常SD大鼠饲以AS饲料;模型组2为正常SD大鼠,试验开始时,将维生素D3溶于精炼植物油,一次性腹腔注射(600 000 IU/kg),然后饲以AS模型饲料。
对照组2为正常C57BL/6小鼠饲以正常基础饲料;模型组3为ApoE-/-小鼠饲以正常基础饲料;模型组4为ApoE-/-小鼠饲以AS模型饲料。
试验6个月后,各组动物禁食不禁水12 h,异氟烷麻醉,小鼠眼眶静脉丛取血,大鼠心脏取血,4 ℃下3 500 r/min离心15 min,分离血浆,-80 ℃保存备用。
1.2.2一般观察
试验期间每周称1次动物体质量和剩食量,并作好记录,观察生理状况,记录动物存活情况。
1.2.3血浆脂质水平
试剂盒酶法测定血浆TC、TG、LDL-C和HDL-C。
1.2.4血浆CRP和IL-6的检测
采用酶联免疫吸附试剂盒测定CRP和IL-6,操作过程严格按照说明书进行。
1.2.5血管体视观察和整体油红O染色
每组随机取3只动物,以1%戊巴比妥钠(5 ml/kg)麻醉。打开胸腔后,用等渗生理盐水进行快速左心室灌注,冲净全身血液。待右心耳流出液体澄清时,将心脏、血管及肾脏留于原位。在体视显微镜下分离主动脉弓,沿脊柱前缘使用微型手术器械轻柔分离主动脉组织,小心剥离血管周围的脂肪组织,之后分离出整根主动脉(从与心脏连接处至双侧髂总动脉分支处)。使用微型剪刀插入主动脉管腔并纵向剪开整根血管,使整根血管的内壁充分暴露。用70%乙醇轻轻冲洗5 min,待乙醇挥发后,将整根血管浸入油红O溶液15 min,80%乙醇溶液分化,然后进行图像扫描。
1.2.6组织病理学检查
将主动脉固定于4%的多聚甲醛溶液,包埋切片,进行圆管腔和主动脉根部苏木精-伊红(HE)染色。
1.3统计学分析
体质量数据以平均数表示,其他数据均以平均数±标准差(±s)表示。采用SPSS 13.0软件对结果进行分析,采用单因素方差分析,用Fisher PLSD进行显著性差异检测。P<0.05为差异有统计学意义。
2结果
2.1体质量变化
如图1所示,各组大鼠初始体质量差异无统计学意义(P>0.05),对照组1和模型组1大鼠的体质量随喂养时间的增长而呈现递增的趋势。模型组2大鼠的体质量在第1周开始即低于对照组1和模型1,并且在以后持续降低,在第5周达到最低点。虽然之后体质量逐渐恢复,但到试验结束时仍然明显低于对照组1和模型组1。另外,维生素D3处理导致模型组2大鼠组的体质量明显增大,差异有统计学意义(P<0.05),同时导致数只大鼠死亡。
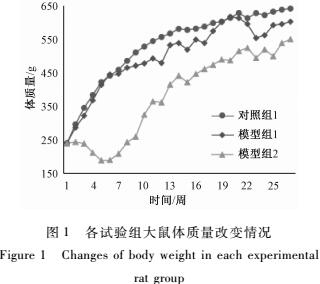
|
图1各试验组大鼠体质量改变情况 Figure 1Changes of body weight in each experimental rat group |

|
图2各试验组小鼠体质量改变情况 Figure 2Changes of body weight in each experimental mice group |
2.2血浆脂质变化
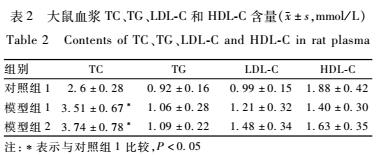
如表2所示,与对照组1比较,模型组1和模型组2大鼠的血浆TC明显增高,差异有统计学意义(P<0.05);但血浆TG、LDL-C和HDL-C没有明显改变,差异无统计学意义(P>0.05)。
|
表2大鼠血浆TC、TG、LDL-C和HDL-C含量(±s,mmol/L) Table 2Contents of TC、TG、LDL-C and HDL-C in rat plasma 注:*表示与对照组1比较,P<0.05 |

|
表3小鼠血浆TC、TG、LDL-C和HDL-C含量(±s,mmol/L) Table 3Contents of TC、TG、LDL-C and HDL-C in mice plasma 注:*表示与对照组2比较,P<0.05;#表示与模型组3比较,P<0.05 |
2.3血浆炎症因子改变
如表4所示,与对照组1大鼠比较,模型组1和模型组2大鼠的血浆炎症因子IL-6和CRP均明显增高,差异有统计学意义(P<0.05)。

|
表4大鼠血浆IL-6和CRP水平(±s ,pg/ml) Table 4Plasma levels of IL-6 and CRP in rats 注:*表示与对照组1比较,P<0.05 |
|
表5小鼠血浆IL-6和CRP水平(±s ,pg/ml) Table 5Plasma levels of IL-6 and CRP in mice 注:*表示与对照组2比较,P<0.05;#表示与模型组3比较,P<0.05 |
2.4形态学改变
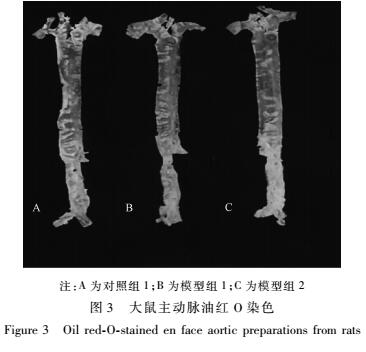
如图3所示,所有组别的大鼠主动脉油红O染色均未见明显的脂质沉积和脂质斑块。圆管腔和三尖瓣HE染色(见图4、5)可见所有组别内膜完整,未见泡沫细胞聚集,未见AS病变形成。注:A为对照组1;B为模型组1;C为模型组2
|
图3大鼠主动脉油红O染色 Figure 3Oil red-O-stained en face aortic preparations from rats 注:A为对照组1;B为模型组1;C为模型组2 |
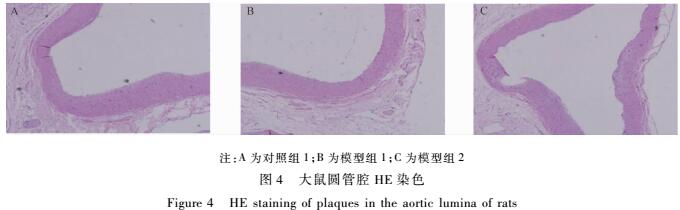
|
图4大鼠圆管腔HE染色 Figure 4HE staining of plaques in the aortic lumina of rats 注:A为对照组1;B为模型组1;C为模型组2 |
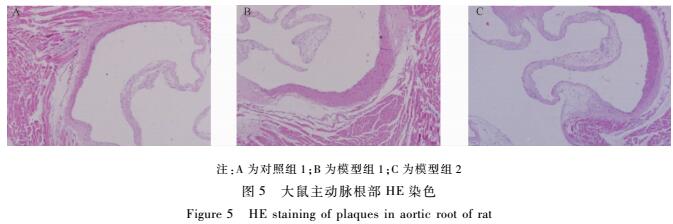
|
图5大鼠主动脉根部HE染色 Figure 5HE staining of plaques in aortic root of rat |
3讨论
选择合适的动物模型是进行功能性食品抗AS功效评价的重要前提,本研究主要在总结前人经验的基础上选择SD大鼠和ApoE-/-小鼠,建立AS模型。

|
注:A对照组2;B为模型组3;C为模型组4 图6小鼠主动脉油红O染色 Figure 6Oil red-O-stained en face aortic preparations from mice |
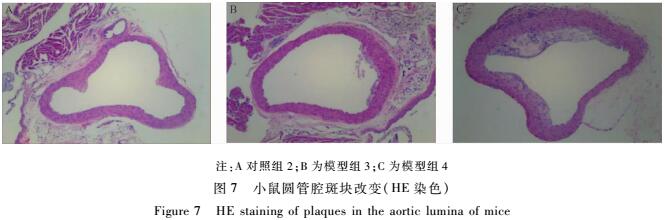
|
注:A对照组2;B为模型组3;C为模型组4 图7小鼠圆管腔斑块改变(HE染色) Figure 7HE staining of plaques in the aortic lumina of mice |
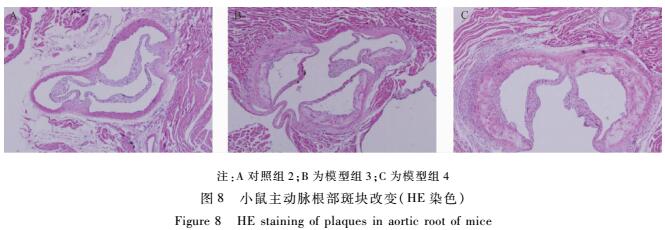
|
注:A对照组2;B为模型组3;C为模型组4 图8小鼠主动脉根部斑块改变(HE染色) Figure 8HE staining of plaques in aortic root of mice |
早在1992年,Plump等[17]成功建立了ApoE-/-小鼠AS模型并发现含4.5%脂肪的常规饲料即诱导ApoE-/-小鼠AS病变。刘剑刚等[18]分别采用普通饲料和高脂饲料诱导ApoE-/-小鼠AS模型,并分别研究15、19、24、28和36周龄ApoE-/-小鼠AS发展情况,结果表明随着时间的推移ApoE-/-小鼠AS程度逐渐加重,经历了从脂肪条纹到斑块形成的AS病理过程,但高脂组ApoE-/-小鼠AS病变程度严重。现在,ApoE-/-小鼠已经被广泛应用于各种AS相关研究[19-21]。本研究中,模型组3和模型组4动物的血浆TC、TG和LDL-C均明显增高,模型组4动物的血浆HDL-C明显降低,并且模型组4的血浆TC和LDL-C水平明显高于模型组3,差异均有统计学意义(P<0.05)。模型组3和模型组4的血浆炎症因子IL-6和CRP均明显增加,差异有统计学意义(P<0.05),但模型组4增加更为明显。此外,模型组3小鼠仅出现部分AS模型特点,而模型组4则发展为典型AS病理特点,而且在整个生长过程中体质量增长趋势平稳,个体间差异较小,适合作为AS研究的对象。
参考文献
[1]Bhatnagar P,Wickramasinghe K,Williams J,et al.The epidemiology of cardiovascular disease in the UK 2014[J].Heart,2015,101(15):1182-1189.
[2]Mathers C D,Loncar D.Projections of global mortality and burden of disease from 2002 to 2030[J].PLoS Med,2006,3(11):2011-2030.
[3]隋辉,陈伟伟,王文.《中国心血管病报告2014》要点介绍[J].中华高血压杂志,2015,23(7):627-629.
[4]陈伟伟,隋辉,马丽媛.中国心脑血管病流行现况及防治进展[J].心脑血管病防治,2016,16(2):79-83.
[5]Klingenberg R,Gerdes N,Badeau R M,et al.Depletion of FOXP3+ regulatory T cells promotes hypercholesterolemia and atherosclerosis[J].Journal of Clinical Investigation,2013,123(3):1323-1334.
[6]Prasad K.Flax lignan complex slows down the progression of atherosclerosis in hyperlipidemic rabbits[J].Journal of Cardiovascular Pharmacology and Therapeutics,2009,14(1):38-48.
[7]Loke W M,Proudfoot J M,Hodgson J M,et al.Specific dietary polyphenols attenuate atherosclerosis in apolipoprotein E-knockout mice by alleviating inflammation and endothelial dysfunction[J].Arteriosclerosis Thrombosis & Vascular Biology,2010,30(4):749-757.
[8]ZHANG Y H,ZHANG Y,LI J,et al.Protective effects of Xiongshao Capsule on anti-inflammatory function of high-density lipoprotein in atherosclerosis rabbit model[J].Chinese Journal of Integrative Medicine,2015:1-5.
[9]Getz G S,Reardon C A.Animal models of atherosclerosis[J].Arteriosclerosis Thrombosis & Vascular Biology,2012,32(5):1104-1115.
[10]Grundtman C.Animal models of atherosclerosis[M].Springer Vienna,2012:133-169.
[11]Krarnsch D M.Atherosclerosis progression/regression:lipoprotein and vessel wall determinants[J].Atherosclerosis,1995,118(1):29-36.
[12]Bennani-Kabchi N,Kehel L,El Bouayadi F,et al.New model of atherosclerosis in insulin resistant sand rats:hypercholesterolemia combined with D2 vitamin[J].Atherosclerosis,2000,150(1):55-61.
[13]Aubin M C,Lajoie C,Clement R,et al.Female rats fed a high-fat diet were associated with vascular dysfunction and cardiac fibrosis in the absence of overt obesity and hyperlipidemia: therapeutic potential of resveratrol[J].Journal of Pharmacology and Experimental Therapeutics,2008,325(3):961-968.
[14]PANG J J,XU Q H,XU X B,et al.Hexarelin suppresses high lipid diet and vitamin D3-induced atherosclerosis in the rat[J].Peptides,2010,31(4):630-638.
[15]温进坤,韩梅,杜玮南,等.一种快速建立大鼠动脉粥样硬化模型的实验方法[J].中国老年学杂志,2001,21(1):50-52.
[16]赵娟,李相军,孙波,等.维生素D3联合高脂饲料建立大鼠动脉粥样硬化模型[J].实用医学杂志,2009,25(21):3569-3571.
[17]Plump A S,Smith J D,Hayek T,et al.Severe hyperchol-esterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells[J].Cell,1992,71(2):343-353.
[18]刘剑刚,董国菊,史大卓,等.载脂蛋白E基因敲除小鼠不同周龄动脉粥样硬化的病理变化[J].中国动脉硬化杂志,2005,13(6):689-692.
[19]Kyaw T,Tay C,Hosseini H,et al.Depletion of B2 but Not B1a B cells in BAFF receptor-deficient ApoE-/-mice attenuates atherosclerosis by potently ameliorating arterial inflammation[J].PLoS One,2012,7(1):1-10.
[20]Ketelhuth D F J,Hermansson A,Hlawaty H,et al.The leukotriene B4 receptor(BLT)antagonist BIIL284 decreases atherosclerosis in ApoE-/- mice[J].Prostaglandins & Other Lipid Mediators,2015,121(5):105-109.
[21]LI J,LIN S Q,Vanhoutte P M,et al.Akkermansia muciniphila protects against atherosclerosis by preventing metabolic endotoxemia-induced inflammation in Apoe-/- mice[J].Circulation,2016,133(24):2434-2446.
[2]Mathers C D,Loncar D.Projections of global mortality and burden of disease from 2002 to 2030[J].PLoS Med,2006,3(11):2011-2030.
[3]隋辉,陈伟伟,王文.《中国心血管病报告2014》要点介绍[J].中华高血压杂志,2015,23(7):627-629.
[4]陈伟伟,隋辉,马丽媛.中国心脑血管病流行现况及防治进展[J].心脑血管病防治,2016,16(2):79-83.
[5]Klingenberg R,Gerdes N,Badeau R M,et al.Depletion of FOXP3+ regulatory T cells promotes hypercholesterolemia and atherosclerosis[J].Journal of Clinical Investigation,2013,123(3):1323-1334.
[6]Prasad K.Flax lignan complex slows down the progression of atherosclerosis in hyperlipidemic rabbits[J].Journal of Cardiovascular Pharmacology and Therapeutics,2009,14(1):38-48.
[7]Loke W M,Proudfoot J M,Hodgson J M,et al.Specific dietary polyphenols attenuate atherosclerosis in apolipoprotein E-knockout mice by alleviating inflammation and endothelial dysfunction[J].Arteriosclerosis Thrombosis & Vascular Biology,2010,30(4):749-757.
[8]ZHANG Y H,ZHANG Y,LI J,et al.Protective effects of Xiongshao Capsule on anti-inflammatory function of high-density lipoprotein in atherosclerosis rabbit model[J].Chinese Journal of Integrative Medicine,2015:1-5.
[9]Getz G S,Reardon C A.Animal models of atherosclerosis[J].Arteriosclerosis Thrombosis & Vascular Biology,2012,32(5):1104-1115.
[10]Grundtman C.Animal models of atherosclerosis[M].Springer Vienna,2012:133-169.
[11]Krarnsch D M.Atherosclerosis progression/regression:lipoprotein and vessel wall determinants[J].Atherosclerosis,1995,118(1):29-36.
[12]Bennani-Kabchi N,Kehel L,El Bouayadi F,et al.New model of atherosclerosis in insulin resistant sand rats:hypercholesterolemia combined with D2 vitamin[J].Atherosclerosis,2000,150(1):55-61.
[13]Aubin M C,Lajoie C,Clement R,et al.Female rats fed a high-fat diet were associated with vascular dysfunction and cardiac fibrosis in the absence of overt obesity and hyperlipidemia: therapeutic potential of resveratrol[J].Journal of Pharmacology and Experimental Therapeutics,2008,325(3):961-968.
[14]PANG J J,XU Q H,XU X B,et al.Hexarelin suppresses high lipid diet and vitamin D3-induced atherosclerosis in the rat[J].Peptides,2010,31(4):630-638.
[15]温进坤,韩梅,杜玮南,等.一种快速建立大鼠动脉粥样硬化模型的实验方法[J].中国老年学杂志,2001,21(1):50-52.
[16]赵娟,李相军,孙波,等.维生素D3联合高脂饲料建立大鼠动脉粥样硬化模型[J].实用医学杂志,2009,25(21):3569-3571.
[17]Plump A S,Smith J D,Hayek T,et al.Severe hyperchol-esterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells[J].Cell,1992,71(2):343-353.
[18]刘剑刚,董国菊,史大卓,等.载脂蛋白E基因敲除小鼠不同周龄动脉粥样硬化的病理变化[J].中国动脉硬化杂志,2005,13(6):689-692.
[19]Kyaw T,Tay C,Hosseini H,et al.Depletion of B2 but Not B1a B cells in BAFF receptor-deficient ApoE-/-mice attenuates atherosclerosis by potently ameliorating arterial inflammation[J].PLoS One,2012,7(1):1-10.
[20]Ketelhuth D F J,Hermansson A,Hlawaty H,et al.The leukotriene B4 receptor(BLT)antagonist BIIL284 decreases atherosclerosis in ApoE-/- mice[J].Prostaglandins & Other Lipid Mediators,2015,121(5):105-109.
[21]LI J,LIN S Q,Vanhoutte P M,et al.Akkermansia muciniphila protects against atherosclerosis by preventing metabolic endotoxemia-induced inflammation in Apoe-/- mice[J].Circulation,2016,133(24):2434-2446.
 田光晶,马丛丛,许继取.动脉粥样硬化动物模型筛选[J].中国食品卫生杂志,2017,29(1):26-31.
田光晶,马丛丛,许继取.动脉粥样硬化动物模型筛选[J].中国食品卫生杂志,2017,29(1):26-31.