DOi:10.13590/j.cjfh.2017.01.009
一起疑似食源性诺如病毒胃肠炎事件病原分子生物学特征分析
(厦门市思明区疾病预防控制中心,福建 厦门361009)
作者简介: 王坤明男主管技师研究方向为病原微生物检验 E-mail:619352369@qq.com
通信作者: 柯明月女主任技师研究方向为卫生检验 E-mail:kmy1973@163.com
收稿日期: 2016-10-20
摘要:目的 研究厦门市思明区一起聚集性胃肠炎事件的诺如病毒的分子生物学特征。方法将收集到的11份肛拭子标本及1份生蚝样品,采用实时荧光定量逆转录-聚合酶链反应(RT-PCR)方法检测诺如病毒核酸,阳性标本再进行实时荧光定量RT-PCR扩增,扩增产物经过凝胶电泳分析后,进行序列测定,确定基因型,并进行系统发育树分析。结果11份肛拭子标本中检出5株GI组诺如病毒株,2株测序成功,检出4株GII组毒株,3株测序成功;1份生蚝样品中检出1株GI组毒株,测序成功。对测序成功的6株毒株进行同源性分析,GI.2型毒株所测序列与2014年上海株KP325648等6株参考株高度同源,GII.17型毒株所测序列与2015年韩国株KT384078等8株参考株高度同源,证实这是一起由GI.2和GII.17型诺如病毒混合感染引起的聚集性胃肠炎事件,GII.17型毒株为厦门市首次报道。结论此次聚集性胃肠炎事件是由诺如病毒引起,且为GI.2与GII.17型毒株混合感染引起。
关键词:
诺如病毒; 胃肠炎; 生蚝; 基因型; 系统发育树; 厦门; 思明区; 食源性疾病
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)01-0042-00
Pathogenic molecular biological characteristics analysis of
a suspected foodborne Norovirus gastroenteritis incident
a suspected foodborne Norovirus gastroenteritis incident
(Siming District Center for Disease Control and Prevention of Xiamen,Fujian Xiamen 361009,China)
Abstract: Objective To analyze the molecular biological characteristics of Norovirus from a gastroenteritis incident in Siming District.MethodsEleven anal swab specimens and one oyster samples were collected and fluorescence quantitative reverse transcription polymerase chain reaction (RT-PCR) method was applied to detect Norovirus. The positive samples were amplified by RT-PCR, and amplified products were used for gel electrophoresis analysis and sequencing to determine the genotype and to make phylogenetic trees analysis. ResultsTwo strains of GI Norovirus were detected from 11 anal swab specimens, and both were successfully sequenced. Four strains of GII were detected, and 3 strains were successfully sequenced. One strain of GI was detected from the oyster, and was successfully sequenced. Six positive strains successfully sequenced were further homology analyzed. The sequence of the GI.2 strain were highly homologous with the reference strains of KP325648 etc. collected from Shanghai in 2014. The sequence of GII.17 strain were highly homologous with the reference strains of KT384078 etc. collected from South Korea in 2015. GII.17 strain was reported for the first time in Xiamen.ConclusionThe aggregated gastroenteritis incident was caused by mixed infection of GI.2 and GII.17 Norovirus.
Key words:
Norovirus; gastroenteritis; oyster; genotype; phylogenetic tree; Xiamen; Siming District; foodborne diseases
诺如病毒(Norovirus,NoV)属于人类杯状病毒科,感染性强,少量(10~100个)的病毒粒子即可引发感染[1],可通过污染的水或食物经粪-口途径传播,是引起急性非细菌性肠胃炎暴发的重要病原体[2-3],世界卫生组织(WHO)已将其定为B类病原[4]。NoV感染性胃肠炎多发于冬春季节,易呈聚集性。2016年2月,厦门市思明区发生一起杭州赴厦门旅游团疑似食源性聚集性胃肠炎事件,多名游客出现以呕吐、腹泻为主的胃肠炎症状,经流行病学调查和实验室检测,确认由NoV引起,本研究主要对引起本次事件的病原进行分子生物学特征分析。
一步法NoV GI、GII型核酸荧光RT-PCR检测试剂盒(上海之江生物科技有限公司),Roche High Pure Viral RNA Kit试剂盒(罗氏公司),甘氨酸缓冲液(配方含0.05 mol/L甘氨酸,0.15 mol/L氯化钠,pH=9.5,批号:212F065),16%聚乙二醇6 000溶液(配方含0.3 mol/L氯化钠,16%聚乙二醇6 000,批号:1226A033),Rnase/Dnase-free Water(批号:LZ-0518S14014L)。
生蚝:用手术剪刀开壳,尽量去除外膜及消化腺周围的脂肪组织等,取消化腺约3 g,置于中速匀浆器匀浆1 min,将匀浆液放入灭菌的均质袋中,加入7倍体积0.05 mol/L甘氨酸缓冲液,室温下充分振荡后分装于50 ml离心管中,4 ℃ 3 000×g离心30 min。将上清液转移至新的50 ml离心管中,调pH值至7.5,加入等体积16% 聚乙二醇6 000溶液,轻微混匀,4 ℃沉淀4 h后,4 ℃ 3 000×g离心30 min。弃上清,沉淀,用1.5 ml 0.15 mol /L Na2HPO4溶液重悬,室温下100 r/min振荡20 min后,分装于1.5 ml的无RNA酶的离心管中,4 ℃ 10 000×g 离心30 min。将上清液移至新的1.5 ml无RNA酶的离心管中,并调节pH值至7.4即为RNA粗提液,备用。
仪器扩增反应条件:45 ℃逆转录10 min;95 ℃变性15 min;95 ℃变性15 s,60 ℃退火1 min,40个循环,羧基荧光素(FAM)通道检测荧光。
结果判定:当质控对照正常,样品Ct值<36时,判为阳性;Ct值>38时,判为阴性;36<Ct值<38时,判为可疑,需再次检测,若Ct值≤38,判为阳性,否则判为阴性。
本研究在涉事游客中检出3株GII.17型毒株,这是厦门地区首次报道检出GII.17型毒株,与2015年韩国株KT384078等2株参考株同源性100%,与2015年南阳株KT992789等6株参考株同源性99%,均属于同一进化分支,表明该株与上述参考株高度同源,该株及变异株正在成为我国及周边国家的优势株,有进一步流行的可能[15]。由于厦门地区历史流行优势株为GII.4型[16],人群对GII.17型普遍缺乏免疫力,其有可能在思明区流行并成为优势株,这些有待今后进一步跟进NoV胃肠炎事件调查和病原分子生物学的分析研究。这也提示疾病防控相关部门,应加大GII.17型NoV株的监测,密切注意其流行动态。
在涉事游客中检出的2株GI.2型毒株和在生蚝样品中检出的1株GI.2型毒株,与2014年上海株KP325648等3株参考株同源性100%,与2015年韩国株KT383951等2株参考株同源性99%。该事件5名患者发病时间分布情况提示单一同源感染,根据NoV潜伏期,结合此次事件的发病高峰,推断感染餐次为食用烤生蚝的当餐,而在与涉事烤生蚝同一货源的生蚝中检出与涉事游客感染的NoV序列比对同源性100%、基因型一致的病毒株,可以推断此次事件极有可能是食用被NoV污染的烤生蚝引起。生蚝的消化腺能富集外源性致病因子,包括NoV等[17],国外已有多起因食用生蚝引起的NoV感染事件的报道[18-19],但国内尚未有在食源性NoV胃肠炎事件的食材中检出NoV并进行分型的报道。此次事件从与涉事同一来源的生蚝中检出与患者同源性一致的病毒株,进一步印证了厦门地区存在食用受污染生蚝引发食源性疾病的风险。
需要指出的是,在涉事游客中检出GI.2型和GII.17型,而在生蚝样品中仅检出GI.2型,未检出GII.17型,这可能是因为生蚝样品的均匀性问题,使得所取样品未含有GII.17型,或含量低于本研究所用方法的检出限,导致检测结果阴性。
厦门地区市售生蚝NoV污染较为普遍,污染水平较高,生蚝又是该地区消费量最大的海产品之一,由污染生蚝介导引发食源性疾病的风险较高[20],有关部门应该引起足够重视,采取必要的预防控制措施。相关执法部门应加强对餐饮业的监督执法,加大卫生宣传力度,加强餐饮从业者食品安全培训,提高食品安全卫生意识,注意食材的加工制作,特别是生蚝等贝类海产品应该彻底煮熟、烤熟,做到生熟分开,防止交叉污染;及时将患病的餐饮从业人员调离岗位,防止污染食品;同时引导消费者养成良好的饮食习惯,不吃生或半生的生蚝等海产品,减小NoV感染风险。
1材料与方法
1.1材料
1.1.1病例定义
该旅游团共6名游客,本次事件将病例定义为“2016年2月16~19日,该旅行团中,出现腹泻(≥3次/d伴粪便性状改变)或呕吐(≥1次/d),且伴有发热、恶心、腹痛等其他症状之一者”,根据此标准确定5名患者。
1.1.2样本
共采集5名患者、1名同行游客无症状者和5名无症状厨师肛拭子,并采集与可疑餐次同货源的生蚝样品1份(10个)。
1.1.3对照品
阳性对照品为本实验室保存的NoV GI、GII型阳性粪便标本,阴性对照品为本实验室保存的NoV GI、GII型阴性粪便标本。
1.1.4主要仪器与试剂
7500实时荧光定量PCR仪(美国ABI)、旋涡振荡器、匀浆器。一步法NoV GI、GII型核酸荧光RT-PCR检测试剂盒(上海之江生物科技有限公司),Roche High Pure Viral RNA Kit试剂盒(罗氏公司),甘氨酸缓冲液(配方含0.05 mol/L甘氨酸,0.15 mol/L氯化钠,pH=9.5,批号:212F065),16%聚乙二醇6 000溶液(配方含0.3 mol/L氯化钠,16%聚乙二醇6 000,批号:1226A033),Rnase/Dnase-free Water(批号:LZ-0518S14014L)。
1.2方法
1.2.1样本处理
肛拭子:放入1 ml磷酸盐缓冲液中,经旋涡振荡器混匀,标本悬液经12 000 r/min高速离心15 min后,吸取上清液于1.5 ml离心管即为RNA粗提液,备用。生蚝:用手术剪刀开壳,尽量去除外膜及消化腺周围的脂肪组织等,取消化腺约3 g,置于中速匀浆器匀浆1 min,将匀浆液放入灭菌的均质袋中,加入7倍体积0.05 mol/L甘氨酸缓冲液,室温下充分振荡后分装于50 ml离心管中,4 ℃ 3 000×g离心30 min。将上清液转移至新的50 ml离心管中,调pH值至7.5,加入等体积16% 聚乙二醇6 000溶液,轻微混匀,4 ℃沉淀4 h后,4 ℃ 3 000×g离心30 min。弃上清,沉淀,用1.5 ml 0.15 mol /L Na2HPO4溶液重悬,室温下100 r/min振荡20 min后,分装于1.5 ml的无RNA酶的离心管中,4 ℃ 10 000×g 离心30 min。将上清液移至新的1.5 ml无RNA酶的离心管中,并调节pH值至7.4即为RNA粗提液,备用。
1.2.2核酸提取与实时荧光定量RT-PCR检测
将RNA粗提液用Roche High Pure Viral RNA Kit试剂盒按照说明书吸附柱法提取病毒RNA。采用实时荧光定量RT-PCR法进行检测,使用一步法NoV GI、GII核酸荧光RT-PCR检测试剂盒。按照试剂盒说明书配制试剂,设置质控对照(包括阳性、阴性、空白对照)。仪器扩增反应条件:45 ℃逆转录10 min;95 ℃变性15 min;95 ℃变性15 s,60 ℃退火1 min,40个循环,羧基荧光素(FAM)通道检测荧光。
结果判定:当质控对照正常,样品Ct值<36时,判为阳性;Ct值>38时,判为阴性;36<Ct值<38时,判为可疑,需再次检测,若Ct值≤38,判为阳性,否则判为阴性。
1.2.3核酸扩增与测序
根据实时荧光定量RT-PCR基因组检测结果,对样本RNA提取液进行基因关键区域ORF2(VP1衣壳蛋白区)实时荧光定量RT-RCR核酸扩增,GI、GII组引物序列见表1,引物由上海生工生物工程股份有限公司合成。扩增后进行琼脂糖凝胶电泳分析,阳性扩增产物送上海生工生物工程股份有限公司测序。

|
表1NoV GI、GII组扩增引物[5]
Table 1NoV GI、GII group amplification primer
|
1.2.4序列分析
应用NoV基因分型工具(http://www.rivm.nl/mpf/norovirus/typingtool#/)将测序成功的序列进行基因分型,同时将获得的序列应用BLAST在GenBank寻找相近序列。应用Mega 5.1软件ClustalW进行序列的比对和分析;并应用Mega 5.1软件Neighbor-Joining法构建系统发育树,参考株均来自于GenBank数据库。
2结果
2.1NoV检出情况
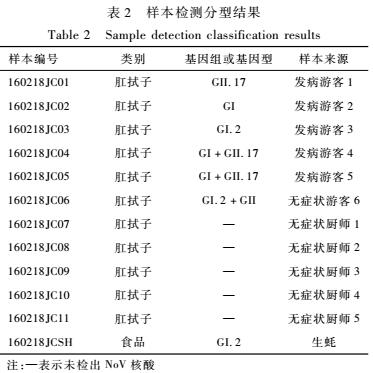
实时荧光定量RT-PCR检测11份肛拭子标本,6份游客肛拭子全部检出NoV,其中3份为GI和GII组、2份为GI组、1份为GII组;5份无症状厨师肛拭子均未检出NoV;1份牡蛎样品中,检出GI组NoV。
2.2NoV基因分型
将检出的10株NoV PCR产物进行测序,6株测序成功,将获得的序列用NoV基因在线分型工具分型,6份游客肛拭子检出2株GI.2型毒株,3株GII.17型毒株;1份生蚝样品检出1株GI.2型毒株。见表2。
|
表2样本检测分型结果
Table 2Sample detection classification results
注:—表示未检出NoV核酸 |
2.3NoV VP1基因同源性和系统发育数分析
2.3.1GI、GII组毒株序列比对
分别将GI、GII组毒株序列进行序列比对,结果显示:游客肛拭子标本160218JC03、160218JC06与生蚝160218JCSH同源性为100%,均为GI.2型;游客肛拭子标本160218JC01、160218JC04、160218JC05核苷酸序列同源性为100%,均为GII.17型。将序列提交到GenBank数据库与参考株进行同源性分析,3株GI组株与2014年上海株KP325648、2013年荆州株KF306212、2013年湖州株KM462611同源性100%,与2015年韩国株KT383951、2016年日本株LC128710同源性99%,与1996年英国株AJ277610同源性97%;3株GII组株与2015年韩国株KT384078、2015年中国香港株KT780416同源性100%,与2015年南阳株KT992789、2015年广州株KT970377、2015年中国台湾彰化株KR052020、2014年美国盖瑟斯堡株KR083017、2015年韩国株KU561256、2015年日本川崎株LC037415同源性99%。
2.3.2GI、GII组系统发育树分析
GI、GII组系统发育树分析结果显示:3株GI组株与上海株KP325648、荆州株KF306212、湖州株KM462611、韩国株KT383951及日本株LC128710亲缘关系较近,处于同一个进化簇内,同属于一个进化分支,均为GI.2型,
见图1。3株GII组株与韩国株KT384078、中国香港株KT780416、南阳株KT992789、广州株KT970377、中国台湾株彰化株KR052020、美国盖瑟斯堡株KR083017、韩国株KU561256、日本川崎株LC037415处于同一进化簇,同属于一个进化分支,均为GII.17型,
见图2。
见图1。3株GII组株与韩国株KT384078、中国香港株KT780416、南阳株KT992789、广州株KT970377、中国台湾株彰化株KR052020、美国盖瑟斯堡株KR083017、韩国株KU561256、日本川崎株LC037415处于同一进化簇,同属于一个进化分支,均为GII.17型,
见图2。

|
图1NoV GI组VP1核苷酸序列系统发育树
Figure 1NoV GI group VP1 nucleotide sequence phylogenetic tree
|

|
图2NoV GII组VP1核苷酸序列系统发育树
Figure 2NoV GII group VP1 nucleotide sequence phylogenetic tre
|
3讨论
NoV基因组包含3个开放阅读框(Open reading frames,ORFs)。ORF1编码非结构蛋白,包括RNA聚合酶(RNA-dependent RNA polymerase,RdRp);ORF2和ORF3分别编码主要(VP1)和次要(VP2)衣壳蛋白。根据抗原性和核苷酸序列的变异程度可分成5个基因组(genogroup,GI-GⅤ),其中GI组有8个基因型,GII组有21个基因型,GI和GII组是感染人类的主要基因组。本研究在涉事游客中检出2株GI.2型毒株,序列比对同源性为100%;在涉事游客中检出3株GII.17型毒株,序列比对同源性为100%。结合流行病学调查、患者的临床表现,确认这是一起由GI.2和GII.17型NoV混合感染引起的胃肠炎事件,进一步验证了思明区胃肠炎事件存在GI和GII混合感染的报道[6]。GII.4型一直是国内NoV胃肠炎的主要流行株[4,7-8],但近年来GII.17型NoV引起的胃肠炎报道也日益增多[9-11],而GII.2[12]、GII.3[13]、GI.2[14]等型也有报道。本研究在涉事游客中检出3株GII.17型毒株,这是厦门地区首次报道检出GII.17型毒株,与2015年韩国株KT384078等2株参考株同源性100%,与2015年南阳株KT992789等6株参考株同源性99%,均属于同一进化分支,表明该株与上述参考株高度同源,该株及变异株正在成为我国及周边国家的优势株,有进一步流行的可能[15]。由于厦门地区历史流行优势株为GII.4型[16],人群对GII.17型普遍缺乏免疫力,其有可能在思明区流行并成为优势株,这些有待今后进一步跟进NoV胃肠炎事件调查和病原分子生物学的分析研究。这也提示疾病防控相关部门,应加大GII.17型NoV株的监测,密切注意其流行动态。
在涉事游客中检出的2株GI.2型毒株和在生蚝样品中检出的1株GI.2型毒株,与2014年上海株KP325648等3株参考株同源性100%,与2015年韩国株KT383951等2株参考株同源性99%。该事件5名患者发病时间分布情况提示单一同源感染,根据NoV潜伏期,结合此次事件的发病高峰,推断感染餐次为食用烤生蚝的当餐,而在与涉事烤生蚝同一货源的生蚝中检出与涉事游客感染的NoV序列比对同源性100%、基因型一致的病毒株,可以推断此次事件极有可能是食用被NoV污染的烤生蚝引起。生蚝的消化腺能富集外源性致病因子,包括NoV等[17],国外已有多起因食用生蚝引起的NoV感染事件的报道[18-19],但国内尚未有在食源性NoV胃肠炎事件的食材中检出NoV并进行分型的报道。此次事件从与涉事同一来源的生蚝中检出与患者同源性一致的病毒株,进一步印证了厦门地区存在食用受污染生蚝引发食源性疾病的风险。
需要指出的是,在涉事游客中检出GI.2型和GII.17型,而在生蚝样品中仅检出GI.2型,未检出GII.17型,这可能是因为生蚝样品的均匀性问题,使得所取样品未含有GII.17型,或含量低于本研究所用方法的检出限,导致检测结果阴性。
厦门地区市售生蚝NoV污染较为普遍,污染水平较高,生蚝又是该地区消费量最大的海产品之一,由污染生蚝介导引发食源性疾病的风险较高[20],有关部门应该引起足够重视,采取必要的预防控制措施。相关执法部门应加强对餐饮业的监督执法,加大卫生宣传力度,加强餐饮从业者食品安全培训,提高食品安全卫生意识,注意食材的加工制作,特别是生蚝等贝类海产品应该彻底煮熟、烤熟,做到生熟分开,防止交叉污染;及时将患病的餐饮从业人员调离岗位,防止污染食品;同时引导消费者养成良好的饮食习惯,不吃生或半生的生蚝等海产品,减小NoV感染风险。
参考文献
[1]Glass R I,Noel J,Ando T,et al.The epidemiology of enteric Caliciviruses from humans:a reassessment using new diagnostics[J].J Infect Dis,2000,181(2):254-261.
[2]周晓红,李晖,杨杏芬.食源性及水源性诺如病毒研究进展[J].中国公共卫生,2010,26(9):1213-1214.
[3]靳淼,孙军玲,常昭瑞,等.中国2006—2007年诺如病毒胃肠炎暴发及其病原学特征分析[J].中华流行病学杂志,2010,31(5):549-553.
[4]吴清平,薛亮,张菊梅.诺如病毒流行株GII.4型进化研究进展[J].微生物学报,2012,52(12):1431-438.
[5]廖巧红,冉陆,靳淼,等.诺如病毒感染暴发调查和预防控制技术指南(2015版)[J].中华预防医学杂志,2016,50(1):7-16.
[6]王坤明,陈佳璐,柯明月,等.思明区2013—2015年诺如病毒聚集性胃肠炎基因群分布特征[J].海峡预防医学杂志,2016,22(1):28-30.
[7]许灵波.诺如病毒GII.4型流行株基因序列分析和流行病学研究[J].中国病原生物学杂志,2014,9(7):607-612.
[8]周永康,靳淼,李宇宁,等.GII.4型诺如病毒的进化及疫苗研究进展[J].中国科学:生命科学,2015,45(12):1185-1193.
[9]陆剑勇,戴传文,邱星元,等.一起GII.17型诺如病毒感染性胃肠炎暴发疫情流行病学调查[J].职业与健康,2015,31(17):2431-2433.
[10]荆红波,张爽,邵占涛,等.一起GII.17型诺如病毒感染疫情的分子流行病学分析[J].中国卫生检验杂志,2015(21):3697-3699.
[11]那永东,乙引.诺如病毒GII.17型在盘锦地区的检出和鉴定[J].中国卫生检验杂志,2015,25(22):3861-3862.
[12]沈纪川,刘于飞,李巧艳,等.2008年广州市婴幼儿诺如病毒感染流行特征及基因型研究[J].华南预防医学,2010,36(5):1-4.
[13]李静,李国明,张婷,等.2012—2013年湖北省襄阳地区病毒性腹泻的病原学分析[J].中国预防医学杂志,2015,16(4):245-251.
[14]纪蕾,吴晓芳,徐德顺,等.湖州市非细菌性急性胃肠炎暴发中诺如病毒的分子生物学特点初步研究[J].病毒学报,2011,27(5):469-474.
[15]荆红波,张爽,邵占涛,等.一起GII.17型诺如病毒感染疫情的分子流行病学分析[J].中国卫生检验杂志,2015,25(21):3697-3699.
[16]陈智浩,黄革玲,陈小丽,等.厦门地区婴幼儿腹泻诺如病毒的基因分型研究[J].中国卫生检验杂志,2012,22(11):2654-2656.
[17]Metcalf T G,Melnick J L,Estes M K.Environmental virology:from detection of virus in sewage and water by isolation to identification by molecular biology-a trip of over 50 years[J].Annu Rev Microbiol,1995,49(2):461-487.
[18]Shieh Y,Monroe S S,Fankhauser R L,et al.Detection of Norwalk-like virus in shellfish implicated in illness[J].J Infect Dis,2000,181(2):360-366.
[19]Westrell T,Dusch V,Ethelberg S,et al.Norovirus outbreaks linked to oyster consumption in the United Kingdom,Norway,France,Sweden and Denmark,2010[J].Euro Surveill,2010,15(12):8-11.
[20]柯明月,王坤明,陈佳璐,等.2014年厦门地区市售牡蛎诺如病毒污染状况调查分析[J].中国卫生检验杂志,2015,25(10):1634-1637.
[2]周晓红,李晖,杨杏芬.食源性及水源性诺如病毒研究进展[J].中国公共卫生,2010,26(9):1213-1214.
[3]靳淼,孙军玲,常昭瑞,等.中国2006—2007年诺如病毒胃肠炎暴发及其病原学特征分析[J].中华流行病学杂志,2010,31(5):549-553.
[4]吴清平,薛亮,张菊梅.诺如病毒流行株GII.4型进化研究进展[J].微生物学报,2012,52(12):1431-438.
[5]廖巧红,冉陆,靳淼,等.诺如病毒感染暴发调查和预防控制技术指南(2015版)[J].中华预防医学杂志,2016,50(1):7-16.
[6]王坤明,陈佳璐,柯明月,等.思明区2013—2015年诺如病毒聚集性胃肠炎基因群分布特征[J].海峡预防医学杂志,2016,22(1):28-30.
[7]许灵波.诺如病毒GII.4型流行株基因序列分析和流行病学研究[J].中国病原生物学杂志,2014,9(7):607-612.
[8]周永康,靳淼,李宇宁,等.GII.4型诺如病毒的进化及疫苗研究进展[J].中国科学:生命科学,2015,45(12):1185-1193.
[9]陆剑勇,戴传文,邱星元,等.一起GII.17型诺如病毒感染性胃肠炎暴发疫情流行病学调查[J].职业与健康,2015,31(17):2431-2433.
[10]荆红波,张爽,邵占涛,等.一起GII.17型诺如病毒感染疫情的分子流行病学分析[J].中国卫生检验杂志,2015(21):3697-3699.
[11]那永东,乙引.诺如病毒GII.17型在盘锦地区的检出和鉴定[J].中国卫生检验杂志,2015,25(22):3861-3862.
[12]沈纪川,刘于飞,李巧艳,等.2008年广州市婴幼儿诺如病毒感染流行特征及基因型研究[J].华南预防医学,2010,36(5):1-4.
[13]李静,李国明,张婷,等.2012—2013年湖北省襄阳地区病毒性腹泻的病原学分析[J].中国预防医学杂志,2015,16(4):245-251.
[14]纪蕾,吴晓芳,徐德顺,等.湖州市非细菌性急性胃肠炎暴发中诺如病毒的分子生物学特点初步研究[J].病毒学报,2011,27(5):469-474.
[15]荆红波,张爽,邵占涛,等.一起GII.17型诺如病毒感染疫情的分子流行病学分析[J].中国卫生检验杂志,2015,25(21):3697-3699.
[16]陈智浩,黄革玲,陈小丽,等.厦门地区婴幼儿腹泻诺如病毒的基因分型研究[J].中国卫生检验杂志,2012,22(11):2654-2656.
[17]Metcalf T G,Melnick J L,Estes M K.Environmental virology:from detection of virus in sewage and water by isolation to identification by molecular biology-a trip of over 50 years[J].Annu Rev Microbiol,1995,49(2):461-487.
[18]Shieh Y,Monroe S S,Fankhauser R L,et al.Detection of Norwalk-like virus in shellfish implicated in illness[J].J Infect Dis,2000,181(2):360-366.
[19]Westrell T,Dusch V,Ethelberg S,et al.Norovirus outbreaks linked to oyster consumption in the United Kingdom,Norway,France,Sweden and Denmark,2010[J].Euro Surveill,2010,15(12):8-11.
[20]柯明月,王坤明,陈佳璐,等.2014年厦门地区市售牡蛎诺如病毒污染状况调查分析[J].中国卫生检验杂志,2015,25(10):1634-1637.
 王坤明,柯明月,施红,林英华.一起疑似食源性诺如病毒胃肠炎事件病原分子生物学特征分析[J].中国食品卫生杂志,2017,29(1):42-46.
王坤明,柯明月,施红,林英华.一起疑似食源性诺如病毒胃肠炎事件病原分子生物学特征分析[J].中国食品卫生杂志,2017,29(1):42-46.