DOi:10.13590/j.cjfh.2017.04.006
不同阶段母乳中10种游离低聚糖的检测及含量分析
(1.北京市营养源研究所,北京100069; 2.雀巢研究中心北京分部,北京100095; 3.中国疾病预防控制中心营养与健康所,北京100050; 4.北京中科邦尼国际科技 有限责任公司,北京100069)
作者简介: 朱婧女助理研究员研究方向为食物营养与功能评价E-mail:juer120@hotmail.com
通信作者: 杨月欣女研究员研究方向为食物营养E-mail:yxyang@263.net
收稿日期: 2017-04-25
基金项目:北京市科学技术研究院青年骨干计划(201527)
摘要:目的 检测不同阶段母乳中10种游离母乳低聚糖(human milk oligosaccharides,HMOS)的含量,并比较其在不同阶段母乳中的变化。方法 分别采集产后0~7 d(初乳)、产后8~15 d(过渡乳)、产后16~180 d(成熟乳)的母乳,采用荧光标记HMOS,通过超高效液相色谱-荧光检测法和标准曲线定量10种HMOS。采用Person相关比较不同泌乳时间与HMOS含量的相关性,3个泌乳阶段的组间差异采用单因素方差分析。结果 在选定的色谱条件下,10种HMOS可完全分离并定量。10种HMOS中,2′岩藻糖乳糖(2′FL)、3′唾液酸乳糖(3′SL)、6′唾液酸乳糖(6′SL)、乳糖-N-四糖(LNT)、乳糖-N-新四糖(LNnT)、乳糖-N-五糖I(LNFP-I)与泌乳时间存在负相关关系,3′岩藻糖乳糖(3′FL)与泌乳时间存在正相关关系,上述7种HMOS在不同阶段母乳中差异有统计学意义(P<0.05),而α-四糖(PI)、乳糖-N-五糖V(LNFP-V)、乳糖-N-新五糖(LNnFP-V)与泌乳时间无明显相关关系,在不同阶段母乳中含量差异无统计学意义(P>0.05)。结论 不同阶段母乳中HMOS的含量不同。10种HMOS中,7种HMOS与泌乳时间具有相关关系并且在不同泌乳阶段差异有统计学意义(P<0.05)。
关键词:
母乳; 泌乳阶段; 母乳低聚糖; 超高效液相色谱; 检测
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)04-0417-06
Detection and comparison of 10 human milk oligosaccharides during lactational stage
(1.Beijing Research Institute for Nutritional Resources,Beijing 100069,China; 2.Nestle Research Center Beijing Hub,Beijing 100095,China; 3.National Institute for Nutrition and Health, Chinese Center for Disease Control and Prevention,Beijing 100050,China; 4.Beijing Bonnysci Co., Ltd,Beijing 100069,China)
Abstract:Objective To detect 10 kinds of human milk oligosaccharides (HMOS) and compare their amounts during lactational stage. Methods Breast milk samples in different stages of lactation as colostrum (day 0-7 postpartum), transitional milk (day 8-15 postpartum), and mature milk (day 16-180 postpartum) were collected and 10 HMOS in those samples were detected and quantified by ultra high performance liquid chromatography-fluorescence detection after fluorescence labeling by using standard curves. Correlations between HMOS and lactation day were conducted by Person correlation analysis method , while the differences among three stages were calculated by ANOVA test. Results Ten HMOS were successfully separated and quantified under chosen chromatographic parameters. 2′FL,3′SL, 6′SL, LNT, LNnT and LNFP-I were negatively correlated and 3′FL was positively correlated with lactation days. They were different in three lactational stages (P<0.05), while PI, LNFP-V and LNnFP-V showed no correlation and difference (P>0.05). Conclusion The amount of HMOS changed during lactational stages. Seven HMOS were correlated with lactation days and different in three lactational stages (P<0.05).
Key words:
Breast milk; lactational stage; human milk oligosaccharides; ultra high performance liquid chromatography; detection
母乳可提供婴儿正常生长发育所需的全部营养成分和多种生物活性物质,是婴儿的最佳食物[1]。游离母乳低聚糖(human milk oligosaccharides, HMOS)是母乳中仅次于乳糖和脂类的第三大固体组分[2],通常由3~14个单糖组成,在核心结构的基础上可分为中性HMOS(末端为L-岩藻糖)和酸性HMOS(末端为唾液酸)[3]。HMOS不能被婴幼儿小肠的内源性酶消化,其具有多种重要功能,包括减少感染[4]、维持肠道微生态平衡[5]、发挥免疫调节因子的作用[6]及参与脑组织中神经节苷脂和糖蛋白构成[7]等。有研究[8]报道了3个月内不同泌乳时期对HMOS的影响,泌乳时期的增加伴随着婴儿生长发育状况的变化,HMOS的变化可能与婴儿的发育状况变化相关。但目前还缺乏更长泌乳时期的研究及中国人群的相关研究。本研究中,应用超高效液相色谱-荧光检测(UHPLC-FLD)法对中国人群母乳中10种HMOS进行检测[9],比较从初乳至产后6个月间不同阶段母乳中HMOS含量的变化,从而有助于阐明不同结构HMOS的功能,以及母乳在婴儿生长发育不同阶段的作用变化。
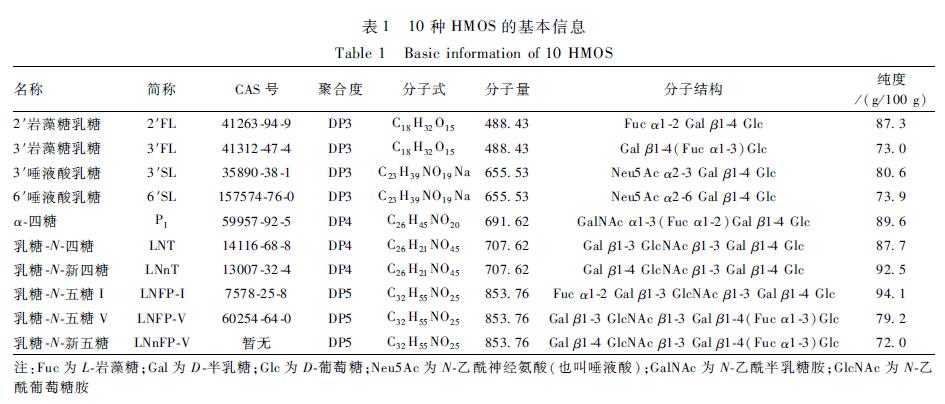
10种HMOS对照品的基本信息详见表1,均购自法国Elicityl Oligo Tech;内标为昆布三糖(laminaritriose,CAS:3256-04-0,美国Sigma)。乙腈(色谱纯),甲酸、氢氧化铵、二甲基亚砜(DMSO)、乙酸、2-氨基苯甲酰胺(2-AB,CAS:88-68-6)、氰基硼氢化钠(CAS:25895-60-7)均为分析纯,试验用水为超纯水。
内标溶液:准确称取15.00 mg昆布三糖至10 ml容量瓶中,以超纯水为溶剂制备内标溶液。
41岁,平均年龄为(27.62±4.02)岁,其中初乳阶段乳母平均年龄为(26.97±4.60)岁,过渡乳为(28.32±4.69)岁,成熟乳为(27.85±3.16)岁。
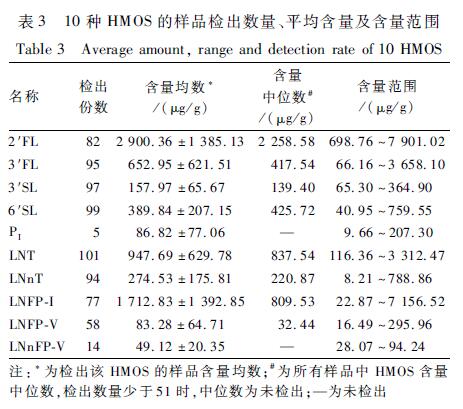
经检测,10种HMOS中,2′FL是第一大组分,平均含量为(2 900.36±1 385.13)μg/g,有19.6%(20/102)的母乳中2′FL未检出,未检出LNFP-I的母乳与未检出2′FL的母乳基本一致。仅有5份母乳测出PI,因此不宜继续比较不同泌乳阶段的差异。表3对10种HMOS的平均值及检出率进行了描述。
FUT2由Secretor基因编码,Secretor基因显性表达时,岩藻糖可通过α1-2键与核心结构连接,可合成2′FL、LNFP-I及PI,隐性表达时则不能合成。同时仅有血型A的乳母可检出PI,因检出数量很少,故本研究不对泌乳时间与HMOS含量的关系进行分析。约20%的母乳中均未检出2′FL和LNFP-I,提示这部分人群Secretor基因隐性表达。在比较不同泌乳时期的这2种HMOS变化时,本研究仅对显性表达的母乳中的含量进行了比较。
对HMOS进行检测,通常首先需要去除母乳中的脂肪和蛋白质,如离心沉淀法[10]、超滤法[11]、液-液萃取法[2]和乙腈提取法[12]等。提取HMOS使用液相色谱-质谱联用的方法进行定量检测[11],前处理步骤繁杂,检测仪器要求较高。本研究采用超高效液相色谱-荧光检测法[9]对10种HMOS进行检测,该方法重复样品测量的相对标准偏差(RSD)为1.8%~8.1%,回收率为98.7%~105%,具有较高的准确性和精密度。在本研究中,10种HMOS的重复样品测量RSD亦达到1.8%~4.9%。该方法前处理步骤简单,不需要去除脂肪和蛋白质,通过引入标记物可实现荧光检测,对检测仪器的要求较低,能实现10种HMOS的完全分离和定量,并通过内标对保留时间迁移进行控制及对待测HMOS的含量进行校正,确保HMOS的定性和定量的准确。
本研究表明,母乳中HMOS的含量与泌乳时间有关。成熟乳中2′FL、3′SL、6′SL、LNT、LNnT、LNFP-I的含量均较初乳和过渡乳减少,而3′FL则相反,在成熟乳中的含量高于初乳与过渡乳,这一发现与THURL等[8]的发现一致。不同HMOS随泌乳阶段出现不同变化,可能与婴儿不同生长发育阶段的需求变化有关,如肠道微生态的变化、免疫系统的发展完善等,因此研究HMOS的变化对阐明母乳对婴儿的影响有着重要意义。
1材料与方法
1.1材料
1.1.1样品采集
分别于江苏南京及黑龙江齐齐哈尔,采用便携式自动吸奶器,于上午8∶00~11∶00间,分别在产后0~7 d(初乳)、8~15 d(过渡乳)、16~180 d(成熟乳)取每位母亲单侧乳房乳汁不少于5 ml,采集后立即分装密封,存放于冷链包或-20 ℃冰箱,并在冷藏状态下尽快转移至-80 ℃冰箱,避光保存,共取得102份样品。
1.1.2主要仪器与试剂
U3000超高效液相色谱仪(配备荧光检测器,美国Dionex)、冷冻离心机、分析天平、超声水浴、恒温水浴锅、恒温烘箱。10种HMOS对照品的基本信息详见表1,均购自法国Elicityl Oligo Tech;内标为昆布三糖(laminaritriose,CAS:3256-04-0,美国Sigma)。乙腈(色谱纯),甲酸、氢氧化铵、二甲基亚砜(DMSO)、乙酸、2-氨基苯甲酰胺(2-AB,CAS:88-68-6)、氰基硼氢化钠(CAS:25895-60-7)均为分析纯,试验用水为超纯水。
|
表110种HMOS的基本信息 Table 1Basic information of 10 HMOS 注:Fuc为L-岩藻糖;Gal为D-半乳糖;Glc为D-葡萄糖;Neu5Ac为N-乙酰神经氨酸(也叫唾液酸);GalNAc为N-乙酰半乳糖胺;GlcNAc为N-乙酰葡萄糖胺 |
1.2方法
1.2.1对照品溶液及内标溶液的制备
对照品溶液:分别精密称取2′FL、3′FL对照品各10.00 mg于1 ml超纯水中,LNT、LNFP-I对照品各15.00 mg于1 ml超纯水中,3′SL、6′SL、PI、LNnT、LNFP-V、LNnFP-V各10.00 mg于10 ml超纯水中,浓度范围为843~17 874 nmol/ml,备用。将2′FL、3′FL、LNT、LNFP-I对照品溶液依次稀释2、5、6.65、10、20、50、125倍,将3′SL、6′SL、PI、LNnT、LNFP-V、LNnFP-V对照品溶液依次稀释1.33、2、4、10、25倍。内标溶液:准确称取15.00 mg昆布三糖至10 ml容量瓶中,以超纯水为溶剂制备内标溶液。
1.2.2样品处理
将母乳置于50 ℃烘箱20~30 min,放置到室温涡旋均匀后吸取40 μl至2 ml离心管中并记录重量。每份样品进行2次平行试验。以已测得HMOS含量的母乳样品为质控样品,每次试验以与待测样品相同的步骤进行处理。
1.2.3荧光标记
在放置样品/对照品的2 ml离心管中加入内标溶液20 μl,涡旋均匀后吸取20 μl至另一2 ml离心管中,加入200 μl 2-AB荧光标记溶液(0.35 mol/L 2-AB+1.0 mol/L氰基硼氢化钠,溶剂为含有30%乙酸的DMSO),混匀后置于(65±1)℃水浴中2 h,再将离心管放入4 ℃冰箱中至完全冷却。在离心管中加入1 ml 25%乙腈,10 000×g,4 ℃离心5 min取上清液至色谱中检测。
1.2.4色谱条件
俘获柱为ACQUITYBEH Amide预柱(2.1 mm×5 mm,1.7 μm),分离柱为ACQUITY UPLC BEH Amide(3.0 mm×150 mm,1.7 μm)。流动相:梯度洗脱A相为100%乙腈;B相为50 mmol/L甲酸铵(pH=4.4,甲酸、氢氧化铵及水配制而成)。俘获柱洗脱程序:5%B等度(0~2.5 min),5%~90%B线性变换(2.5~4 min),90%B等度(4~62 min),90%~5%B线性变换(62~65 min)。分离柱洗脱程序:10%B等度(0~6 min),10%~18%B线性变换(6~40 min),18%~19.5%B线性变换(40~60 min),19.5%~70%B线性变换(60~61 min),70%B等度(61~65 min)。检测波长:激发波长330 nm,发射波长420 nm。柱温60 ℃,流速0.8 ml/min,进样量3 μl。
1.2.5结果计算
以对照品溶液浓度与内标溶液浓度的比值(对照品溶液浓度/内标溶液浓度)为横坐标(x),以对照品色谱峰面积与内标色谱峰面积的比值(对照品色谱峰面积/内标色谱峰面积)为纵坐标(y),绘制标准曲线,计算回归方程及相关系数R2。根据保留时间对样品中的HMOS进行定性,根据标准曲线进行定量,两次重复取平均值,结果以μg/g表示。
1.3统计学分析
采用SPSS 18.0,不同泌乳阶段数据采用均值±标准差(±s)描述,采用散点图和Person相关分析对泌乳时间与HMOS含量的相关性进行分析,组间比较采用方差分析,以P<0.05为差异有统计学意义。
2结果
2.1色谱图
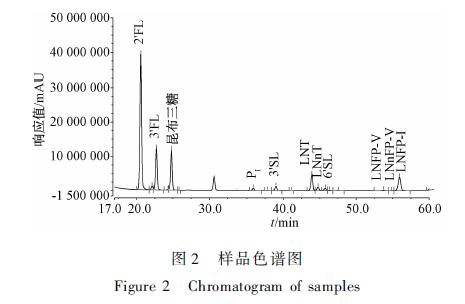
图1为10种HMOS对照品混合标准色谱图,图2为样品色谱图。在选定的色谱条件下,10种HMOS可完全分离,峰形良好。样品经处理后,基质几乎不影响HMOS的检出。

|
图110种HMOS的对照品混合标准色谱图 Figure 1Chromatogram of mixed 10 HMOS references |
|
图2样品色谱图 Figure 2Chromatogram of samples |
2.2线性范围
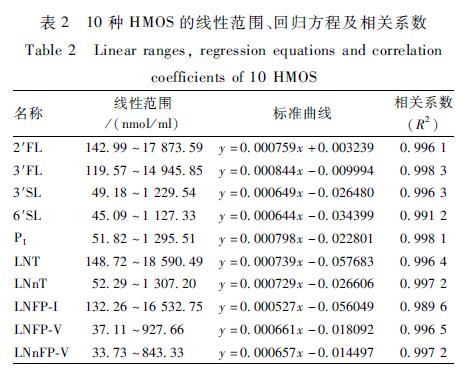
表2可知,在一定浓度范围内,10种HMOS均具有良好的线性关系。
2.3样品基本情况
共采集母乳102份,泌乳时间为3~175 d,其中初乳37份占36.3%,平均泌乳时间为(4.92±1.50) d;过渡乳19份占18.6%,平均泌乳时间为(9.21±1.58) d;成熟乳46份占45.1%,平均泌乳时间为(72.67±48.16) d。乳母的年龄为19~
|
表210种HMOS的线性范围、回归方程及相关系数 Table 2Linear ranges, regression equations and correlation coefficients of 10 HMOS |
经检测,10种HMOS中,2′FL是第一大组分,平均含量为(2 900.36±1 385.13)μg/g,有19.6%(20/102)的母乳中2′FL未检出,未检出LNFP-I的母乳与未检出2′FL的母乳基本一致。仅有5份母乳测出PI,因此不宜继续比较不同泌乳阶段的差异。表3对10种HMOS的平均值及检出率进行了描述。
|
表310种HMOS的样品检出数量、平均含量及含量范围 Table 3Average amount, range and detection rate of 10 HMOS 注:*为检出该HMOS的样品含量均数;#为所有样品中HMOS含量中位数,检出数量少于51时,中位数为未检出;—为未检出 |
2.4泌乳时间与HMOS水平的相关性
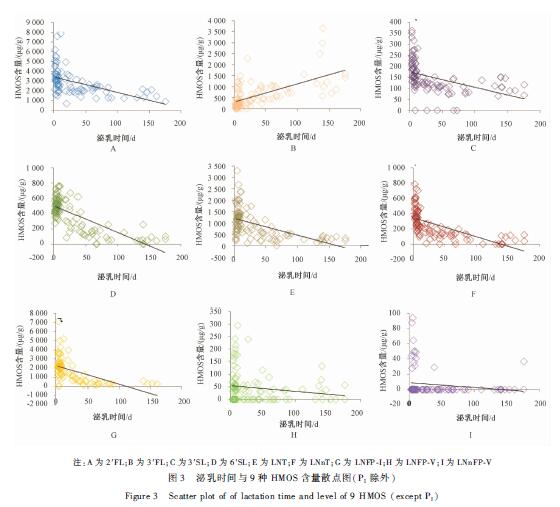
Person相关分析显示,泌乳时间与HMOS间存在相关关系。如表4及图3所示,泌乳时间与2′FL间存在负相关关系,即随着泌乳时间的延长,母乳中2′FL的含量呈现下降的趋势。此外,3′SL、6′SL、LNT、LNnT、LNFP-I与泌乳时间也存在负相关关系,而3′FL与泌乳时间存在正相关关系,LNFP-V、LNnFP-V与泌乳时间差异无统计学意义(P>0.05)。
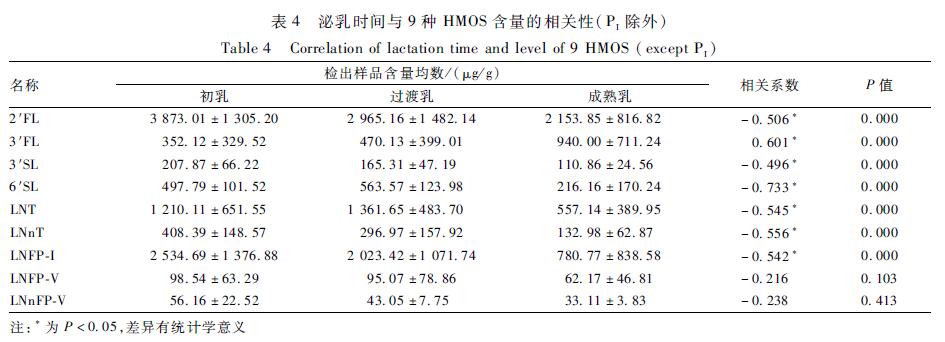
|
表4泌乳时间与9种HMOS含量的相关性(PI除外) Table 4Correlation of lactation time and level of 9 HMOS (except PI) 注:*为P<0.05,差异有统计学意义 |
2.5不同阶段母乳中HMOS含量的变化
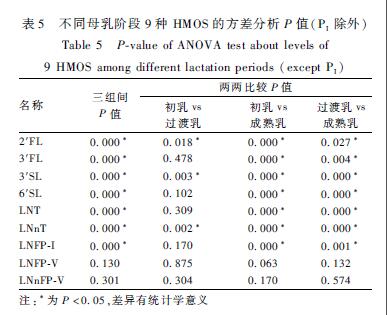
如图4及表5所示,初乳、过渡乳、成熟乳3个阶段母乳中2′FL、3′SL、LNnT的含量随着分泌时间的延长逐渐降低;6′SL、LNT、LNFP-I的含量在初乳和过渡乳两阶段无明显变化,在成熟乳阶段降低;成熟乳阶段3′FL的含量较初乳和过渡乳阶段明显增加,LNFP-V、LNnFP-V在各泌乳阶段均无明显变化。
3讨论
HMOS是一大类复杂的混合物,目前已发现超过200种结构。HMOS的合成依靠糖基转移酶,糖基转移酶具有基因多态性,特别是岩藻糖基转移酶-2(FUT2)对母乳中含量较高的2′FL和LNFP-I的合成具有决定性影响[8]。FUT2由Secretor基因编码,Secretor基因显性表达时,岩藻糖可通过α1-2键与核心结构连接,可合成2′FL、LNFP-I及PI,隐性表达时则不能合成。同时仅有血型A的乳母可检出PI,因检出数量很少,故本研究不对泌乳时间与HMOS含量的关系进行分析。约20%的母乳中均未检出2′FL和LNFP-I,提示这部分人群Secretor基因隐性表达。在比较不同泌乳时期的这2种HMOS变化时,本研究仅对显性表达的母乳中的含量进行了比较。
|
注:A为2′FL;B为3′FL;C为3′SL;D为6′SL;E为LNT;F为LNnT;G为LNFP-I;H为LNFP-V;I为LNnFP-V 图3泌乳时间与9种HMOS含量散点图(PI除外) Figure 3Scatter plot of of lactation time and level of 9 HMOS (except PI) |

|
图4母乳阶段与9种HMOS含量(PI除外) Figure 4Lactation periods and level of 9 HMOS(except PI) |
|
表5不同母乳阶段9种HMOS的方差分析P值(PI除外) Table 5P-value of ANOVA test about levels of 9 HMOS among different lactation periods (except PI) 注:*为P<0.05,差异有统计学意义 |
本研究表明,母乳中HMOS的含量与泌乳时间有关。成熟乳中2′FL、3′SL、6′SL、LNT、LNnT、LNFP-I的含量均较初乳和过渡乳减少,而3′FL则相反,在成熟乳中的含量高于初乳与过渡乳,这一发现与THURL等[8]的发现一致。不同HMOS随泌乳阶段出现不同变化,可能与婴儿不同生长发育阶段的需求变化有关,如肠道微生态的变化、免疫系统的发展完善等,因此研究HMOS的变化对阐明母乳对婴儿的影响有着重要意义。
参考文献
[1]OFTEDAL O T. The evolution of milk secretion and its ancient origins[J]. Animal, 2012, 6(3):355-368.
[2]NINONUEVO M R, PARK Y, YIN H, et al. A strategy for annotating the human milk glycome[J]. J Agric Food Chem, 2006, 54(20):7471-7480.
[3]KUNZ C, RUDLOFF S, BAIER W, et al. Oligosaccharides in human milk: structural, functional, and metabolic aspects[J]. Annu Rev Nutr, 2000, 20(1):699-722.
[4]GEORGI G, BARTKE N, WIENS F, et al. Functional glycans and glycoconjugates in human milk[J]. Am J Clin Nutr, 2013, 98(2):578S-585S.
[5]GUEIMONDE M, LAITINEN K, SALMINEN S, et al. Breast milk: a source of Bifidobacteria for infant gut development and maturation?[J]. Neonatology, 2007, 92(1):64-66.
[6]EIWEGGER T, STAHL B, HAIDL P, et al. Prebiotic oligosaccharides: in vitro evidence for gastrointestinal epithelial transfer and immunomodulatory properties[J]. Pediatr Allergy Immunol, 2010, 21(8):1179-1188.
[7]WANG B, BRAND-MILLER J. The role and potential of sialic acid in human nutrition[J]. Eur J Clin Nutr, 2003, 57(11):1351-1369.
[8]THURL S, MUNZERT M, HENKER J, et al. Variation of human milk oligosaccharides in relation to milk groups and lactational periods[J]. Br J Nutr, 2010, 104(9):1261-1271.
[9]AUSTIN S, DE CASTRO C A, BNET T, et al. Temporal change of the content of 10 oligosaccharides in the milk of chinese urban mothers[J]. Nutrients, 2016, 8(6):346.
[10]STAHL B, THURL S, ZENG J R, et al. Oligosaccharides from human milk as revealed by matrix-assisted laser desorption/ionization mass spectrometry[J]. Anal Biochem, 1994, 223(2):218-226.
[11]SAKAGUCHI Y, HAYAMA T, YOSHIDA H, et al. Liquid chromatography/tandem mass spectrometry with fluorous derivatization method for selective analysis of sialyl oligosaccharides[J]. Rapid Commun Mass Spectrom, 2014, 28(23):2481-2489.
[12]GALEOTTI F, COPPA G V, ZAMPINI L, et al. On-line high-performance liquid chromatography-fluorescence detection-electrospray ionization-mass spectrometry profiling of human milk oligosaccharides derivatized with 2-aminoacridone[J]. Anal Biochem, 2012, 430(1):97-104.
[2]NINONUEVO M R, PARK Y, YIN H, et al. A strategy for annotating the human milk glycome[J]. J Agric Food Chem, 2006, 54(20):7471-7480.
[3]KUNZ C, RUDLOFF S, BAIER W, et al. Oligosaccharides in human milk: structural, functional, and metabolic aspects[J]. Annu Rev Nutr, 2000, 20(1):699-722.
[4]GEORGI G, BARTKE N, WIENS F, et al. Functional glycans and glycoconjugates in human milk[J]. Am J Clin Nutr, 2013, 98(2):578S-585S.
[5]GUEIMONDE M, LAITINEN K, SALMINEN S, et al. Breast milk: a source of Bifidobacteria for infant gut development and maturation?[J]. Neonatology, 2007, 92(1):64-66.
[6]EIWEGGER T, STAHL B, HAIDL P, et al. Prebiotic oligosaccharides: in vitro evidence for gastrointestinal epithelial transfer and immunomodulatory properties[J]. Pediatr Allergy Immunol, 2010, 21(8):1179-1188.
[7]WANG B, BRAND-MILLER J. The role and potential of sialic acid in human nutrition[J]. Eur J Clin Nutr, 2003, 57(11):1351-1369.
[8]THURL S, MUNZERT M, HENKER J, et al. Variation of human milk oligosaccharides in relation to milk groups and lactational periods[J]. Br J Nutr, 2010, 104(9):1261-1271.
[9]AUSTIN S, DE CASTRO C A, BNET T, et al. Temporal change of the content of 10 oligosaccharides in the milk of chinese urban mothers[J]. Nutrients, 2016, 8(6):346.
[10]STAHL B, THURL S, ZENG J R, et al. Oligosaccharides from human milk as revealed by matrix-assisted laser desorption/ionization mass spectrometry[J]. Anal Biochem, 1994, 223(2):218-226.
[11]SAKAGUCHI Y, HAYAMA T, YOSHIDA H, et al. Liquid chromatography/tandem mass spectrometry with fluorous derivatization method for selective analysis of sialyl oligosaccharides[J]. Rapid Commun Mass Spectrom, 2014, 28(23):2481-2489.
[12]GALEOTTI F, COPPA G V, ZAMPINI L, et al. On-line high-performance liquid chromatography-fluorescence detection-electrospray ionization-mass spectrometry profiling of human milk oligosaccharides derivatized with 2-aminoacridone[J]. Anal Biochem, 2012, 430(1):97-104.
 朱婧,石羽杰,吴立芳,孙赫南,王鑫,王竹,关蕾,余恺,杨月欣.不同阶段母乳中10种游离低聚糖的检测及含量分析[J].中国食品卫生杂志,2017,29(4):417-422.
朱婧,石羽杰,吴立芳,孙赫南,王鑫,王竹,关蕾,余恺,杨月欣.不同阶段母乳中10种游离低聚糖的检测及含量分析[J].中国食品卫生杂志,2017,29(4):417-422.