DOi:10.13590/j.cjfh.2017.04.009
基质分散固相萃取净化-亲水液相色谱-串联质谱法检测织纹螺与贝类中河鲀毒素
(1.舟山市疾病预防控制中心 浙江省海产品健康危害因素关键技术研究重点实验室, 浙江 舟山316021; 2.岱山县疾病预防控制中心,浙江 岱山316200)
作者简介: 方力男工程师研究方向为理化检验E-mail:fangli123@126.com
收稿日期: 2017-05-08
基金项目: 浙江省公益技术应用研究(分析测试)项目(2016C37029);国家星火计划项目(2015GA700094);浙江省公共卫生应急检测关键技术重点实验室开放课题(201306);舟山市公益类科技项目(2013C31070)
摘要: 目的针对海产品常见中毒原因分析需求,建立基质分散固相萃取净化-亲水液相色谱-串联三重四极杆质谱(HILIC-MS/MS)快速定性定量检测织纹螺和贝类中河鲀毒素的新方法。方法1.0 g样品经0.1%乙酸溶液沸水浴提取后,用50 mg 亲水亲油平衡填料(HLB)和5 mg石墨化碳黑(GCB)吸附剂吸附净化,最后经乙腈蛋白沉淀后过0.22 μm聚四氟乙烯(PTFE)滤膜,亲水液相色谱柱(150 mm×2.0 mm,3 μm)分离,电喷雾离子化,选择反应监测(SRM)模式检测,基质匹配外标法定量。结果在2.0~40.0 ng/ml浓度范围内,河鲀毒素呈现良好的线性关系,相关系数r2≥0.999;以3倍基线噪声所对应的浓度为检出限时,河鲀毒素的方法检出限可达10.0 μg/kg;在25、100和200 μg/kg的加标水平时,方法回收率为74.2%~87.9%,相对标准偏差为2.3%~9.1%。应用本方法对浙江沿海地区市售织纹螺和贝类样品进行检测,15份织纹螺中有14份检出河鲀毒素,检出率为93.3%,含量范围为0.04~15.75 mg/kg,60份贝类样品均未检出河鲀毒素。结论该检测方法准确、快速、易操作,能满足典型海产品中河鲀毒素的公共卫生应急检测或日常监测要求。
关键词:
基质分散固相萃取; 海产品; 织纹螺; 贝类; 河鲀毒素; 亲水液相色谱; 中毒; 检测
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)04-0434-05
Determination of tetrodotoxin in nassarius and shellfish by hydrophilic liquid
chromatography-tandem mass spectrometer coupled with dispersive solid phase extraction
chromatography-tandem mass spectrometer coupled with dispersive solid phase extraction
(1.Key Laboratory of Health Risk Factors for Seafood of Zhejiang Province, Zhoushan Center for Disease Control and Prevention, Zhejiang Zhoushan 316021, China; 2.Daishan Center for Disease Control and Prevention, Zhejiang Daishan 316200, China)
Abstract:ObjectiveIn order to analyze of poisoning causes, a new method was established utilizing hydrophilic liquid chromatography-tandem triple quadrupole mass spectrometer (HILIC-MS/MS) coupled with dispersive solid phase extraction for rapid qualitative and quantitative analysis of tetrodotoxin in nassarius and shellfish. MethodsSample(1.0 g)was extracted with 0.1% acetic acid in boiling water bath, purified by dispersive solid phase extraction with 50 mg hydrophilic-lipophilic balance (HLB), 5 mg graphitized carbon black (GCB) and protein precipitation with acetonitrile, and then filtered through a polytetrafluoroethylene(PTFE)membrane. The analytes were separated on a HILIC column, and detected in selected reaction monitoring (SRM) mode via positive electrospray ionization. The matrix matching and external standard method was used for quantification.ResultsTetrodotoxin showed good linearity in the concentration range between 2.0 and 40.0 ng/ml, the correlation coefficient was higher than 0.999. The detection limit of tetrodotoxin in seafood was 10.0 μg/kg. The rates of recovery varied between 74.2% and 87.9% with relative standard deviations from 2.3% to 9.1% at spiked concentrations of 25, 100 and 200 μg/kg. The proposed method was applied in the detection of tetrodotoxin in shellfish and nassarius from coastal cities of Zhejiang Province. ConclusionThe method was accurate, fast, easy to operate, which could meet the requirements of public health emergency testing or routine testing.
Key words:
Dispersive solid phase extraction; seafood; nassarius; shellfish; tetrodotoxin; hydrophilic liquid chromatography; poisoning; detection
近年来,因误食河鲀、织纹螺、虾虎鱼等海产品导致河鲀毒素中毒的事件时有发生[1-3],中毒症状主要表现为颤抖、口舌发麻、四肢无力、全身麻痹,严重者甚至可以导致死亡,因此,开发简单、准确、快速检测海产品中河鲀毒素的方法显得十分迫切。目前,河鲀毒素检测方法主要有小鼠生物法[4]、酶联免疫法[5]、气相色谱-质谱联用法[6]、高效液相色谱法[7]及液相色谱-串联质谱法[8-11]。生物法和酶联免疫吸附法易产生假阳性或者假阴性,一般仅用于常规筛查;气相色谱-质谱联用法需要衍生化,试验条件要求严格;液相色谱法灵敏度相对较低;液相色谱-串联质谱法是目前的主流方法,具有选择性好、灵敏度高等优势。当前关于海产品中河鲀毒素检测的前处理手段主要有固相萃取、免疫亲和柱等[8-9,11]。常规固相萃取小柱净化法存在溶剂消耗量大、净化效果不够理想等缺陷;免疫亲和柱净化法尽管净化效果好,但也存在使用成本高、操作要求高、处理时间长等缺陷。
本试验采用亲水液相色谱-串联质谱(HILIC-MS/MS),结合基质分散固相萃取(dispersive solid phase extraction,dSPE)技术,建立了一种净化简单的测定海产品中河鲀毒素的方法。
甲酸(LC-MS级)、乙酸(LC-MS级)、甲醇(色谱纯)、乙腈(色谱纯)、甲酸铵(LC-MS级)、固相萃取填料:Poly-Sery HLB(20~120 μm)、CNWBOND HC-C18(40~63 μm)、CNWBOND Carbon-GCB(120~400目)均购自德国CNW,超纯水由Mili-Q超纯水系统制得,河鲀毒素(纯度≥99%,I0190030,上海安谱实验科技股份有限公司),0.22 μm聚四氟乙烯(PTFE)滤膜。
河鲀毒素标准溶液用0.1%乙酸乙腈溶液稀释,配成浓度为1.0 μg/ml的标准储备液。用空白基质配制成浓度为2、5、10、20和40 ng/ml的标准系列。
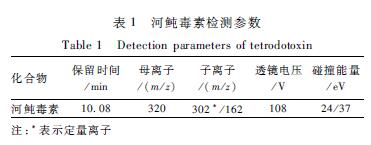
质谱:采用电喷雾离子源(ESI),正离子扫描方式,选择反应监测(SRM)模式;喷雾电压为3.0 kV;汽化温度为300 ℃;离子传输毛细管温度为325 ℃;鞘气压(sheath units)为45 arb,辅助气压(arbitrary units)为15 arb,这两种雾化气均为高纯氮气,碰撞气为高纯氩气,压力为1.5 mTorr。使用前调节各气体流量以使质谱灵敏度达到检测要求。河鲀毒素的检测参数见表1。
最后本试验增加了乙腈净化的步骤,主要目的是为了能进一步沉淀样品中剩余的蛋白,同时提高进样溶液中有机相的比例(初始流动相中有机相的比例约为80%),以降低可能存在的溶剂效应对色谱行为的影响。
在本试验条件下,根据3倍基线噪声的峰响应值、取样量和进样量,得出两种基质中河鲀毒素的方法检出限均能达到10.0 μg/kg,我国尚无海产品中河鲀毒素限量标准,根据日本厚生劳动省规定无毒河鲀鱼中河鲀毒素的限量值为2.2 mg/kg[12],本方法完全能满足检测要求。
本试验采用亲水液相色谱-串联质谱(HILIC-MS/MS),结合基质分散固相萃取(dispersive solid phase extraction,dSPE)技术,建立了一种净化简单的测定海产品中河鲀毒素的方法。
1材料与方法
1.1主要仪器与试剂
TSQ Vantage三重四极杆质谱仪(配有电喷雾离子源)、Ultimate 3000超高效液相色谱仪均购自美国Thermo,高速冷冻离心机、微量高速离心机均购自美国Beckman,超声波清洗机,电子天平,涡旋混合器,数显恒温水浴锅,Mili-Q(18.2 MΩ)超纯水处理系统。甲酸(LC-MS级)、乙酸(LC-MS级)、甲醇(色谱纯)、乙腈(色谱纯)、甲酸铵(LC-MS级)、固相萃取填料:Poly-Sery HLB(20~120 μm)、CNWBOND HC-C18(40~63 μm)、CNWBOND Carbon-GCB(120~400目)均购自德国CNW,超纯水由Mili-Q超纯水系统制得,河鲀毒素(纯度≥99%,I0190030,上海安谱实验科技股份有限公司),0.22 μm聚四氟乙烯(PTFE)滤膜。
1.2方法
1.2.1提取
准确称取(1.0±0.01)g均质后样品置于15 ml聚丙烯离心管中,加入5 ml 0.1%乙酸溶液(提取溶剂),涡旋混合1 min,沸水浴提取10 min,冷却至室温后5 000×g离心10 min,上清液转移至另一支15 ml离心管中,再向残渣中加入5 ml 0.1%乙酸溶液,重复以上提取步骤,合并提取液并定容至10 ml,混匀后再次5 000×g离心10 min,提取液待净化。
1.2.2净化
称取(50±5) mg亲水亲油平衡填料(HLB)粉末和(5±0.5) mg 石墨化碳黑(GCB)粉末置于2 ml离心管并混合均匀,移取1.0 ml提取液于该离心管中,涡旋混合1 min,15 000 r/min离心5 min,移取500 μl上清液于2 ml离心管中,加入500 μl乙腈,涡旋混合30 s,15 000 r/min离心2 min,上清液经0.22 μm滤膜过滤,注入样品瓶中,备用。
1.2.3空白基质溶液及标准溶液的制备
称取与待测样品基质相同、不含河鲀毒素的样品于离心管中,按照1.2.1和1.2.2中的步骤进行提取和净化,得到空白基质溶液。河鲀毒素标准溶液用0.1%乙酸乙腈溶液稀释,配成浓度为1.0 μg/ml的标准储备液。用空白基质配制成浓度为2、5、10、20和40 ng/ml的标准系列。
1.2.4仪器条件
色谱:TSKgel Amide-80色谱柱(150 mm×2.0 mm,3 μm),流动相A为0.1%甲酸-2 mmol/L甲酸铵水,B为0.1%甲酸-2 mmol/L甲酸铵+95%乙腈水,流速为0.3 ml/min,进样量为10 μl,柱温为30 ℃。分析梯度:0~3 min,B:85%;3~13 min,B:85%~40%;13~15 min,B:40%,15~15.2 min,B:40%~85%;15.2~19 min,B:85%。质谱:采用电喷雾离子源(ESI),正离子扫描方式,选择反应监测(SRM)模式;喷雾电压为3.0 kV;汽化温度为300 ℃;离子传输毛细管温度为325 ℃;鞘气压(sheath units)为45 arb,辅助气压(arbitrary units)为15 arb,这两种雾化气均为高纯氮气,碰撞气为高纯氩气,压力为1.5 mTorr。使用前调节各气体流量以使质谱灵敏度达到检测要求。河鲀毒素的检测参数见表1。
|
表1河鲀毒素检测参数 Table 1Detection parameters of tetrodotoxin 注:*表示定量离子 |
2结果
2.1色谱条件优化
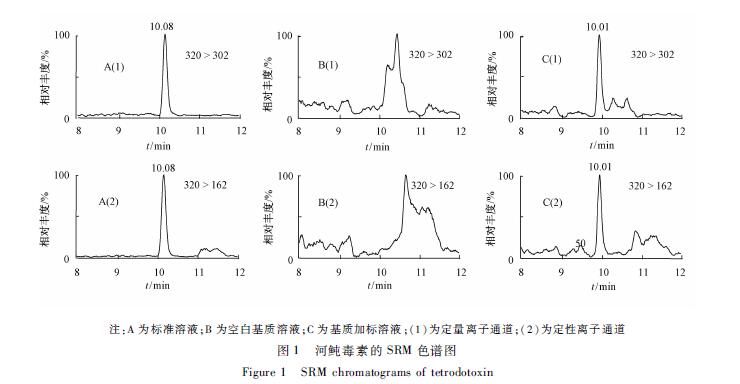
河鲀毒素是一种小分子极性化合物,很多国内外文献[8-11]已证实亲水色谱柱适合该类化合物的分离与检测。本试验选取两根Amide填料的亲水色谱柱比较其对河鲀毒素的色谱分离效果。尽管ACQUITY UPLC BEH Amide柱(100 mm×2.0 mm,1.7 μm)分离后获得的色谱峰具有峰宽窄、分析时间短等小粒径色谱柱特有的优势,但实际检测过程中发现部分复杂基质贝类样品中存在与目标峰保留时间重合的干扰峰,没能在该色谱柱上实现基线分离。使用TSKgel Amide-80柱(150 mm×2.0 mm,3 μm)能较好地实现目标峰与基质干扰峰之间的分离,且能实现目标毒素的较好保留,见图1。
|
注:A为标准溶液;B为空白基质溶液;C为基质加标溶液;(1)为定量离子通道;(2)为定性离子通道 图1河鲀毒素的SRM色谱图 Figure 1SRM chromatograms of tetrodotoxin |
2.2前处理条件优化
2.2.1提取条件的优化
河鲀毒素具有弱碱性,在酸性条件下带正电,易被酸性水溶剂提取,本试验采用0.1%乙酸溶液作为提取溶剂,能达到较好的提取效果。与10 ml提取液一次性提取比较,5 ml提取液重复提取两次明显提高了河鲀毒素的提取回收率。河鲀毒素在酸性环境中对热稳定,高温下一般不分解。本试验比较了有无沸水浴提取对净化效果的影响,发现经沸水浴处理的样品为透明溶液,而未经沸水浴处理的样品相对浑浊,沸水浴处理检测效果明显好于未处理。
2.2.2净化条件优化
dSPE是一种简单高效的净化方法,吸附剂的选择是dSPE的一个最重要的参数。C18填料是一种憎水硅胶基吸附剂,其对非极性化合物具有很强的吸附性能。HLB是一种以改性的二乙烯基苯聚合物为基质的吸附剂,其亲水-亲脂平衡性能设计适用于酸性、碱性和中性化合物的净化。针对不同的分析物,表现出不同的保留特性。HLB的相对保留容量比最常用的硅胶基吸附剂(如C18)高三倍。GCB具有六元环结构,因此与平面分子具有很强的亲和力,适用于许多有机化合物的提取和净化,特别是用于从各种基质中分离和除去有色物质、固醇类等。本试验考察了C18、HLB和GCB吸附剂对河鲀毒素的吸附情况,分别选择50 mg C18、50 mg HLB、25 mg C18和25 mg HLB、50 mg C18和50 mg HLB为吸附剂进行回收率比较,结果显示单独使用HLB、C18的回收率与二者共同使用之间没有明显差异,但由于部分C18吸附剂在离心后仍悬浮于上清液,会对后续取样造成困难。HLB和GCB的同时使用能产生比单独使用HLB更好的净化效果。使用GCB净化后的溶液是无色透明的,而没有GCB的溶液是浅黄色的。本试验还进一步研究了HLB和GCB的使用量以提高净化效果。对于河鲀毒素,使用5~10 mg GCB达到较好的回收率,此后随着GCB使用量的增加,河鲀毒素的回收率逐渐下降;使用25~100 mg HLB均能提供较好的回收率,综合考虑实际净化效果和使用成本,本试验选择50 mg HLB和5 mg GCB作为净化样品的吸附剂。本试验从两个角度比较dSPE处理前后的净化效果,首先从净化前后溶液颜色比较,提取后未净化的样品溶液呈现浅黄色,而经dSPE处理后样品溶液变为无色透明;其次,对比净化前后基质标准样品的总离子流图,从图2可以看出,未经dSPE净化的贻贝、织纹螺基质在总离子流图前段出现杂峰(1~3.5 min),而经dSPE净化后,该段杂峰明显降低。综上说明dSPE净化能有效去除杂质,减轻复杂样品基质对色谱柱和质谱仪的污染。

|
注:A为空白基质标准溶液;B为贻贝基质标准溶液-未净化; C为贻贝基质标准溶液-净化后;D为织纹螺基质标准溶液-未净化; E为织纹螺基质标准溶液-净化后 图2dSPE净化前后河鲀毒素基质标准溶液的总离子流图 Figure 2Total ion chromatograms of tetrodotoxin matrix standard solution before and after cleaning with dispersive solid phase extraction |
2.3基质效应、工作曲线及检出限
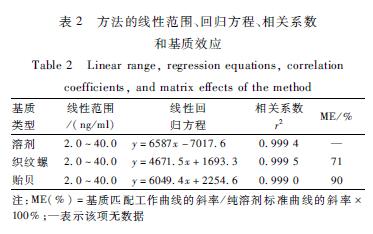
按1.2.3的方法配制标准溶液并测定,以河鲀毒素的浓度为横坐标,峰面积为纵坐标,绘制基质工作曲线,在2.0~40.0 ng/ml浓度范围内,线性关系良好,相关系数r2≥0.999。本试验采用基质匹配工作曲线的斜率与纯溶剂标准曲线的斜率的百分比值来评价检测方法基质效应(ME)。从表2可知,织纹螺基质的ME值为71%,表明存在一定的基质抑制效应。贻贝基质的ME值为90%,表明贻贝基质的抑制效应弱。本试验采用基质匹配标准曲线测定实际样品,一定程度上消除了基质效应。
|
表2方法的线性范围、回归方程、相关系数 和基质效应 Table 2Linear range, regression equations, correlation coefficients, and matrix effects of the method 注:ME(%)=基质匹配工作曲线的斜率/纯溶剂标准曲线的斜率×100%;—表示该项无数据 |
2.4回收率和精密度
本试验以织纹螺和贻贝为研究对象,考察检测方法的回收率和精密度。准确称取空白织纹螺和贻贝样品各1.0 g,设定3个添加水平25、100和200 μg/kg,根据上述方法进行检测,每组样品6个平行,测定回收率和相对标准偏差(RSD)。由表3可知,织纹螺和贻贝中河鲀毒素的方法回收率为74.2%~87.9%,RSD为2.3%~9.1%。

|
表3方法回收率和精密度(n=6) Table 3Recovery and precision of the method |
2.5实际样品检测
应用本方法对2013—2014年浙江省沿海地区采集的15份织纹螺和60份贝类样品进行检测,其中有14份织纹螺检出河鲀毒素,检出率为93.3%,含量范围为0.04~15.75 mg/kg,60份贝类样品均未检出河鲀毒素。
3小结
本方法采用0.1%乙酸溶液提取,dSPE净化、亲水液相色谱分离、三重四极杆质谱检测,实现快速定性定量检测织纹螺和贝类中的河鲀毒素。本方法快速、简便、灵敏度高、重现性好,能够应用于应急检测或日常监测等公共卫生实践活动。
参考文献
[1]林学尧, 林洁, 张秀尧, 等. 多起食用织纹螺中毒的流行病学调查[J]. 中国卫生检验杂志, 2015, 25(10): 1646-1648.
[2]朱国萍, 疗建萌, 伍彬, 等. 犬牙僵虾虎鱼体内河豚毒素季节性变化规律[J]. 海洋环境科学, 2015, 34(1): 66-69,80.
[3]张秀尧, 蔡欣欣, 贾俐挺. 一起食用河豚鱼干中毒死亡事件调查[J]. 浙江预防医学, 2014, 26(1): 86-87.
[4]中华人民共和国国家质量监督检验检疫总局. 出口河豚鱼中河豚毒素检测方法 第2部分:小鼠生物法:SN/T 1569.2—2013[S]. 北京: 中国标准出版社, 2013.
[5]中华人民共和国卫生部. 鲜河豚鱼中河豚毒素的测定:GB/T 5009.206—2007[S]. 北京: 中国标准出版社, 2007.
[6]吴平谷, 赵永信, 沈向红, 等.河豚鱼中河豚毒素的气相色谱质谱法测定[J]. 中国卫生检验杂志, 2009, 19(3): 549-551.
[7]陈伟珠, 洪专, 张怡评, 等. 河豚毒素的高效液相/荧光精确定量技术研究[J]. 中国卫生检验杂志, 2009, 19(2): 261-262.
[8]王智, 褚学军, 郭萌萌, 等. 免疫亲和柱净化-亲水液相色谱-串联质谱法测定水产食品中河鲀毒素[J]. 中国食品卫生杂志, 2016, 28(3): 306-310.
[9]严忠雍, 张小军, 李奇富, 等. 免疫亲和柱净化-液相色谱-串联质谱法测定海洋生物中河豚毒素[J]. 分析化学, 2015, 43(2): 277-281.
[10]张秀尧, 蔡欣欣. 石墨化炭黑固相萃取-亲水液相色谱-三重四极杆质谱法测定海产品中河豚毒素[J]. 中华预防医学杂志, 2013, 47(3): 274-277.
[11]骆和东, 贾玉珠, 朱宝平. 固相萃取-超过滤-液相色谱/质谱联用法测定织纹螺中的河豚毒素[J]. 色谱, 2007, 25(6): 917-921.
[12]日本厚生劳动省. 食品卫生检查指针[M]. 东京: 日本食品卫生协会, 2005: 661-667.
[2]朱国萍, 疗建萌, 伍彬, 等. 犬牙僵虾虎鱼体内河豚毒素季节性变化规律[J]. 海洋环境科学, 2015, 34(1): 66-69,80.
[3]张秀尧, 蔡欣欣, 贾俐挺. 一起食用河豚鱼干中毒死亡事件调查[J]. 浙江预防医学, 2014, 26(1): 86-87.
[4]中华人民共和国国家质量监督检验检疫总局. 出口河豚鱼中河豚毒素检测方法 第2部分:小鼠生物法:SN/T 1569.2—2013[S]. 北京: 中国标准出版社, 2013.
[5]中华人民共和国卫生部. 鲜河豚鱼中河豚毒素的测定:GB/T 5009.206—2007[S]. 北京: 中国标准出版社, 2007.
[6]吴平谷, 赵永信, 沈向红, 等.河豚鱼中河豚毒素的气相色谱质谱法测定[J]. 中国卫生检验杂志, 2009, 19(3): 549-551.
[7]陈伟珠, 洪专, 张怡评, 等. 河豚毒素的高效液相/荧光精确定量技术研究[J]. 中国卫生检验杂志, 2009, 19(2): 261-262.
[8]王智, 褚学军, 郭萌萌, 等. 免疫亲和柱净化-亲水液相色谱-串联质谱法测定水产食品中河鲀毒素[J]. 中国食品卫生杂志, 2016, 28(3): 306-310.
[9]严忠雍, 张小军, 李奇富, 等. 免疫亲和柱净化-液相色谱-串联质谱法测定海洋生物中河豚毒素[J]. 分析化学, 2015, 43(2): 277-281.
[10]张秀尧, 蔡欣欣. 石墨化炭黑固相萃取-亲水液相色谱-三重四极杆质谱法测定海产品中河豚毒素[J]. 中华预防医学杂志, 2013, 47(3): 274-277.
[11]骆和东, 贾玉珠, 朱宝平. 固相萃取-超过滤-液相色谱/质谱联用法测定织纹螺中的河豚毒素[J]. 色谱, 2007, 25(6): 917-921.
[12]日本厚生劳动省. 食品卫生检查指针[M]. 东京: 日本食品卫生协会, 2005: 661-667.
 方力,邱凤梅,余新威,张志超.基质分散固相萃取净化-亲水液相色谱-串联质谱法检测织纹螺与贝类中河鲀毒素[J].中国食品卫生杂志,2017,29(4):434-438.
方力,邱凤梅,余新威,张志超.基质分散固相萃取净化-亲水液相色谱-串联质谱法检测织纹螺与贝类中河鲀毒素[J].中国食品卫生杂志,2017,29(4):434-438.