DOi:10.13590/j.cjfh.2017.06.006
生牛乳中乳铁蛋白的蛋白质芯片检测平台的评价研究
(中国疾病预防控制中心营养与健康所,北京100050)
收稿日期:2017-10-12
作者简介:殷继永男副研究员研究方向为营养与食品卫生学 E-mail:jyyin7579@163.com
通信作者:霍军生男研究员研究方向为营养与食品卫生学 E-mail:jshuo@263.net.cn
基金项目:中国疾病预防控制中心青年科研基金(2015A202)
摘要:目的对本研究前期建立的用于乳铁蛋白的蛋白质芯片检测平台进行评价。方法使用3份生牛乳样品,批内重复8次检测,计算批内精密度;另对3份生牛乳分别重复8个批次检测,计算批间精密度。对高浓度标准品稀释3个浓度后,进行稀释回收率试验;另对3个浓度基础液分别进行加标回收率试验;取10份生牛乳样品,分别用蛋白质芯片检测平台与商用酶联免疫吸附测定(ELISA)试剂盒进行检测并对结果进行方法学比较。结果用于生牛乳中乳铁蛋白的蛋白质芯片检测平台的批内精密度在9.79%~15.90%之间,批间精密度在11.63%~23.38%之间;稀释回收率在79.8%~129.7%之间,加标回收率在105.7%~133.9%之间;经比较,两种方法的相关系数r=0.825 2,差异有统计学意义(t=4.132,P<0.05),配对比较t检验结果显示两种方法差异无统计学意义(t=1.282,P>0.05)。结论本研究建立的用于乳铁蛋白的蛋白质芯片检测平台能够满足实验室检测需要,尚有操作偏倚需进一步优化。
关键词:
蛋白质芯片; 乳铁蛋白; 检测平台; 精密度; 准确性; 加标回收率; 评价; 生牛乳
文章编号:1004-8456(2017)06-0666-05
中图分类号:R155
文献标志码:A
The evaluation of protein microarray platform for lactoferrin detection in raw milk
(National Institute for Nutrition and Health, Chinese Center for Disease Control and Prevention, Beijing 100050,China)
Abstract:ObjectiveTo evaluate the protein microarray platform that previously established for lactoferrin detection in raw milk. MethodsTriplet raw milk samples were used to implement within-run precision of 8 repeats and other triplet raw milk samples were used to implement between-run precision of 8 batches. The high concentration standard was consecutively diluted for recovery test. Three concentrations of spiked samples were used for recovery. Ten raw milk samples were detected by protein chip platform and commercial ELISA Kit, respectively. ResultsThe within-run precision and between-run precision were 9.79%-15.90% and 11.63%-23.38%, respectively. The dilution recovery and recovery were 79.8%-129.7% and 105.7%-133.9%, respectively. The relevant coefficient of the two detection method was 0.825 2, the difference was significant (t=4.132, P<0.05), but the result of paired t test showed that there was no difference between the two method (t=1.282, P>0.05). ConclusionThe protein chip platform could satisfy the requirement of laboratory test, and its operation error need to be further optimized.
Key words:
Protein chip; lactoferrin; detection platform; precision; accuracy ability; recovery; evaluation; raw milk
乳铁蛋白(lactoferrin,Lf)是从牛乳中分离出来的一种蛋白质,具有增强铁的传递和吸收的作用,同时还具有广谱抗菌作用、免疫作用、抗氧化作用和促进肠道菌群平衡作用,已被广泛应用于婴儿配方食品等多类产品中。这些特点使得Lf可以作为评价牛乳营养价值的标志蛋白质之一。目前有许多检测方法应用于Lf的检测[1-8],但现有方法检测过程复杂、不易于掌握和操作,且对仪器要求较高。本研究前期利用蛋白质芯片技术,建立了针对牛乳中Lf的蛋白质芯片检测平台[9],该平台具有快速、高效、高灵敏度和操作性强的特点,但是其具体的检测性能是否能满足实验室阶段的检测需求,还需要相应的评价。目前对检测平台进行性能评价的试验包括评价精确性的批内精密度、批间精密度试验,评价准确性的稀释回收率、加标回收率及方法学对照试验,因此,本试验利用上述试验内容对前期建立的蛋白质芯片检测Lf的平台进行检测性能评价。
牛乳Lf标准品(PCode 1002101934,美国Sigma),Lf鼠单抗与兔多抗(北京华大蛋白质研发中心有限公司),Cy3标记的羊抗兔多抗(code 111-165-003,美国Jackson ImmunoResearch),阴性兔IgG,蛋白质芯片点样液A(code 440015)、晶芯 高分子三维基片(code 420040)均购自博奥生物有限公司,磷酸盐缓冲液(PBS),Tween20。10份不同采样点的生牛乳各50 ml(北京三元食品股份有限公司)。
各阵列中加入30 μl抗原Lf蛋白稀释液(37 ℃反应1 h),反应完全后用1‰ PBST洗涤芯片5次,每次5 min后1 000 r/min甩干2 min;各阵列加入30 μl检测抗体,Lf鼠单抗或Lf兔多抗(37 ℃反应1 h),反应完全后再进行芯片洗涤与甩干(条件同上);各阵列中加入30 μl Cy3标记的二抗(37 ℃反应1 h)后进行芯片洗涤与甩干,芯片扫描并获取检测图像与检测数据。
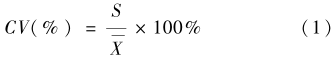 其中:CV:变异系数,S:标准差,X:均数。
其中:CV:变异系数,S:标准差,X:均数。

其中:S批间为批间试验的批间标准差,Xi为每天每批次检测结果均数,X1为每天每批的第一个检测结果,X2为每天每批的第二个检测结果,L为检测天数。
1.2.6方法学对照
取10份生牛乳,4 ℃ 12 000 r/min离心30 min后各取中间清澈乳清部分并进行编号,各生牛乳乳清分为两部分,一部分用于酶联免疫吸附测定(ELISA)试剂盒检测Lf含量,另一部分用于蛋白质芯片检测Lf的含量。对两种方法的检测结果,计算相关系数,并进行配对比较的t检验。
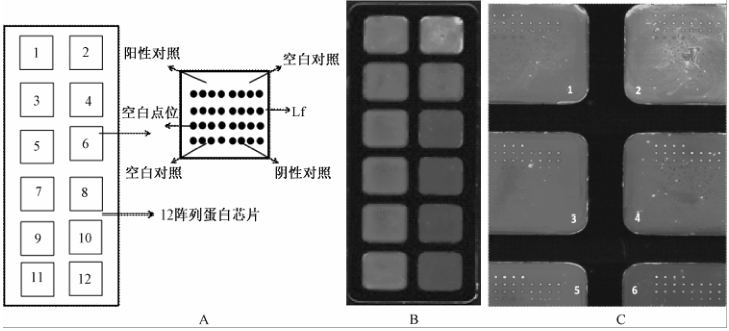
如图1-A所示,每张蛋白质芯片含有12个子阵列,在每个子阵列中包含4行×8列共32个点位,其中阳性对照、空白对照、阴性对照及Lf的点位分布与图1-A中子阵列的设计一致。在试验点样阶段,将Lf鼠单抗点样于每个子阵列的第二行;各阵列点样结束后,参照试验方法1.2.1的步骤,完成后续加抗原、加Lf兔多抗、加Cy3标记的羊抗兔等操作步骤,在试验结束时,每个子阵列的第二行的8个点显示的就是Lf的检测结果。因为不同子阵列间抗原的浓度各不相同,所以结合于各子阵列第二行的抗原量各不相同,相应各子阵列结合的兔多抗与Cy3标记的羊抗兔的量也各不相同,进而各阵列之间第二行的亮度各不相同;不同的信号亮度对应不同的信号值,因此根据各子阵列间信号值的高低可以反推出各子阵列中样品浓度的大小。
以精密度试验为例,每张芯片的2、4、6、8、10、12阵列依次加入从高到低的Lf标准品,1、3子阵列加入I号生牛乳样品,5、7子阵列加入II号生牛乳样品,9、11子阵列加入III号生牛乳样品。试验最终扫描结果如图1-B所示。
图1-C是对图1-B中1~6子阵列的放大图,可以看出,第2、4、6子阵列中第二行的亮度在依次减弱,利用扫描仪配套的数据分析软件(LuxScanTM Series Software)对各点位提值后的结果显示,各子阵列中相对应的信号值也在依次降低。因为2、4、6各阵列中加入的Lf浓度是依次减弱的,因此在2、4、6阵列间,抗原浓度与信号值存在线性决定关系,即,随着浓度的减弱,信号值在降低。由此绘制的标准曲线,可以计算出子阵列1、3、5、7,9、11中第二行信号值所对应的浓度,并据此可以评价出此平台检测I、II、III号样品时的精密度。
检测性能评价包括精密度评价(批内精密度与批间精密度)与准确度评价(稀释回收率、加标回收率、方法学对照)。这些指标分别可以从不同角度对所建立的检测平台的实用性能进行性能检验。关于批间精密度试验的天数,不同的文献有不同的报道[14-17],在试验平台建立阶段,批间精密度的试验天数与次数可从满足实验室需求出发进行确定。本研究选择检测4 d,每天两个批次的试验次数主要取决于本实验室对同一样品的重复验证不会超过4 d或8次,因此本研究中所选择的试验天数与次数能够满足对批间精密度的评价要求。在本平台进入生产阶段时,将按照生产要求对精密度时间与次数重新进行评价。此外,本平台的批内CV均<16%,批间CV均<25%,这主要与试验操作人员的熟练程度有关。本检测平台虽然在点样与扫描阶段均已实现一致性高的机械化操作,但在整个流程中还是存在多次手工操作的步骤,因此不熟练的手工操作是导致批间精密度>20%的主要原因。在后续的产品阶段中,如果提高操作人员熟练度,可以实现批间精密度低于20%的水平。从结果也可得出,虽然目前的批间精密度有待提高,但如果重复试验的次数与天数分别小于4 d或8次,则现有的批间精密度也能低于20%。目前对总精密度的认识还存在分歧,但按苏敏等[18]对总精密度的计算方法,可以分析出本研究中不同批次间差异与不同天次之间的差异是引起总精密度不理想的主要原因,因此,建议在产品应用阶段,从提高操作人员熟练程度出发,充分做好操作人员的上岗前培训、尽量减少其操作偏倚,进而降低不同批次间与不同检测天次间的操作误差。
稀释回收率试验结果显示,回收率随着稀释次数的增多而减小,这主要与连续稀释时的操作偏倚有关。在后续的产品阶段加强操作人员培训,或减少连续稀释次数,可以使这一结果得到提高。在加标回收率试验中,本研究参照吴树宏等[12]、伍云卿等[13]的方法,对三个浓度的基础液,分别加入基础液体积1%的高浓度加标溶液(5 927.3 ng/ml)。从结果可以看出,最低浓度的基础液回收效果不太理想,使得整体的回收水平偏低,这主要是由于目标蛋白浓度越低时,对其检测受其他因素干扰的效果就越大。根据这一情况,建议在后续的产品研发阶段,提高加标回收的基础液浓度。这一结果在另一方面也提示了本研究所建立的平台在较高浓度时准确度较理想,因此在未来的产品应用阶段,建议将待测样品按比例稀释在标准曲线的中、高浓度范围内,以便获得更为准确的检测结果。
因为本研究最终是要建立包括β-乳球蛋白、Lf等多个蛋白在内的同时检测多个蛋白指标的芯片平台,因此在做方法学对照试验时,分别加入了适当比例的β-乳球蛋白标准品与兔多抗,以期使试验条件尽可能的接近最终的条件并观察混合检测的可行性。试验通过多次比较,获得了现有的较为理想的结果。这为今后更大通量检测的实施奠定了很好的研究基础。
对方法学对照试验的结果显示,本研究所建立的平台与目前商用的ELISA试剂盒之间具有较好的一致性。因为生物学检测试验没有金标准,因此根据目前的试验结果无法判断哪种方法更优,但可以成为一种新的可替代ELISA试剂盒的检测生牛乳中Lf的方法。虽然这一方法在成为成熟的产品前还需要做出进一步的改进,但是从现有的结果可以看出,它已经能够满足本实验室的检测需求。
1材料与方法
1.1主要仪器与试剂
LuxScanTM10 K Microarray Scanner芯片扫描仪、Personal ArrayerTM16 Microarray Spotter蛋白质芯片点样仪均购自博奥生物有限公司。牛乳Lf标准品(PCode 1002101934,美国Sigma),Lf鼠单抗与兔多抗(北京华大蛋白质研发中心有限公司),Cy3标记的羊抗兔多抗(code 111-165-003,美国Jackson ImmunoResearch),阴性兔IgG,蛋白质芯片点样液A(code 440015)、晶芯 高分子三维基片(code 420040)均购自博奥生物有限公司,磷酸盐缓冲液(PBS),Tween20。10份不同采样点的生牛乳各50 ml(北京三元食品股份有限公司)。
1.2方法
1.2.1蛋白质芯片基本检测方法
将Lf的抗体探针Lf鼠单抗或Lf兔多抗和质控(阳性控制为无关兔IgG,阴性控制为1×点样buffer,空白控制为PBS)分别重复点样在三维基片的每一个阵列中。经37 ℃固定18.5 h后,按以下操作完成试验。各阵列中加入30 μl抗原Lf蛋白稀释液(37 ℃反应1 h),反应完全后用1‰ PBST洗涤芯片5次,每次5 min后1 000 r/min甩干2 min;各阵列加入30 μl检测抗体,Lf鼠单抗或Lf兔多抗(37 ℃反应1 h),反应完全后再进行芯片洗涤与甩干(条件同上);各阵列中加入30 μl Cy3标记的二抗(37 ℃反应1 h)后进行芯片洗涤与甩干,芯片扫描并获取检测图像与检测数据。
1.2.2批内精密度
基本试验过程参照方法1.2.1。将Lf标准品以1‰ PBST样品稀释液稀释5个标准浓度(270.10、90.55、45.28、22.64、11.32 ng/ml),以1‰ PBST为阴性对照做标准曲线。取3份生牛乳,编号为Ⅰ、Ⅱ、Ⅲ。其中生牛乳Ⅰ和Ⅱ按1∶400稀释,生牛乳Ⅲ按1∶800稀释后,批内重复8次检测,按公式1计算批内精密度。以30 μl/阵列加入各自相应的阵列。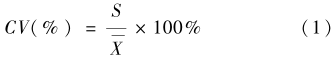 其中:CV:变异系数,S:标准差,X:均数。
其中:CV:变异系数,S:标准差,X:均数。
1.2.3批间精密度
基本试验过程参照方法1.2.1。取3份生牛乳,编号为Ⅳ、Ⅴ、Ⅵ。其中生牛乳Ⅳ和Ⅴ按1∶400稀释,生牛乳Ⅵ按1∶800稀释后,对3份生牛乳分8个批次检测、每批次内两阵列重复,以8个批次检测结果按公式2计算批间标准差,并以此结果结合均数值按公式1求批间精密度。以30 μl/阵列加入各自相应的阵列。
其中:S批间为批间试验的批间标准差,Xi为每天每批次检测结果均数,X1为每天每批的第一个检测结果,X2为每天每批的第二个检测结果,L为检测天数。
1.2.4稀释回收率
基本试验过程参照方法1.2.1。对高浓度标准品(181.10 ng/ml)连续稀释3个浓度(120.73、90.55、60.37 ng/ml)后,以30 μl/阵列加入各自相应的阵列,进行稀释回收率试验,并根据试验结果计算稀释回收率。
1.2.5加标回收率
基本试验过程参照方法1.2.1。对3个浓度基础液(92.6、61.74、30.87 ng/ml)进行加标回收率试验,每个浓度均加入其体积量1%的高浓度加标溶液(5 927.3 ng/ml),加标原则参照文献[10-11]中的要求;以30 μl/阵列加入各自相应的阵列。根据试验结果计算加标回收率。1.2.6方法学对照
取10份生牛乳,4 ℃ 12 000 r/min离心30 min后各取中间清澈乳清部分并进行编号,各生牛乳乳清分为两部分,一部分用于酶联免疫吸附测定(ELISA)试剂盒检测Lf含量,另一部分用于蛋白质芯片检测Lf的含量。对两种方法的检测结果,计算相关系数,并进行配对比较的t检验。
1.3统计学分析
所有的数据用Microsoft Office Excel 2007与SPSS 17.0进行分析处理。精密度评价试验以重复检测值的X、S及由二者确定的CV表示;准确度评价以每个检测信号值代入回归方程求浓度的X后进行计算;方法学对照评价,用配对比较的t检验和相关性分析对两种方法检测结果进行一致性评价。检验水准选定α=0.05,以P<0.05为差异有统计学意义。
2结果
2.1结果参考依据
本研究中所使用的蛋白质芯片基本检测方法,与前期建立蛋白质芯片平台研究中所优选出的基本检测方法相一致[9]。在精密度与准确度的方法学评价试验中,参照文献[10-11]中的评价方法进行评价,各试验中所使用的标准曲线参考前期平台建立时所建立的标准曲线并根据实际检测需要略做调整。在批内精密度与批间精密度评价中,分别随机选取3份生牛乳进行试验。研究中的重复次数参考文献[10-11];在稀释回收率试验中,为了减少大比例稀释可能带来的稀释偏倚,本研究所选择的3个稀释浓度均在检测标准曲线的中上部。在加标回收率试验中,为确保加标前后的检测结果都不超出标准曲线最高点与最低点,以保证评价的可行性,本研究结合相关文献报道[12-13],最终选择了现在使用的3个基础液浓度与加标液的浓度。方法学比较试验中使用的生牛乳样品选自北京周边奶源,因为这些奶源地的生牛乳质量相对稳定,所以本次评价试验中所使用的10份生牛乳已经能够满足实验室阶段的检测需求。 2.2蛋白质芯片扫描结果如图1-A所示,每张蛋白质芯片含有12个子阵列,在每个子阵列中包含4行×8列共32个点位,其中阳性对照、空白对照、阴性对照及Lf的点位分布与图1-A中子阵列的设计一致。在试验点样阶段,将Lf鼠单抗点样于每个子阵列的第二行;各阵列点样结束后,参照试验方法1.2.1的步骤,完成后续加抗原、加Lf兔多抗、加Cy3标记的羊抗兔等操作步骤,在试验结束时,每个子阵列的第二行的8个点显示的就是Lf的检测结果。因为不同子阵列间抗原的浓度各不相同,所以结合于各子阵列第二行的抗原量各不相同,相应各子阵列结合的兔多抗与Cy3标记的羊抗兔的量也各不相同,进而各阵列之间第二行的亮度各不相同;不同的信号亮度对应不同的信号值,因此根据各子阵列间信号值的高低可以反推出各子阵列中样品浓度的大小。
|
注:A为蛋白质芯片阵列设计;B为精密度评价试验扫描结果;C为精密度评价试验扫描结果中1~6阵列放大效果 图1蛋白质芯片阵列设计与扫描结果示意图 Figure 1Design of block and schematic diagram of scan for protein chip |
图1-C是对图1-B中1~6子阵列的放大图,可以看出,第2、4、6子阵列中第二行的亮度在依次减弱,利用扫描仪配套的数据分析软件(LuxScanTM Series Software)对各点位提值后的结果显示,各子阵列中相对应的信号值也在依次降低。因为2、4、6各阵列中加入的Lf浓度是依次减弱的,因此在2、4、6阵列间,抗原浓度与信号值存在线性决定关系,即,随着浓度的减弱,信号值在降低。由此绘制的标准曲线,可以计算出子阵列1、3、5、7,9、11中第二行信号值所对应的浓度,并据此可以评价出此平台检测I、II、III号样品时的精密度。
2.3批内精密度
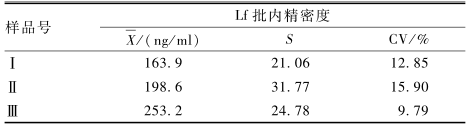
对3份生牛乳样品进行批内重复检测的结果显示,蛋白质芯片检测平台对生牛乳中Lf检测的批内精密度在9.79%~15.90%之间(表1)。
|
表1蛋白质芯片检测Lf的批内精密度评价(n=8) Table 1Intra-assay precision evaluation for Lf by using protein microarray |
2.4批间精密度
对3份生牛乳样品进行批间重复检测的结果显示,蛋白质芯片检测平台对生牛乳中Lf检测时,每批内2个结果间的批内精密度在7.12%~14.32%之间,日间精密度在19.13%~30.23%之间,每批次之间的批间精密度在11.63%~23.38%之间,总批间精密度在28.42%~35.00%之间(表2)。
|
|
表2蛋白质芯片检测Lf的批间精密度评价(n=8) Table 2Inter-assay precision evaluation for Lf by using protein microarray |
2.5稀释回收率
稀释回收率结果显示,蛋白质芯片检测平台检测3个浓度Lf的稀释回收率在79.8%~129.7%之间(表3),其平均回收率为109.1%。|
|
表3蛋白质芯片检测Lf的回收率评价 Table 3Evaluation for recovery of Lf by using protein microarray |
2.6加标回收率
加标回收率结果显示,蛋白质芯片检测平台检测3个浓度Lf的加标回收率在105.7%~133.9%之间(表3),其平均回收率为123.3%。
2.7方法学对照
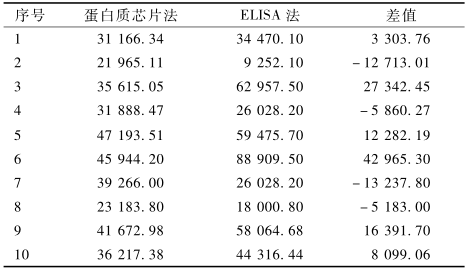
方法学对照的结果显示,两种方法的相关系数r=0.825 2,经检验差异有统计学意义(t=4.132,P<0.05),10份样品的蛋白质芯片法检测的平均结果为(35 411±8 598) ng/ml,ELISA法的平均检测结果为(42 750±24 536) ng/ml,平均差值为(7 339±5 724) ng/ml。配对比较t检验结果显示两种方法之间差异无统计学意义(t=1.282,P>0.05),见表4。
|
表4蛋白质芯片法与ELISA法配对比较的t检验(ng/ml) Table 4Pair-t test between protein microarray and ELISA |
3讨论
利用蛋白质芯片实现对样品中特定物质含量的测定是一种新兴的检测技术,目前国内外鲜见有利用此技术对牛乳中Lf进行研究的报道。本课题组前期建立了利用蛋白质芯片检测Lf的检测平台,并对此平台的检测条件进行了优化与确定。本研究主要对这一检测平台的检测性能进行综合评价。本研究使用的芯片扫描仪含有双激光发射器,采用了包括光学、信号处理和运动控制系统在内的十余项技术,是进行高、中、低密度微阵列芯片检测与分析的必备工具。它采用532和635 nm两种激发波长,配合专业设计的信号采集与处理电路,从而使得该仪器具有良好的线性动态范围和极高的检测灵敏度,为获得最终的评价结果提供了有力的技术支持。检测性能评价包括精密度评价(批内精密度与批间精密度)与准确度评价(稀释回收率、加标回收率、方法学对照)。这些指标分别可以从不同角度对所建立的检测平台的实用性能进行性能检验。关于批间精密度试验的天数,不同的文献有不同的报道[14-17],在试验平台建立阶段,批间精密度的试验天数与次数可从满足实验室需求出发进行确定。本研究选择检测4 d,每天两个批次的试验次数主要取决于本实验室对同一样品的重复验证不会超过4 d或8次,因此本研究中所选择的试验天数与次数能够满足对批间精密度的评价要求。在本平台进入生产阶段时,将按照生产要求对精密度时间与次数重新进行评价。此外,本平台的批内CV均<16%,批间CV均<25%,这主要与试验操作人员的熟练程度有关。本检测平台虽然在点样与扫描阶段均已实现一致性高的机械化操作,但在整个流程中还是存在多次手工操作的步骤,因此不熟练的手工操作是导致批间精密度>20%的主要原因。在后续的产品阶段中,如果提高操作人员熟练度,可以实现批间精密度低于20%的水平。从结果也可得出,虽然目前的批间精密度有待提高,但如果重复试验的次数与天数分别小于4 d或8次,则现有的批间精密度也能低于20%。目前对总精密度的认识还存在分歧,但按苏敏等[18]对总精密度的计算方法,可以分析出本研究中不同批次间差异与不同天次之间的差异是引起总精密度不理想的主要原因,因此,建议在产品应用阶段,从提高操作人员熟练程度出发,充分做好操作人员的上岗前培训、尽量减少其操作偏倚,进而降低不同批次间与不同检测天次间的操作误差。
稀释回收率试验结果显示,回收率随着稀释次数的增多而减小,这主要与连续稀释时的操作偏倚有关。在后续的产品阶段加强操作人员培训,或减少连续稀释次数,可以使这一结果得到提高。在加标回收率试验中,本研究参照吴树宏等[12]、伍云卿等[13]的方法,对三个浓度的基础液,分别加入基础液体积1%的高浓度加标溶液(5 927.3 ng/ml)。从结果可以看出,最低浓度的基础液回收效果不太理想,使得整体的回收水平偏低,这主要是由于目标蛋白浓度越低时,对其检测受其他因素干扰的效果就越大。根据这一情况,建议在后续的产品研发阶段,提高加标回收的基础液浓度。这一结果在另一方面也提示了本研究所建立的平台在较高浓度时准确度较理想,因此在未来的产品应用阶段,建议将待测样品按比例稀释在标准曲线的中、高浓度范围内,以便获得更为准确的检测结果。
因为本研究最终是要建立包括β-乳球蛋白、Lf等多个蛋白在内的同时检测多个蛋白指标的芯片平台,因此在做方法学对照试验时,分别加入了适当比例的β-乳球蛋白标准品与兔多抗,以期使试验条件尽可能的接近最终的条件并观察混合检测的可行性。试验通过多次比较,获得了现有的较为理想的结果。这为今后更大通量检测的实施奠定了很好的研究基础。
对方法学对照试验的结果显示,本研究所建立的平台与目前商用的ELISA试剂盒之间具有较好的一致性。因为生物学检测试验没有金标准,因此根据目前的试验结果无法判断哪种方法更优,但可以成为一种新的可替代ELISA试剂盒的检测生牛乳中Lf的方法。虽然这一方法在成为成熟的产品前还需要做出进一步的改进,但是从现有的结果可以看出,它已经能够满足本实验室的检测需求。
参考文献
[1]卢蓉蓉,许时婴.乳铁蛋白测定方法的比较[J].中国乳品工业,2002,30(5):123-125.
[2]李珊珊,王加启,魏宏阳,等.乳及乳制品中乳铁蛋白定量测定方法的建立——SDS-PAGE法[J].中国乳业,2008(9):42-46.
[3]DUPONTD D,ARNOULDC C,ROLET R D,et al.Determination of bovine lactoferrin concentrations in cheese with specific monoclonal antibodies[J].International Dairy Journal,2006,16(9):1081-1087.
[4]PALMANO K P,ELGAR D F.Detection and quantitation of lactoferrin in bovine whey samples by reversed-phase high performance liquid chromatography on polystyrene-divinylbenzene[J].Journal of Chromatography A,2002,947(2):307-311.
[5]NAMBA S,ISHII T,OKUDA Y,et al.Development of latex agglutination turbidimetric immunoassay for the quantitative measurement reagents of human and bovine lactoferrin[J].Foods and Food Ingredients Journal of Japan,2006,211(5):387.
[6]SOEJIMA T,YAMAUCHI K,YAMAMOTO T,et al.Determination of bovine lactoferrin in lactoferrin-supplemented dairy products and raw milk by an automated latex assay[J].Journal of Dairy Research,2007,74(1):100-105.
[7]YAMAUCHI K,SOEJIMA T,OHARA Y,et al.Rapid determination of bovine lactoferrin in dairy products by an automated quantitative agglutination assay based on latex beads coated with F(ab’)2 fragments[J].Biometals,2004,17(3):349-352.
[8]陈晓旭,宋桂雪,童玉,等.高效亲和色谱法检测液体奶和奶制品中乳铁蛋白的质量浓度[J].中国乳品工业,2013,41(12):40-42.
[9]殷继永,马欣欣,孙静,等. 蛋白质芯片检测牛乳中乳铁蛋白条件的优化研究[J].中国食品卫生杂志,2016,28(6):720-724.
[10]林宁,赵久红,戴卫,等.自建半自动生化检测系统精密度和准确度评价[J].检验医学与临床,2009,6(15):1230-1234.
[11]李如凯.HLC-723G7糖化血红蛋白分析仪的精密度和准确度性能评价[J].临床和实验医学杂志,2011,10(12):951-952.
[12]吴树宏,周春华.加标回收率计算方法的探讨[J].甘肃环境研究与监测,2000,13(3):179-180.
[13]伍云卿,涂杰峰,范超,等.加标回收实验方案探讨[J].福建分析测试,2010,19(3):67-68.
[14]陈保民,陈维娜.酶联免疫吸附实验全自动检测的控制[J].职业与健康,2002, 18(5):46-47.
[15]蒋理,徐建,杨瑞霞.散射比浊法测定血清铁蛋白的方法学评价[J].放射免疫学杂志,2008, 21(2):182-183.
[16]COOK J D, FLOWERS C H,SKIKNE B S. The quantitative assessment of body iron[J].Blood, 2003,101(9):3359-3364.
[17]JUERGEN G E, JOHN E, CHRESTINE M P, et al. Combined measurement of ferritin, soluble transferrin receptor, retinol binding protein, and C-reactive protein by an inexpensive, sensitive, and simple sandwich enzyme-linked immunosorbent assay technique[J].J Nutr, 2004, 134(11):3127-3132.
[18]苏敏,沙玲,台虹. STAGO-STA型全自动血凝仪APTT测定总精密度评价[J].中国医学检验杂志,2001,2(5):348-350.
[2]李珊珊,王加启,魏宏阳,等.乳及乳制品中乳铁蛋白定量测定方法的建立——SDS-PAGE法[J].中国乳业,2008(9):42-46.
[3]DUPONTD D,ARNOULDC C,ROLET R D,et al.Determination of bovine lactoferrin concentrations in cheese with specific monoclonal antibodies[J].International Dairy Journal,2006,16(9):1081-1087.
[4]PALMANO K P,ELGAR D F.Detection and quantitation of lactoferrin in bovine whey samples by reversed-phase high performance liquid chromatography on polystyrene-divinylbenzene[J].Journal of Chromatography A,2002,947(2):307-311.
[5]NAMBA S,ISHII T,OKUDA Y,et al.Development of latex agglutination turbidimetric immunoassay for the quantitative measurement reagents of human and bovine lactoferrin[J].Foods and Food Ingredients Journal of Japan,2006,211(5):387.
[6]SOEJIMA T,YAMAUCHI K,YAMAMOTO T,et al.Determination of bovine lactoferrin in lactoferrin-supplemented dairy products and raw milk by an automated latex assay[J].Journal of Dairy Research,2007,74(1):100-105.
[7]YAMAUCHI K,SOEJIMA T,OHARA Y,et al.Rapid determination of bovine lactoferrin in dairy products by an automated quantitative agglutination assay based on latex beads coated with F(ab’)2 fragments[J].Biometals,2004,17(3):349-352.
[8]陈晓旭,宋桂雪,童玉,等.高效亲和色谱法检测液体奶和奶制品中乳铁蛋白的质量浓度[J].中国乳品工业,2013,41(12):40-42.
[9]殷继永,马欣欣,孙静,等. 蛋白质芯片检测牛乳中乳铁蛋白条件的优化研究[J].中国食品卫生杂志,2016,28(6):720-724.
[10]林宁,赵久红,戴卫,等.自建半自动生化检测系统精密度和准确度评价[J].检验医学与临床,2009,6(15):1230-1234.
[11]李如凯.HLC-723G7糖化血红蛋白分析仪的精密度和准确度性能评价[J].临床和实验医学杂志,2011,10(12):951-952.
[12]吴树宏,周春华.加标回收率计算方法的探讨[J].甘肃环境研究与监测,2000,13(3):179-180.
[13]伍云卿,涂杰峰,范超,等.加标回收实验方案探讨[J].福建分析测试,2010,19(3):67-68.
[14]陈保民,陈维娜.酶联免疫吸附实验全自动检测的控制[J].职业与健康,2002, 18(5):46-47.
[15]蒋理,徐建,杨瑞霞.散射比浊法测定血清铁蛋白的方法学评价[J].放射免疫学杂志,2008, 21(2):182-183.
[16]COOK J D, FLOWERS C H,SKIKNE B S. The quantitative assessment of body iron[J].Blood, 2003,101(9):3359-3364.
[17]JUERGEN G E, JOHN E, CHRESTINE M P, et al. Combined measurement of ferritin, soluble transferrin receptor, retinol binding protein, and C-reactive protein by an inexpensive, sensitive, and simple sandwich enzyme-linked immunosorbent assay technique[J].J Nutr, 2004, 134(11):3127-3132.
[18]苏敏,沙玲,台虹. STAGO-STA型全自动血凝仪APTT测定总精密度评价[J].中国医学检验杂志,2001,2(5):348-350.
