DOi:10.13590/j.cjfh.2017.06.007
海产品中溶藻弧菌的分离及多种方法鉴定效果的比较
(北京出入境检验检疫局检验检疫技术中心,北京100026)
收稿日期:2017-07-28
作者简介:赵晓娟女工程师研究方向为食品安全与微生物检测
E-mail:zhaoxj@bjciq.gov.cn
通信作者:曾静女研究员研究方向为食品安全与微生物检测
E-mail:zengj@bjciq.gov.cn
基金项目:国家重点研发计划项目(2016YFD0401100);国家质检总局科技计划项目(2017IK145);北京检验检疫技术中心自立科研课题(2017JK008)
摘要:目的了解北京市市售海产品中溶藻弧菌的污染情况,并对使用不同方法鉴定溶藻弧菌的效果进行比较。方法样品经碱性蛋白胨水增菌后,分别于硫代硫酸盐柠檬酸盐胆盐蔗糖(TCBS)琼脂培养基和科玛嘉弧菌显色培养基上划线培养,实时荧光聚合酶链式反应(PCR)法鉴定可疑菌落。以rpoB基因测序方法为参考,比较了实时荧光PCR和VITEK两种方法的鉴定效果。结果对北京市水产品市场随机采集的116份海产品进行了检测,实时荧光PCR法鉴定出溶藻弧菌阳性样品95份,检出率高达82%。使用科玛嘉弧菌显色培养基的检出率高于TCBS培养基,分别为82%(95/116)和72%(83/116)。经rpoB基因核苷酸序列测定确定95株疑似菌株为溶藻弧菌。采用VITEK 2 COMPACT GN鉴定卡对这95株菌株进行鉴定,31株鉴定为溶藻弧菌,其余未能得到准确的鉴定结果。结论北京市市售海产品中溶藻弧菌检出率高。科玛嘉弧菌显色培养基比TCBS琼脂培养基更适于溶藻弧菌的分离,实时荧光PCR法的鉴定效果优于VITEK法。
关键词:
溶藻弧菌; 分离鉴定; rpoB基因; 实时荧光聚合酶链式反应; VITEK 2 COMPACT; 海产品; 食源性致病菌
文章编号:1004-8456(2017)06-0671-05
中图分类号:R155
文献标志码:A
Comparison of the identification methods of VITEK, RT-PCR and rpoB sequencing on Vibrio alginolyticus isolated from seafood
(Inspection and Quarantine Technical Center of Beijing Entry-Exit Inspection and Quarantine Bureau, Beijing 100026, China)
Abstract:ObjectiveTo investigate the contamination of Vibrio alginolyticus in seafood sold in Beijing and compare the different identification method. MethodsAfter enrichment with alkaline peptone water (APW), a loopful from APW culture was streaked on thiosulfate citrate bile salts sucrose agar(TCBS)and CHROMagar Vibrio simultaneously. Typical colonies of Vibrio alginolyticus were identified with reverse transcription polymerase chain reaction (RT-PCR).The isolated 95 Vibrio alginolyticus strains were also identified with VITEK 2 COMPACT GN card and rpoB gene sequencing. ResultsVibrio alginolyticus strains were isolated from 116 seafood which were collected randomly from markets in Beijing. The result indicated that the detection of Vibrio alginolyticus in seafood was high in Beijing, about 82% (95/116). CHROMagar Vibrio media got higher detection rate than TCBS media, which were 82% (95/116) and 72% (83/116) respectively. RT-PCR result were in good accordance with that of rpoB gene sequencing, while VITEK 2 COMPACT GN card could only identify 32.6% (31/95) of the isolated strains as Vibrio alginolyticus. ConclusionThe contamination of Vibrio alginolyticus in seafood was serious in Beijing. CHROMagar Vibrio media was better than TCBS media for isolation. RT-PCR could give a more precise result than VITEK.
Key words:
Vibrio alginolyticus; isolation and identification; rpoB gene sequencing; reverse transcription polymerase chain reaction; VITEK 2 COMPACT; seafood; foodborne pathogens
溶藻弧菌(Vibrio alginolyticus)是革兰阴性短杆菌,专性嗜盐,广泛分布于海洋和江河入海口的水域中,数量居海水类弧菌之首。溶藻弧菌最初被认为是副溶血弧菌(Vibrio parahaemolyticus)的一个生物型,后来独立为一个种[1-2]。该菌是多数海洋鱼类和贝类的条件致病菌,可通过受损的鱼类皮肤和口腔引发感染,并可导致人类的多种疾病,包括腹泻、创伤感染、眼结膜炎、中耳炎等[3-5]。近年来的研究证实该菌是沿海地区腹泻病和食物中的常见病原菌,引起食物中毒和胃肠炎的报道屡见不鲜[6-9]。
目前,我国国家标准中还没有溶藻弧菌的检测方法。文献中报导的溶藻弧菌的检测方法也不统一,常用的分离培养基有硫代硫酸盐柠檬酸盐胆盐蔗糖(TCBS)琼脂培养基和科玛嘉弧菌显色培养基,常用的鉴定方法有VITEK方法和聚合酶链式反应(PCR)方法[10-14]。VITEK是传统微生物检测方法中最常用的微生物鉴定仪器,而且依据产品说明书,GN卡能够鉴定包括溶藻弧菌和副溶血性弧菌在内的8种重要的弧菌[14]。SN/T 1870—2016《出口食品中食源性致病菌检测方法 实时荧光PCR法》[15]提供了溶藻弧菌可疑菌落的实时荧光PCR检测方法。比较不同培养基的分离效果以及VITEK方法和PCR方法的鉴定效果,对于建立快速准确检测溶藻弧菌的方法具有十分重要的意义。
基因测序方法也是一种常用的细菌种类鉴定方法。美国ABI公司开发的用于微生物鉴定的Microseq试剂盒的靶基因即为16S rRNA基因。尽管16S rRNA基因序列多年来被视为细菌鉴定的金标准,但是越来越多的研究发现16S rRNA基因在识别某些亲缘关系很近的细菌时存在着不足,如无法分开克罗诺杆菌属中的阪崎克罗诺杆菌(Cronobacter sakazakii)和丙二酸盐阳性克罗诺杆菌(Cronobacter malnoticus)[16],也无法分开弧菌属中的副溶血性弧菌和溶藻弧菌[17-18]。更多的研究[19]发现,采用功能基因rpoB的部分核苷酸序列能更加准确地将弧菌属鉴定到种。MOLLET等[20]首次将rpoB序列分析用于细菌物种鉴定,TARR等[21]在10年后成功将其应用于弧菌分离,OBERBECKMANN等[22]利用rpoB准确地区分了副溶血性弧菌和溶藻弧菌。
本研究采用传统的细菌分离结合实时荧光PCR方法对北京市市场海产品中的溶藻弧菌进行了分离和鉴定,同时以rpoB基因序列结果为参考,比较了VITEK方法和实时荧光PCR法的鉴定效果。旨在了解北京市市售海产品中溶藻弧菌的污染情况,及对使用不同方法鉴定溶藻弧菌的准确率做一个初步的评估。
胰酪胨大豆琼脂(TSA)培养基、TCBS琼脂培养基、碱性蛋白胨均购自北京陆桥技术责任有限公司,科玛嘉弧菌显色培养基(法国CHROMagar),VITEK GN鉴定卡(法国生物梅里埃),Gene Expression Master Mix(美国ABI),细菌基因组DNA提取试剂盒(离心柱型,天根生化科技有限公司),rTaq酶(日本Takara),去离子水,氯化钠。PCR引物、探针由上海生工生物有限公司合成。
扩增rpoB基因PCR反应体系:rTaq酶(5 U/μl)0.2 μl,10×buffer 5 μl,脱氧核糖核苷三磷酸(dNTP,2.5 mmol/L)4 μl,上、下游引物(10 pmol/μl)各2 μl,DNA模板1 μl,去离子水补充至50 μl。rpoB基因扩增引物:rpoB 458F:5′-agg cgt gtt ctt cga cag cga taa-3′;rpoB 2105R:5′-cgg cta cgt tac gtt cga tac cag-3′。rpoB基因扩增反应条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃延伸5 min[22]。PCR扩增产物经1%琼脂糖凝胶电泳确定特异条带,送生工生物工程(上海)有限公司测序。序列经拼接核对后上传至GenBank,序列号为MF541144~MF541240。
虽然目前我国国家标准中对溶藻弧菌的检测方法还没有具体规定,但大多数溶藻弧菌的分离培养流程是增菌后划线TCBS琼脂培养基,选取黄色可疑菌落进行纯化和鉴定[13,28];或是增菌后先划线TCBS琼脂培养基,从其上挑取可疑菌落转接至科玛嘉弧菌显色培养基,挑取无色菌落再进行纯化和鉴定[11]。本研究结果可以看出,116份样品增菌后同时接种TCBS和科玛嘉弧菌显色培养基,经TCBS琼脂培养基分离,溶藻弧菌的检出率为72%(83/116)。而通过科玛嘉弧菌显色培养基分离,溶藻弧菌的检出率为82%(95/116)。TCBS琼脂培养基是传统方法分离弧菌最常用的选择性培养基,但是在其上长成黄色菌落的除了溶藻弧菌外还有霍乱弧菌等。而科玛嘉弧菌显色培养基上的溶藻弧菌为白色,霍乱弧菌是土耳其蓝色。研究结果显示在分离溶藻弧菌时,科玛嘉弧菌显色培养基的分离效果好于TCBS选择性培养基,可以降低漏检机率,提高检验的准确性。
实时荧光PCR法、VITEK法及rpoB基因测序3种检测方法的结果分析显示,rpoB基因序列NCBI数据库的比对结果及建立的系统发育树结果都表明分离得到的95株菌株全部为溶藻弧菌,与实时荧光PCR结果完全一致。应用VITEK 2 COMPACT鉴定系统对这95株溶藻弧菌进行鉴定,有31株与分子结果完全一致,不一致的为12株,存在溶藻弧菌和副溶血性弧菌难以区分的为50株。溶藻弧菌与副溶血性弧菌不论在表型还是遗传型上都十分相似,这也许是造成本研究中53%的溶藻弧菌和副溶血性弧菌区分不开的原因之一,因此,溶藻弧菌通过分子生物学方法鉴定的准确率明显高于VITEK 2 COMPACT GN鉴定卡的鉴定结果。rpoB基因测序方法虽然准确,但检测时间长、检测费用高,因而常规检测中最为便捷有效的方法为实时荧光PCR法。VITEK检测法由于溶藻弧菌与副溶血性弧菌生化反应差异较小,鉴定效果无法满足日常检测工作的需要。
综上所述,本研究结果显示增菌处理后划线科玛嘉弧菌显色培养基,挑取可疑菌落进行实时荧光PCR法鉴定的流程用来分离鉴定溶藻弧菌最为准确、便捷、有效。
目前,我国国家标准中还没有溶藻弧菌的检测方法。文献中报导的溶藻弧菌的检测方法也不统一,常用的分离培养基有硫代硫酸盐柠檬酸盐胆盐蔗糖(TCBS)琼脂培养基和科玛嘉弧菌显色培养基,常用的鉴定方法有VITEK方法和聚合酶链式反应(PCR)方法[10-14]。VITEK是传统微生物检测方法中最常用的微生物鉴定仪器,而且依据产品说明书,GN卡能够鉴定包括溶藻弧菌和副溶血性弧菌在内的8种重要的弧菌[14]。SN/T 1870—2016《出口食品中食源性致病菌检测方法 实时荧光PCR法》[15]提供了溶藻弧菌可疑菌落的实时荧光PCR检测方法。比较不同培养基的分离效果以及VITEK方法和PCR方法的鉴定效果,对于建立快速准确检测溶藻弧菌的方法具有十分重要的意义。
基因测序方法也是一种常用的细菌种类鉴定方法。美国ABI公司开发的用于微生物鉴定的Microseq试剂盒的靶基因即为16S rRNA基因。尽管16S rRNA基因序列多年来被视为细菌鉴定的金标准,但是越来越多的研究发现16S rRNA基因在识别某些亲缘关系很近的细菌时存在着不足,如无法分开克罗诺杆菌属中的阪崎克罗诺杆菌(Cronobacter sakazakii)和丙二酸盐阳性克罗诺杆菌(Cronobacter malnoticus)[16],也无法分开弧菌属中的副溶血性弧菌和溶藻弧菌[17-18]。更多的研究[19]发现,采用功能基因rpoB的部分核苷酸序列能更加准确地将弧菌属鉴定到种。MOLLET等[20]首次将rpoB序列分析用于细菌物种鉴定,TARR等[21]在10年后成功将其应用于弧菌分离,OBERBECKMANN等[22]利用rpoB准确地区分了副溶血性弧菌和溶藻弧菌。
本研究采用传统的细菌分离结合实时荧光PCR方法对北京市市场海产品中的溶藻弧菌进行了分离和鉴定,同时以rpoB基因序列结果为参考,比较了VITEK方法和实时荧光PCR法的鉴定效果。旨在了解北京市市售海产品中溶藻弧菌的污染情况,及对使用不同方法鉴定溶藻弧菌的准确率做一个初步的评估。
1材料与方法
1.1材料
1.1.1样品来源
样品采集于北京市各大水产品市场,按随机采样原则采集116份鲜活海产品,其中鱼类33份、贝类63份、虾类20份。
1.1.2菌株来源
用于验证实时荧光PCR引物和探针特异性的菌株共24株,包括7株标准菌株(见表1)和17株实验室自分离菌株。自分离菌株为4株溶藻弧菌,3株霍乱弧菌(Vibrio cholera),1株副溶血性弧菌,3株弗尼斯弧菌(Vibrio furnissii),3株哈维弧菌(Vibrio harveyi)和3株纳瓦拉弧菌(Vibrio navarrensis)。所有分离菌株经测序确认。
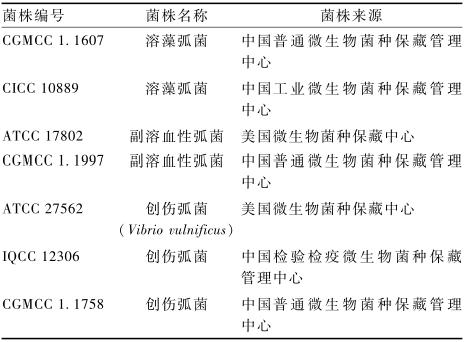
|
表1标准菌株信息 Table 1Information of reference strains |
1.1.3主要仪器与试剂
VITEK 2 COMPACT(法国生物梅里埃),Friocell 222 L培养箱,7900HT Fast Real-Time PCR仪(美国Applied Biosystems),高速离心机,台式离心机。胰酪胨大豆琼脂(TSA)培养基、TCBS琼脂培养基、碱性蛋白胨均购自北京陆桥技术责任有限公司,科玛嘉弧菌显色培养基(法国CHROMagar),VITEK GN鉴定卡(法国生物梅里埃),Gene Expression Master Mix(美国ABI),细菌基因组DNA提取试剂盒(离心柱型,天根生化科技有限公司),rTaq酶(日本Takara),去离子水,氯化钠。PCR引物、探针由上海生工生物有限公司合成。
1.2方法
1.2.1样品的取样及处理
鱼类样品用75%乙醇体表消毒后,无菌取其内脏、鳃及鱼肉等。贝类先用自来水将其外壳上的污泥冲掉,用75%乙醇消毒外壳边缘,敲开外壳,以无菌操作取出内脏或含内脏的全部贝肉和贝液。将不同的海产品于灭菌的研钵中充分研碎,或用灭菌剪刀充分剪碎,取10 g样品,放于装有90 ml的3%NaCl的碱性蛋白胨水(APW)中,37 ℃增菌 24 h。
1.2.2溶藻弧菌的分离及特征性菌落的挑选
增菌后,分别接种于TCBS选择性培养基和科玛嘉弧菌显色培养基上,37 ℃培养18~24 h。每块TCBS琼脂培养基上随机挑取3~5个黄色可疑菌落,每块科玛嘉弧菌显色培养基上随机挑取3~5个白色可疑菌落。将可疑菌落划线接种2%TSA培养基纯化,对纯化后的菌落进行实时荧光PCR法鉴定。
1.2.3溶藻弧菌的实时荧光PCR法鉴定
纯化后的菌落取单克隆重悬于20 μl TE中,取1 μl作为模板。采用SN/T 1870—2016[15]中的引物序列F:5-GAGCTTTCTGTTGAATGTAACGACAC-3,R:5-ACCCACACGCTCCATTGC-3,探针序列:FAM5-TCTCTGCAAACTCAGACGCAAGCGTAGG-3TAMRA。PCR反应体系(25 μl):2×Gene Expression Master Mix 12.5 μl,上、下游引物(10 pmol/μl)各1.0 μl,探针(10 pmol/μl)0.5 μl,模板1.0 μl,去离子水补充至25 μl。
1.2.4VITEK系统鉴定
细菌快速鉴定按照VITEK 2 COMPACT鉴定系统GN鉴定卡说明书操作。
1.2.5rpoB基因扩增及测序
基因组DNA提取:95株菌分别接种到5 ml增菌培养基APW中,增菌培养12 h后,取1 ml菌液按照试剂盒说明书提取细菌基因组DNA,-20 ℃保存备用。扩增rpoB基因PCR反应体系:rTaq酶(5 U/μl)0.2 μl,10×buffer 5 μl,脱氧核糖核苷三磷酸(dNTP,2.5 mmol/L)4 μl,上、下游引物(10 pmol/μl)各2 μl,DNA模板1 μl,去离子水补充至50 μl。rpoB基因扩增引物:rpoB 458F:5′-agg cgt gtt ctt cga cag cga taa-3′;rpoB 2105R:5′-cgg cta cgt tac gtt cga tac cag-3′。rpoB基因扩增反应条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃延伸5 min[22]。PCR扩增产物经1%琼脂糖凝胶电泳确定特异条带,送生工生物工程(上海)有限公司测序。序列经拼接核对后上传至GenBank,序列号为MF541144~MF541240。
1.2.6rpoB系统发育树的构建
从美国国家生物技术信息中心(NCBI)下载弧菌属其他高同源性标准菌株的相关序列和水产品中常见弧菌的相关序列,包括美人鱼发光杆菌(Photobacterium damselae)、轮虫弧菌(Vibrio rotiferianu)、哈维弧菌、副溶血性弧菌、纳瓦拉弧菌、创伤弧菌、双氮养弧菌(Vibrio diazotrophicus)、霍乱弧菌、拟态弧菌(Vibrio mimicus)、河弧菌(Vibrio fluvialis)、弗尼斯弧菌,用于系统发育分析。将NCBI下载的和测序所得的所有序列都导入BioEdit软件进行序列比对,ClustalX软件进行文件格式转化后导入PAUP 4.0软件进行聚类分析。用非加权组平均(UPGMA)法mean计算方法构建系统发育树。进行自举分析(Bootstrap)做置信度检测,自举数集1 000次。
2结果与分析
2.1溶藻弧菌的初筛
样品选择性增菌后,在TCBS琼脂平板上的典型菌落呈圆形、凸起、光滑、湿润、粘稠、边缘整齐的黄色菌落,直径2~3 mm;在科玛嘉弧菌显色培养基上的典型菌落呈圆形、扁平的白色菌落,直径2~3 mm。将116份增菌液同时划线TCBS和科玛嘉弧菌显色2种选择性培养基。TCBS琼脂培养基上得到黄色单菌落的有99份,科玛嘉弧菌显色培养基上得到白色单菌落的有95份。
2.2溶藻弧菌的实时荧光PCR鉴定
2.2.1引物探针特异性检测
用实验室保存的包括溶藻弧菌在内的7种弧菌对所选实时荧光PCR方法的引物探针特异性进行检测,结果如图1所示。所有溶藻弧菌扩增后出现了典型的扩增曲线,判定为阳性;其他菌株和空白对照则为平直的线,判定为阴性。
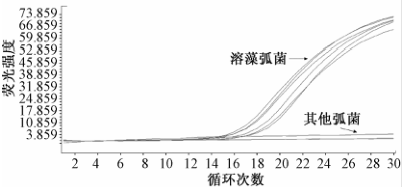
|
图1溶藻弧菌实时荧光PCR方法特异性结果 Figure 1Specificity of real-time PCR reaction system of Vibrio alginolyticus |
2.2.2可疑菌落溶藻弧菌的实时荧光PCR法检测结果
对分离得到的所有可疑菌落进行实时荧光PCR法检测。TCBS琼脂培养基上的99份黄色单菌落经实时荧光PCR法检测得到83份溶藻弧菌;科玛嘉弧菌显色培养基上的95份白色单菌落经实时荧光PCR法检测得到95份溶藻弧菌。
2.3基于rpoB基因的系统发育分析结果
将分离得到的95株溶藻弧菌的rpoB基因序列与NCBI下载的弧菌属其他高同源性标准菌株的相关序列以及水产品中常见弧菌的相关序列进行系统发育分析,结果见图2。95株分离株形成一个独立的分支,并与本试验所用溶藻弧菌的标准菌株CICC 10889、CGMCC 1.1607及NCBI下载的溶藻弧菌ATCC 17749(CP013484.1)聚在一支,说明分离株均为溶藻弧菌。
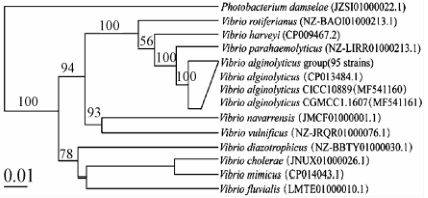
|
图2基于rpoB基因构建的弧菌系统发育树 Figure 2Phylogenetic tree of Vibrio based on the sequences of rpoB gene |
2.4溶藻弧菌VITEK系统鉴定结果
将分离得到的95株溶藻弧菌进行VITEK鉴定,结果见表2。31株鉴定为溶藻弧菌,50株的鉴定结果为低分辨率(low descrimination),通过生化反应难以区分的主要是溶藻弧菌和副溶血性弧菌。12株菌的鉴定结果与实时荧光PCR结果不符,其中有6株鉴定结果为副溶血性弧菌,3株鉴定为河弧菌,2株鉴定为少动鞘氨醇单胞菌(Sphingomonas paucimobilis),1株鉴定为嗜水气单胞菌 (Aeromonas hydrophila)。剩余2株菌不在鉴定谱内,无法鉴定。
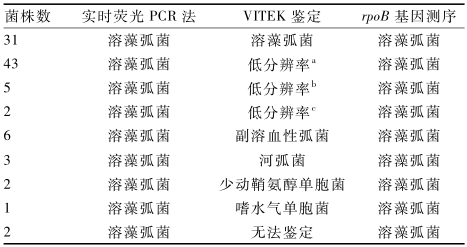
|
表2实时荧光PCR法、VITEK鉴定及rpoB基因测序结果比对 Table 2RT-PCR、VITEK and rpoB gene sequence analyses 注:a:难以区分溶藻弧菌和副溶血性弧菌;b:难以区分溶藻弧菌、副溶血性弧菌和河弧菌;c:难以区分溶藻弧菌、副溶血性弧菌和少动鞘氨醇单胞菌 |
3讨论
近年来,溶藻弧菌引起食物中毒和胃肠炎的报道屡见不鲜[23-25]。人类因食用被污染的水产品而引起急性食物中毒,表现为腹泻、呕吐、菌血症和外伤感染及水样便等症状,严重时可以致死[26-27]。溶藻弧菌作为一种致腹泻菌和影响食品安全的病原菌也日益受到重视。本研究结果显示,北京市市场上的海产品溶藻弧菌的污染比例很高,检出率达82%(95/116),因此,溶藻弧菌的分离鉴定显得愈发重要,其方法的优化对更方便、快速、准确的鉴定溶藻弧菌具有重要的意义。虽然目前我国国家标准中对溶藻弧菌的检测方法还没有具体规定,但大多数溶藻弧菌的分离培养流程是增菌后划线TCBS琼脂培养基,选取黄色可疑菌落进行纯化和鉴定[13,28];或是增菌后先划线TCBS琼脂培养基,从其上挑取可疑菌落转接至科玛嘉弧菌显色培养基,挑取无色菌落再进行纯化和鉴定[11]。本研究结果可以看出,116份样品增菌后同时接种TCBS和科玛嘉弧菌显色培养基,经TCBS琼脂培养基分离,溶藻弧菌的检出率为72%(83/116)。而通过科玛嘉弧菌显色培养基分离,溶藻弧菌的检出率为82%(95/116)。TCBS琼脂培养基是传统方法分离弧菌最常用的选择性培养基,但是在其上长成黄色菌落的除了溶藻弧菌外还有霍乱弧菌等。而科玛嘉弧菌显色培养基上的溶藻弧菌为白色,霍乱弧菌是土耳其蓝色。研究结果显示在分离溶藻弧菌时,科玛嘉弧菌显色培养基的分离效果好于TCBS选择性培养基,可以降低漏检机率,提高检验的准确性。
实时荧光PCR法、VITEK法及rpoB基因测序3种检测方法的结果分析显示,rpoB基因序列NCBI数据库的比对结果及建立的系统发育树结果都表明分离得到的95株菌株全部为溶藻弧菌,与实时荧光PCR结果完全一致。应用VITEK 2 COMPACT鉴定系统对这95株溶藻弧菌进行鉴定,有31株与分子结果完全一致,不一致的为12株,存在溶藻弧菌和副溶血性弧菌难以区分的为50株。溶藻弧菌与副溶血性弧菌不论在表型还是遗传型上都十分相似,这也许是造成本研究中53%的溶藻弧菌和副溶血性弧菌区分不开的原因之一,因此,溶藻弧菌通过分子生物学方法鉴定的准确率明显高于VITEK 2 COMPACT GN鉴定卡的鉴定结果。rpoB基因测序方法虽然准确,但检测时间长、检测费用高,因而常规检测中最为便捷有效的方法为实时荧光PCR法。VITEK检测法由于溶藻弧菌与副溶血性弧菌生化反应差异较小,鉴定效果无法满足日常检测工作的需要。
综上所述,本研究结果显示增菌处理后划线科玛嘉弧菌显色培养基,挑取可疑菌落进行实时荧光PCR法鉴定的流程用来分离鉴定溶藻弧菌最为准确、便捷、有效。
参考文献
[1]ROBERT-PILLOT A, GUENOLE A, FOURNIER J M. Usefulness of R72H PCR assay for differentiation between Vibrio parahaemolyticus and Vibrio alginolyticus species: validation by DNA-DNA hybridization[J]. FEMS Microbiology Letters, 2002, 215(1): 1-6.
[2]SIMS J N, ISOKPEHI R D, COOPER G A, et al.Visual analytics of surveillance data on foodborne vibriosis, United States, 1973-2010[J]. Environmental Health Insights, 2011,5(5):71-85.
[3]CAVALLO R A, STABILI L. Presence of Vibrios in seawater and Mytilus gallooprovincialis(Lam.) from the Mar Piccolo of Taranto(Ionian Sea) [J].Water Research, 2002, 36(15):3719-3726.
[4]GOARANT C, HERLIN J, BRIZARD R, et al. Toxic factors of Vibrio strains pathogenic to shrimp[J]. Dis Aquat Organ,2000,40(2):101-107.
[5]SCHETS F M, VAN H H, MARCHESE A, et al. Potentially human pathogenic Vibrios in marine and fresh bathing waters related to environmental conditions and disease outcome [J].International Journal of Hygiene and Environmental Health,2011,214(5):399-406.
[6]RIPABELLI G, SAMMARCO M L, GRASSO G M, et al. Occurrence of Vibrio and other pathogenic bacteria in Mytilus galloprovincialis (mussels) harvested from Adriatic Sea, Italy [J]. International Journal of Food Microbiology, 1999, 49(1/2): 43-48.
[7]封会茹, 游京蓉, 刘玉堂, 等. 溶藻弧菌引起暴发型食物中毒的病原学研究[J]. 中国食品卫生杂志, 2003, 15(4): 331-334.
[8]费飞,赵越,林凤梅,等. 一起由溶藻弧菌引起的食物中毒的调查报告[J]. 医学动物防制, 2008, 24(2): 150.
[9]JONES E H, ELDMAN K A, PALMER A, et al. Vibrio infections and surveillance in Maryland,2002-2008[J].Public Health Rep, 2013, 128(6): 537-545.
[10]张晓艳,宁喜斌. 海水及海产品中溶藻弧菌的分离与鉴定[J]. 微生物学杂志, 2011, 31(3): 21-24.
[11]李丹丹, 徐义刚, 李梦圆, 等. 溶藻弧菌实时荧光定量PCR快速检测方法的建立[J]. 食品工业科技, 2016, 37(8): 69-71.
[12]钟渊福, 郭以河, 胡永狮, 等. 荧光实时定量PCR检测溶藻弧菌方法的建立[J]. 现代预防医学, 2016, 43(21):3974-3977.
[13]高璐,陶晓雅,陈峻琛,等. 江苏省水产品中溶藻弧菌分布情况[J]. 微生物学杂志, 2015, 35(6): 82-85.
[14]郭静, LISWANISO G, 郭安南, 等. 溶藻弧菌相关分离株的分子及VITEK鉴定[J]. 水产学报, 2012, 36(3): 383-389.
[15]中华人民共和国国家质量监督检验检疫总局. 出口食品中食源性致病菌检测方法 实时荧光PCR法:SN/T 1870—2016[S]. 北京:中国标准出版社, 2016.
[16]ZHU S, RATERING S, SCHNELL S, et al. Matrix-assisted laser desorption and ionization-time-of-flight mass spectrometry, 16S rRNA gene sequencing, and API 32E for identification of Cronobacter spp:a comparative study[J]. Journal of Food Protection, 2011, 74(12): 2182-2187.
[17]O‘HARA C M, SOWERS E G, BOPP C A, et al. Accuracy of six commercially available systems for identification of members of the family Vibrionaceae[J]. Journal of Clinical Microbiology, 2003, 41(12): 5654-5659.
[18]ERLER R,WICHELS A, HEINEMEYER E, et al. Vibrio base: a MALDI-TOF MS database for fast identification of Vibrio spp. that are potentially pathogenic in humans[J]. Systematic and Applied Microbiology, 2014, 38(1): 16-25.
[19]KI J S,ZHANG R, ZHANG W, et al. Analysis of RNA polymerase beta subunit (rpoB) gene sequences for the discriminative power of marine Vibrio species[J]. Microbial Ecology, 2009, 58(4): 679-691.
[20]MOLLET C, DRANCOURT M,RAOULT D. rpoB sequence analysis as a novel basis for bacterial identification[J]. Molecular Microbiology,1997, 26(5): 1005-1011.
[21]TARR C, PATEL J, PUHR N, et al. Identification of Vibrio isolates by a multiplex PCR assay and rpoB sequence determination[J]. Journal of Clinical Microbiology,2007, 45(1): 134-140.
[22]OBERBECKMANN S, WICHELS A, MAIER T, et al. A polyphasic approach for the differentiation of environmental Vibrio isolates from temperate waters[J].FEMS Microbiology Ecology, 2011, 75(1): 145-162.
[23]夏追平. 海岛旅游区溶藻弧菌食物中毒的流行病学调查[J]. 浙江预防医学, 2008, 20(12): 6-7.
[24]LEE K, YU S R, CHEN F R, et al. Virulence of Vibrio alginolyticus isolated from diseased tiger prawn, Penaeus monodon[J]. Current Microbiology, 1996,32(4): 229-231.
[25]龚玲芬, 郁祝新. 副溶血弧菌和溶藻弧菌混合污染引起食物中毒的调查[J]. 职业与健康, 2008, 24(4): 343-344.
[26]卢俊, 袁冬梅. 一起致病性弧菌引起的食物中毒的调查[J]. 现代预防医学, 2013, 40(7): 1216-1217.
[27]CHEN M X, LI H Y, LI G, et al. Distribution of Vibrio alginolyticus like species in Shenzhen coastal waters, China [J].Brazilian Journal of Microbiology, 2011, 42(3):884-896.
[28]谭建锡, 周慧平, 莫瑾, 等. 基于基质辅助激光解吸电离飞行时间质谱的溶藻弧菌鉴定研究[J]. 食品安全质量检测学报, 2016, 7(1):202-208.
[2]SIMS J N, ISOKPEHI R D, COOPER G A, et al.Visual analytics of surveillance data on foodborne vibriosis, United States, 1973-2010[J]. Environmental Health Insights, 2011,5(5):71-85.
[3]CAVALLO R A, STABILI L. Presence of Vibrios in seawater and Mytilus gallooprovincialis(Lam.) from the Mar Piccolo of Taranto(Ionian Sea) [J].Water Research, 2002, 36(15):3719-3726.
[4]GOARANT C, HERLIN J, BRIZARD R, et al. Toxic factors of Vibrio strains pathogenic to shrimp[J]. Dis Aquat Organ,2000,40(2):101-107.
[5]SCHETS F M, VAN H H, MARCHESE A, et al. Potentially human pathogenic Vibrios in marine and fresh bathing waters related to environmental conditions and disease outcome [J].International Journal of Hygiene and Environmental Health,2011,214(5):399-406.
[6]RIPABELLI G, SAMMARCO M L, GRASSO G M, et al. Occurrence of Vibrio and other pathogenic bacteria in Mytilus galloprovincialis (mussels) harvested from Adriatic Sea, Italy [J]. International Journal of Food Microbiology, 1999, 49(1/2): 43-48.
[7]封会茹, 游京蓉, 刘玉堂, 等. 溶藻弧菌引起暴发型食物中毒的病原学研究[J]. 中国食品卫生杂志, 2003, 15(4): 331-334.
[8]费飞,赵越,林凤梅,等. 一起由溶藻弧菌引起的食物中毒的调查报告[J]. 医学动物防制, 2008, 24(2): 150.
[9]JONES E H, ELDMAN K A, PALMER A, et al. Vibrio infections and surveillance in Maryland,2002-2008[J].Public Health Rep, 2013, 128(6): 537-545.
[10]张晓艳,宁喜斌. 海水及海产品中溶藻弧菌的分离与鉴定[J]. 微生物学杂志, 2011, 31(3): 21-24.
[11]李丹丹, 徐义刚, 李梦圆, 等. 溶藻弧菌实时荧光定量PCR快速检测方法的建立[J]. 食品工业科技, 2016, 37(8): 69-71.
[12]钟渊福, 郭以河, 胡永狮, 等. 荧光实时定量PCR检测溶藻弧菌方法的建立[J]. 现代预防医学, 2016, 43(21):3974-3977.
[13]高璐,陶晓雅,陈峻琛,等. 江苏省水产品中溶藻弧菌分布情况[J]. 微生物学杂志, 2015, 35(6): 82-85.
[14]郭静, LISWANISO G, 郭安南, 等. 溶藻弧菌相关分离株的分子及VITEK鉴定[J]. 水产学报, 2012, 36(3): 383-389.
[15]中华人民共和国国家质量监督检验检疫总局. 出口食品中食源性致病菌检测方法 实时荧光PCR法:SN/T 1870—2016[S]. 北京:中国标准出版社, 2016.
[16]ZHU S, RATERING S, SCHNELL S, et al. Matrix-assisted laser desorption and ionization-time-of-flight mass spectrometry, 16S rRNA gene sequencing, and API 32E for identification of Cronobacter spp:a comparative study[J]. Journal of Food Protection, 2011, 74(12): 2182-2187.
[17]O‘HARA C M, SOWERS E G, BOPP C A, et al. Accuracy of six commercially available systems for identification of members of the family Vibrionaceae[J]. Journal of Clinical Microbiology, 2003, 41(12): 5654-5659.
[18]ERLER R,WICHELS A, HEINEMEYER E, et al. Vibrio base: a MALDI-TOF MS database for fast identification of Vibrio spp. that are potentially pathogenic in humans[J]. Systematic and Applied Microbiology, 2014, 38(1): 16-25.
[19]KI J S,ZHANG R, ZHANG W, et al. Analysis of RNA polymerase beta subunit (rpoB) gene sequences for the discriminative power of marine Vibrio species[J]. Microbial Ecology, 2009, 58(4): 679-691.
[20]MOLLET C, DRANCOURT M,RAOULT D. rpoB sequence analysis as a novel basis for bacterial identification[J]. Molecular Microbiology,1997, 26(5): 1005-1011.
[21]TARR C, PATEL J, PUHR N, et al. Identification of Vibrio isolates by a multiplex PCR assay and rpoB sequence determination[J]. Journal of Clinical Microbiology,2007, 45(1): 134-140.
[22]OBERBECKMANN S, WICHELS A, MAIER T, et al. A polyphasic approach for the differentiation of environmental Vibrio isolates from temperate waters[J].FEMS Microbiology Ecology, 2011, 75(1): 145-162.
[23]夏追平. 海岛旅游区溶藻弧菌食物中毒的流行病学调查[J]. 浙江预防医学, 2008, 20(12): 6-7.
[24]LEE K, YU S R, CHEN F R, et al. Virulence of Vibrio alginolyticus isolated from diseased tiger prawn, Penaeus monodon[J]. Current Microbiology, 1996,32(4): 229-231.
[25]龚玲芬, 郁祝新. 副溶血弧菌和溶藻弧菌混合污染引起食物中毒的调查[J]. 职业与健康, 2008, 24(4): 343-344.
[26]卢俊, 袁冬梅. 一起致病性弧菌引起的食物中毒的调查[J]. 现代预防医学, 2013, 40(7): 1216-1217.
[27]CHEN M X, LI H Y, LI G, et al. Distribution of Vibrio alginolyticus like species in Shenzhen coastal waters, China [J].Brazilian Journal of Microbiology, 2011, 42(3):884-896.
[28]谭建锡, 周慧平, 莫瑾, 等. 基于基质辅助激光解吸电离飞行时间质谱的溶藻弧菌鉴定研究[J]. 食品安全质量检测学报, 2016, 7(1):202-208.
