DOi:10.13590/j.cjfh.2017.06.011
超高效液相色谱-串联质谱法测定双壳贝类中9种腹泻性贝类毒素
(1.福建省疾病预防控制中心 福建省人兽共患病研究重点实验室,福建 福州350001;2.福建医科大学药学院,福建 福州350004)
收稿日期:2017-08-28
作者简介:卢嘉丽女硕士生研究方向为食品分析E-mail:lujiali0612@163.com
通信作者:郑仁锦男主管技师研究方向为食品分析E-mail:zrjvs2008@163.com
基金项目:福建省自然科学基金资助项目(2015J01296)
摘要:目的建立超高效液相色谱-串联质谱(UPLC-MS/MS)检测方法,测定双壳贝类样品中9种腹泻性贝类毒素(DSP)。方法样品经100%甲醇提取过滤后,经ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱分离,乙腈-0.01%氨水为流动相,流速为0.2 ml/min,柱温为30 ℃,采用电喷雾电离和正负离子分段扫描,在多反应监测(MRM)模式下测定游离态的毒素(原多甲藻酸1、原多甲藻酸2、原多甲藻酸3、大环内酯类扇贝毒素2、软海绵酸、鳍藻毒素1、鳍藻毒素2、虾夷扇贝毒素和类虾夷扇贝毒素)。当软海绵酸、鳍藻毒素1或鳍藻毒素2任一种或多种毒素呈阳性时,须采用碱水解将酯化的软海绵酸、鳍藻毒素1和鳍藻毒素2转化为游离态形式后,用UPLC-MS/MS测定其水解态毒素含量,外标法定量。结果9种DSP在3个添加水平的平均回收率为85.9%~95.3%,相对标准偏差(RSD)为2.76%~4.18%,检出限(LOD)为4.4~9.9 μg/kg,定量限(LOQ)为14.7~33.0 μg/kg。结论该方法操作简便、灵敏度高,适用于DSP的日常检测。
关键词:
超高效液相色谱-串联质谱法; 双壳贝类; 腹泻性贝类毒素; 食品污染物; 食品安全; 检测方法
文章编号:1004-8456(2017)06-0690-05
中图分类号:R155
文献标志码:A
Determination of nine diarrhetic shellfish poisonings in bivalve molluscs by ultra performance liquid chromatography-mass/mass spectrometry
(1.Fujian Provincial Key Laboratory of Zoonosis Research, Fujian Center for Disease Prevention and Control, Fujian Fuzhou 350001,China; 2.College of Pharmacy,Fujian Medical University, Fujian Fuzhou 350004,China)
Abstract:ObjecticeDetermination method of nine diarrhea shellfish poisons by ultra performance liquid chromatography-mass/mass spectrometry (UPLC-MS/MS) in bivalve molluscs was established. MethodsThe samples were extracted by methanol and separated on a reversed phase ACQUITY UPLC BEH C18 (2.1 mm×100 mm, 1.7 μm) column with acetonitrile-0.01% ammonium hydroxide as the mobile phase, with a flow rate at 0.2 ml/min and the column temperature of 30 ℃. The free toxins (AZA1,AZA2,AZA3,PTX2-b,OA,DTX1,DTX2,YTX and hYTX) in the samples were detected under positive and negative multiple reactions monitoring (MRM) mode through polarity switching between time segments. When any one or more toxins of OA, DTX1 or DTX2 were positive in the sample, the esterified OA, DTX1 and DTX2 were converted to the free form by alkaline hydrolysis and their hydrolyzed toxins were determined by UPLC-MS/MS and quantified by external standard method. ResultsThe average recoveries ranged from 85.9% to 95.3% at three spiked concentrations with the relative standard deviation(RSD) of 2.76% to 4.18%. The detection limit(LOD)ranged from 4.4 to 9.9 μg/kg. The quantification limit(LOQ) ranged from 14.7 to 33.0 μg/kg. ConclusionThe method was highly sensitive and simple,and was suitable for daily detection of diarrhea shellfish poisons in bivalve molluscs.
Key words:
Ultra performance liquid chromatography-mass/mass spectrometry; bivalve molluscs; diarrhetic shellfish poisonings; food contaminants; food safety; testing methods
腹泻性贝类毒素(diarrhetic shellfish poisonings,DSP)是以大田软海绵酸及其衍生物为代表、摄食后可产生以腹泻为主要特征的存在于贝类体内的海洋生物毒性物质的总称[1]。YASUMOTO等[2]首先从紫贻贝的肝胰腺中分离出腹泻性贝类毒素,因被人食用后产生以腹泻为特征的中毒效应而得名。腹泻性贝类毒素是一类脂溶性物质,其化学结构是聚醚或大环内酯化合物,不易溶于水,热稳定性极高,通常的加热处理不易破坏。其主要分为软海绵酸(okadaic acid,OA)、鳍藻毒素(dinophysis toxins,DTX)、蛤毒素(pectenotoxins,PTX)、原多甲藻酸(azaspiracids,AZA)和虾夷扇贝毒素(yessotoxins,YTX)。
目前腹泻性贝类毒素的检测方法主要有小鼠生物检测法[3-4]、酶联免疫(ELISA)法[5]、高效液相色谱(HPLC)及其联用技术[6-10]。小鼠生物检测法是美国公职分析化学家协会(AOAC)采用海洋生物毒素的检测方法,也是许多国家普遍采用的方法,但其灵敏度低,不具有特异性,不能确定样品中毒素成分和结构;ELISA法具有特异性强、简便、快速的优点,但是其难以对样品进行准确定量;HPLC法由于大部分毒素不具有荧光特异性,所以必须进行衍生化才能检测,且其操作较为繁琐,液相色谱-质谱联用法由于分析速度快、灵敏度高、选择性好、检测限低、可提供待测物的结构信息等成为理想的贝类毒素分析方法,几乎可以分析所有的贝类毒素。本试验建立了同时检测9种腹泻性贝类毒素的超高效液相色谱-串联质谱(UPLC-MS/MS)法,并将建立的方法运用到2016年福建省市售92份双壳贝类样品的检测分析。该方法简便、灵敏度高、专属性强,可用于腹泻性贝类毒素的日常检测。
腹泻性贝类毒素标准物质:OA(14.3 μg/ml,CAS∶78111-17-8)、DTX1(15.1 μg/ml,CAS∶81720-10-7)、DTX2(7.8 μg/ml,CAS∶139933-46-3)、YTX(5.6 μg/ml,CAS∶112514-54-2)、类虾夷扇贝毒素(hYTX,5.8 μg/ml,CAS∶196309-94-1)、大环内酯类扇贝毒素2(PTX2-b,4.4 μg/ml,CAS∶97564-91-5)、AZA1(1.30 μg/ml,CAS∶214899-21-5)、AZA2(1.22 μg/ml,CAS∶265996-92-7)、AZA3(1.04 μg/ml,CAS∶265996-93-8)均购自加拿大海洋生物科学研究所。乙腈、甲醇均为色谱纯,甲酸、甲酸铵均为分析纯。
基质标准系列工作液的配制:准确吸取混合标准工作液50、100、300、500、700 μl,用空白基质液定容到1 ml,得到基质标准系列工作液,-20 ℃以下避光保存。
水解态毒素(OA类毒素总量)提取:当检出OA、DTX1和DTX2中任一种或多种毒素时,须采用碱水解将酯化的OA、DTX1和DTX2转化为游离态的OA、DTX1以及DTX2测定其总量。取1 ml游离态毒素提取液于15 ml离心管中,加入125 μl 2.5 mol/L氢氧化钠溶液,涡旋混匀,于76 ℃恒温反应40 min,迅速冷却至室温后,加入125 μl 2.5 mol/L盐酸和2.5 ml水,涡旋混匀,9 000 r/min离心5 min,待净化。
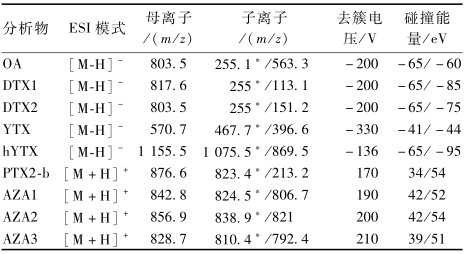
质谱:离子源为ESI,气帘气压力(CUR)2.07 bar,雾化气(GS1)3.45 bar,辅助气(GS2)3.45 bar,出口电压(CXP)25 V,离子源喷雾电压(IS)4 500 V,离子源温度(TEM)650 ℃,9种腹泻性贝类毒素的质谱参数如表1。
显的增加(其中水解态DTX1含量为101.3~167.7 μg/kg;水解态OA含量为68.7~96.8 μg/kg),说明贝类样品中含有OA和DTX1毒素的酯化物形态,这些化合物均来自贝类的新陈代谢过程[11]。
目前腹泻性贝类毒素的检测方法主要有小鼠生物检测法[3-4]、酶联免疫(ELISA)法[5]、高效液相色谱(HPLC)及其联用技术[6-10]。小鼠生物检测法是美国公职分析化学家协会(AOAC)采用海洋生物毒素的检测方法,也是许多国家普遍采用的方法,但其灵敏度低,不具有特异性,不能确定样品中毒素成分和结构;ELISA法具有特异性强、简便、快速的优点,但是其难以对样品进行准确定量;HPLC法由于大部分毒素不具有荧光特异性,所以必须进行衍生化才能检测,且其操作较为繁琐,液相色谱-质谱联用法由于分析速度快、灵敏度高、选择性好、检测限低、可提供待测物的结构信息等成为理想的贝类毒素分析方法,几乎可以分析所有的贝类毒素。本试验建立了同时检测9种腹泻性贝类毒素的超高效液相色谱-串联质谱(UPLC-MS/MS)法,并将建立的方法运用到2016年福建省市售92份双壳贝类样品的检测分析。该方法简便、灵敏度高、专属性强,可用于腹泻性贝类毒素的日常检测。
1材料与方法
1.1主要仪器与试剂
Waters ACQUITY UPLC超高效液相色谱、Sep-Pak C18固相萃取柱(500 mg/6 ml)均购自美国Waters,API 5000三重四极杆串联质谱系统(美国SCIEX)、高速离心机。腹泻性贝类毒素标准物质:OA(14.3 μg/ml,CAS∶78111-17-8)、DTX1(15.1 μg/ml,CAS∶81720-10-7)、DTX2(7.8 μg/ml,CAS∶139933-46-3)、YTX(5.6 μg/ml,CAS∶112514-54-2)、类虾夷扇贝毒素(hYTX,5.8 μg/ml,CAS∶196309-94-1)、大环内酯类扇贝毒素2(PTX2-b,4.4 μg/ml,CAS∶97564-91-5)、AZA1(1.30 μg/ml,CAS∶214899-21-5)、AZA2(1.22 μg/ml,CAS∶265996-92-7)、AZA3(1.04 μg/ml,CAS∶265996-93-8)均购自加拿大海洋生物科学研究所。乙腈、甲醇均为色谱纯,甲酸、甲酸铵均为分析纯。
1.2方法
1.2.1标准溶液的配制
混合标准中间液的配制:分别将9种标准溶液用空白基质液配制成混合标准中间液,使OA、DTX1、DTX2、YTX、hYTX、PTX2-b、AZA1、AZA2、AZA3的浓度分别为0.06、0.06、0.04、0.09、0.09、0.006、0.001、0.003、0.001 μg/ml。-20 ℃以下避光保存。基质标准系列工作液的配制:准确吸取混合标准工作液50、100、300、500、700 μl,用空白基质液定容到1 ml,得到基质标准系列工作液,-20 ℃以下避光保存。
1.2.2样品预处理
游离态毒素提取:准确称取(2±0.01)g贝类样品于15 ml离心管中,加入9 ml 100%甲醇,涡旋混匀3 min,9 000 r/min离心10 min,取上清液至50 ml离心管中,重复一次上述操作;合并上清液用甲醇定容至20 ml,涡旋混匀,过0.22 μm微孔滤膜,供UPLC-MS/MS分析。水解态毒素(OA类毒素总量)提取:当检出OA、DTX1和DTX2中任一种或多种毒素时,须采用碱水解将酯化的OA、DTX1和DTX2转化为游离态的OA、DTX1以及DTX2测定其总量。取1 ml游离态毒素提取液于15 ml离心管中,加入125 μl 2.5 mol/L氢氧化钠溶液,涡旋混匀,于76 ℃恒温反应40 min,迅速冷却至室温后,加入125 μl 2.5 mol/L盐酸和2.5 ml水,涡旋混匀,9 000 r/min离心5 min,待净化。
1.2.3净化
将游离态毒素提取液加入已活化的Sep-Pak C18固相萃取柱(500 mg/6 ml,依次用6 ml甲醇和6 ml水活化),待提取液流干后,用2 ml 20%甲醇水淋洗除杂,最后用2 ml 0.2%氨水甲醇溶液洗脱,收集洗脱液,涡旋混匀,过0.22 μm微孔滤膜,供UPLC-MS/MS分析。
1.2.4仪器条件
色谱:色谱柱:Waters ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm),流动相A为0.01%氨水,B为乙腈。流速0.2 ml/min;进样量10 μl;柱温30 ℃;梯度洗脱程序:0~2 min 80%~70%A,2~6 min 70%~10%A,6~7 min 10%A,7~8.5 min 10%~80%A,8.5~10 min 80%A。质谱:离子源为ESI,气帘气压力(CUR)2.07 bar,雾化气(GS1)3.45 bar,辅助气(GS2)3.45 bar,出口电压(CXP)25 V,离子源喷雾电压(IS)4 500 V,离子源温度(TEM)650 ℃,9种腹泻性贝类毒素的质谱参数如表1。
|
表19种腹泻性贝类毒素的质谱参数 Table 1Parameters of UPLC-MS/MS for determination of nine kinds of DSP 注:*为定量离子 |
2结果与分析
2.1质谱条件的优化
采用多重反应监测(MRM)模式,对9种腹泻性贝类毒素标准溶液进行一级离子扫描,发现AZA1、 AZA2、AZA3和PTX2-b在[M+H]+离子模式下质谱信号强,因此本试验对这4个组分选择[M+H]+离子,而OA、DTX1、DTX2、YTX和hYTX在[M-H]-离子强度较[M+H]+离子强度强,因此本试验对这5个组分选择[M-H]-离子,在获得分子离子峰后,进行二级质谱扫描,并进行MRM,优化去簇电压(DP)、碰撞能量(CE)等质谱参数,从而获得1.2.4中的质谱条件。
2.2色谱条件的优化
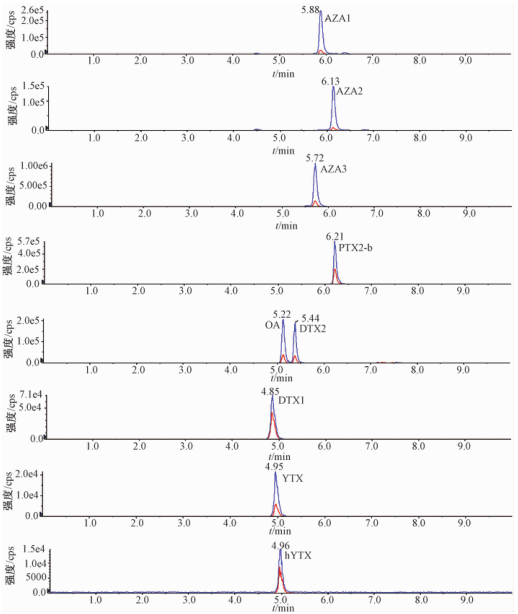
选取ACQUITY UPLC BEH C18色谱柱有利于亲脂性贝类毒素的保留,考察乙腈-0.1%甲酸和乙腈-0.01%氨水体系作为流动相对9种腹泻性贝类毒素的色谱分离效果,试验结果表明,在两种流动相体系下AZA1、AZA2、AZA3、PTX2-b、OA、DTX1和DTX2的峰形及灵敏度基本相同,而YTX和hYTX仅在乙腈-0.01%氨水体系下出峰良好、灵敏度较高且保留时间稳定,因此本试验选取乙腈-0.01%氨水体系作为流动相。其MRM色谱图见图1。
|
图19种腹泻性贝类毒素标准溶液的MRM色谱图 Figure 1MRM chromatograms of nine kinds of DSP standard solution |
2.3OA及DTXs含量的测定
如图2,由于OA及DTXs类海洋生物毒素结构中的R3、R4位置易酯化,主要酯化产物有10种,其在贝类体内既有游离态又有结合态存在,所以只检测其游离态OA和DTXs的含量是不准确的,本试验采用碱水解的方式将其酯化的OA和DTXs转化为游离态的OA、DTX1和DTX2,测定其总OA类毒素。
|
|
图2OA、DTXs及其酯化物的化学结构通式 Figure 2Chemical structure of nine kinds of OA, DTXs and their ester compounds |
2.4线性范围及检出限(LOD)
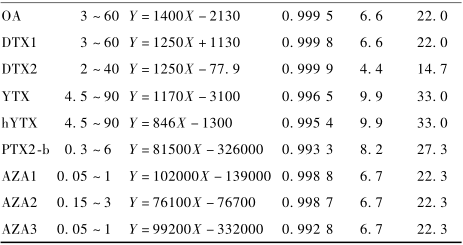
选取空白贝类样品作为空白基质,配制9种腹泻性贝类毒素的基质标准曲线,以定量离子峰面积为纵坐标,浓度为横坐标进行线性回归,试验结果表明,9种腹泻性贝类毒素线性关系均良好,以3倍信噪比(S/N≥3)确定9种腹泻性贝类毒素 的LOD为4.4~9.9 μg/kg,以10倍信噪比(S/N≥10)确定9种腹泻性贝类毒素的定量限(LOQ)为14.7~33.0 μg/kg。结果见表2。
|
表29种腹泻性贝类毒素的线性范围、回归方程、LOD和LOQ Table 2Linear range, regression equations, LODs and LOQs of nine kinds of DSP |
2.5加标回收率及精密度
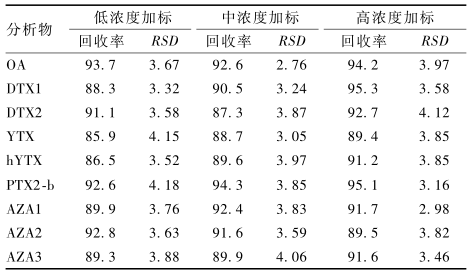
分别对双壳贝类空白样品进行低、中、高3个不同浓度水平的加标试验,按1.2.2样品预处理,每个水平平行测定6次,计算回收率与相对标准偏差(RSD)。测得回收率为85.9%~95.3%,RSD为2.76%~4.18%,结果见表3。
2.6实际样品测定
应用本试验所建立的检测方法检测福建省92份双壳贝类样品,共有7份阳性样品,其中1份样品检出AZA2(其含量为18.8 μg/kg)、5份样品检出DTX1和OA(其中游离态DTX1含量为56.7~103 μg/kg;游离态OA含量为38.2~51.6 μg/kg)、另外1份样品只检出DTX1(其含量为70.5 μg/kg),贝类样品经过水解后,OA和DTX1的含量都有明
|
表3贝类样品中9种DSP在不同水平加标回收率和RSD(n=6,%) Table 3Recoveries and relative standard deviations of nine kinds of DSP in spiked shellfish sample |
3小结
本试验通过优化质谱和色谱条件,建立了超高效液相色谱-串联质谱法检测分析双壳贝类样品中9种腹泻性贝类毒素(AZA1,AZA2,AZA3,PTX2-b,OA,DTX1,DTX2,YTX和hYTX)的定量、定性方法。试验结果表明,9种毒素在一定的浓度范围内具有良好的线性关系,该方法可操作性强、灵敏度高,方法的回收率、精密度等均能满足双壳贝类产品中腹泻性贝类毒素日常检测分析的需要。
参考文献
[1]中华人民共和国卫生部,中国国家标准化管理委员会. 贝类中腹泻性贝类毒素的测定:GB/T 5009.212—2008[S]. 北京: 中国标准出版社, 2008.
[2]YASUMOTO T,OSHIMA Y,YAMAGUCHI M. Occurrence of a new type of shellfish poisoning in the Tohoku district[J]. Nihon-suisan-gakkai-shi, 1978,44(11):1249-1255.
[3]吴锋,江天久,张帆,等. 浙江南麂海域双壳贝类的腹泻性贝毒分析[J]. 海洋环境科学, 2010,29(4):492-495.
[4]柳俊秀,胡乐琴,何培民.腹泻性贝毒素软海绵酸的昆明系小鼠生物学检测法的建立[J]. 生态毒理学报, 2009,4(3):446-451.
[5]刘晓玉,徐静,黄莲芝,等. 腹泻性贝类毒素及检测技术研究进展[J]. 食品安全质量检测学报, 2015,6(10):4096-4102.
[6]卢士英,张代辉,周玉,等. 大田软海绵酸液相色谱串联质谱检测方法的研究[J]. 中国卫生检验杂志, 2007,17(9):1537-1539.
[7]姚建华,谭志军,周德庆,等. 液相色谱-串联质谱法检测贝类产品中的原多甲藻酸贝类毒素[J]. 色谱, 2010,28(4):363-367.
[8]母清林,方杰,万汉兴,等. 液相色谱-串联质谱法检测贝类产品中腹泻性贝类毒素[J]. 分析化学, 2011,39(1):111-114.
[9]KROCK B, TILLMANN U, JOHN U, et al. LC-MS-MS aboard ship: tandem mass spectrometry in the search for phycotoxins and novel toxigenic plankton from the North Sea[J]. Anal Bioanal Chem, 2008, 392(5):797-803.
[10]CHRISTIAN B, LUCKAS B. Determination of marine biotoxins relevant for regulations: from the mouse bioassay to coupled LC-MS methods[J]. Anal Bioanal Chem, 2008, 391(1):117-134.
[11]MARR J C, HU T, PLEASANCE S, et al. Detection of new 7-O-acyl derivatives of diarrhetic shellfish poisoning toxins by liquid chromatography-mass spectrometry[J]. Toxicon, 1992,30(12):1621-1630.
[2]YASUMOTO T,OSHIMA Y,YAMAGUCHI M. Occurrence of a new type of shellfish poisoning in the Tohoku district[J]. Nihon-suisan-gakkai-shi, 1978,44(11):1249-1255.
[3]吴锋,江天久,张帆,等. 浙江南麂海域双壳贝类的腹泻性贝毒分析[J]. 海洋环境科学, 2010,29(4):492-495.
[4]柳俊秀,胡乐琴,何培民.腹泻性贝毒素软海绵酸的昆明系小鼠生物学检测法的建立[J]. 生态毒理学报, 2009,4(3):446-451.
[5]刘晓玉,徐静,黄莲芝,等. 腹泻性贝类毒素及检测技术研究进展[J]. 食品安全质量检测学报, 2015,6(10):4096-4102.
[6]卢士英,张代辉,周玉,等. 大田软海绵酸液相色谱串联质谱检测方法的研究[J]. 中国卫生检验杂志, 2007,17(9):1537-1539.
[7]姚建华,谭志军,周德庆,等. 液相色谱-串联质谱法检测贝类产品中的原多甲藻酸贝类毒素[J]. 色谱, 2010,28(4):363-367.
[8]母清林,方杰,万汉兴,等. 液相色谱-串联质谱法检测贝类产品中腹泻性贝类毒素[J]. 分析化学, 2011,39(1):111-114.
[9]KROCK B, TILLMANN U, JOHN U, et al. LC-MS-MS aboard ship: tandem mass spectrometry in the search for phycotoxins and novel toxigenic plankton from the North Sea[J]. Anal Bioanal Chem, 2008, 392(5):797-803.
[10]CHRISTIAN B, LUCKAS B. Determination of marine biotoxins relevant for regulations: from the mouse bioassay to coupled LC-MS methods[J]. Anal Bioanal Chem, 2008, 391(1):117-134.
[11]MARR J C, HU T, PLEASANCE S, et al. Detection of new 7-O-acyl derivatives of diarrhetic shellfish poisoning toxins by liquid chromatography-mass spectrometry[J]. Toxicon, 1992,30(12):1621-1630.
