DOi:10.13590/j.cjfh.2017.06.013
加速溶剂萃取结合亲水液相色谱柱分离测定坚果中的8种生育酚异构体
(浙江省疾病预防控制中心,浙江 杭州310051)
收稿日期:2017-08-08
作者简介:郑熠斌男初级技师研究方向为食品理化检测技术的开发E-mail:ybzheng@cdc.zj.cn
通信作者:黄百芬女主任技师研究方向为食品理化检测技术的开发E-mail:bfhuang@cdc.zj.cn
基金项目:
摘要:目的建立加速溶剂萃取(ASE)结合亲水液相色谱(HILIC)柱分离测定坚果中8种生育酚异构体的方法。方法2 g坚果样品经ASE提取富集后,用BEH Amide色谱柱(150 mm×3.0 mm, 1.7 μm)分离,以90%正己烷,10%叔丁基甲基醚-四氢呋喃-甲醇(20∶1∶0.1,V/V)作为流动相等度洗脱,荧光检测器激发波长294 nm,发射波长328 nm检测,外标法定量。结果4种生育酚在0.5~80.0 μg/ml、4种生育三烯酚在0.5~30.0 μg/ml之间具有良好的线性(r2>0.998),方法检出限在0.032~0.070 mg/kg之间,方法定量限范围0.096~0.210 mg/kg,三个水平加标回收率在87.5%~114.2%之间,6次重复测定相对标准偏差(RSD)均≤12%。结论本方法具有良好的灵敏度、回收率和重复性,适用于坚果中8种生育酚异构体的含量分布的测定。
关键词:
加速溶剂萃取; 亲水液相色谱柱; 坚果; 生育酚异构体; 测定方法
文章编号:1004-8456(2017)06-0698-05
中图分类号:R155
文献标志码:A
Simultaneous and quick determination of all eight vitamin E isomers in nuts by accelerated solvent extraction and hydrophilic interaction liquid chromatography
(Zhejiang Provincial Centre for Disease Control and Prevention, Zhejiang Hangzhou 310051, China)
Abstract:ObjectiveA method was developed for simultaneous quantification of eight E vitamers (tocopherols and tocotrienols with α, β, γ and δ type) in nut matrix by hydrophilic interaction liquid chromatography (HILIC) after pretreating with accelerated solvent extraction. MethodsNut samples were extracted using accelerated solvent extraction (ASE), the separation of 8 anlaytes was achieved using BEH amide amino column (150 mm×3.0 mm, 1.7 μm) and the mobile phase was 90% hexane and 10% methyl tert-butyl ether-tetrahydrofuran-methanol (20∶ 1∶ 0.1, V/V). ResultsThe detection limits were ranged from 0.032 to 0.070 mg/kg with linear correlation coefficient above 0.998, while quantification limits were 0.096-0.210 mg/kg. Intraday and interday recoveries of spiking standards were 87.5%-114.2%, and relative standard deviations (RSDs) were all less than 12%. ConclusionThe established method could be applied in the simultaneous detection of vitamin E isomers in nuts due to its excellent sensitivity, recovery and reproducibility.
Key words:
Accelerated solvent extraction; hydrophilic interaction liquid chromatography; nut; tocopherols isomer; detection method
维生素E(生育酚,T)是人体必需的脂溶性维生素[1],主要来源于各种植物种子,对动物生长、骨骼及视力发育、繁殖和免疫功能的影响尤为重要,也能防止身体退行性病变、常见的癌症以及心血管疾病[2]。根据其色环上的甲基数目及位置的不同,可分为4种生育酚(α-T,β-T,γ-T,δ-T)以及不饱和形式的4种生育三烯酚(α-T3,β-T3,γ-T3,δ-T3)[3],不同的生育酚异构体的生物学活性有着较大区别,如γ-T虽然在坚果中普遍含量较高,但其活性只有α-T的1/10,近期研究[4]表明生育三烯酚具有降低低密度胆固醇生物合成等特殊的生物学作用。所以分别分析定量生育酚异构体对明确食物中生育酚对生物体的作用具有重要意义。
目前生育酚的检测方法主要有液相色谱(LC)法[5-9]、高效液相色谱-质谱联用(HPLC-MS)法[10-11]、气相色谱(GC)法[12]、毛细管电泳(CE)法[13]等,但对8种生育酚异构体同时检测的方法鲜有报道。CE法灵敏度较低,且对脂溶性成分的分离难度大。LC法与GC法比较,前处理过程相对简单,更适用于生育酚的检测,但要达到8种生育酚异构体同时分离检测,对分离手段有着更高的要求。本试验选用亲水液相色谱(HILIC)模式的BEH Amide氨基色谱柱,可对8种生育酚异构体实现基线分离。选用的荧光检测器能很好的满足灵敏度与选择性的需求[14]。
样品前处理过程是影响整个分析效率的决速步骤,也是造成检测结果误差的主要来源。在目前针对生育酚的检测的前处理方法中,被应用最多的是皂化-液液萃取的经典方法[15],该法过程繁琐、耗时长、有机试剂用量大。与营养强化食品不同,天然食品中生育酚异构体基本以游离态而非以酯等结合态的形式存在于油脂当中[16],因此可以直接提取。基于此,本试验将加速溶剂萃取(ASE)应用于坚果样品的前处理,该方法自动化程度高,全程避光且与氧气接触少,很好的避免了试验过程中生育酚异构体的氧化分解,而且耗时短,有机试剂消耗少,是对坚果样品理想的前处理方法[17]。
本试验研究利用ASE技术提取坚果样品中的脂溶性成分,用BEH Amide氨基柱分离-荧光检测器检测其中的8种生育酚异构体的方法。方法优化了色谱分离条件,用田口设计试验法优化了ASE的条件。试验结果表明本方法简便、快速、准确,重现性好,为8种生育酚异构体的定性与定量检测提供了一种高效可行的色谱检测方法。
正己烷、叔丁基甲基醚、四氢呋喃、甲醇均为色谱纯,α-生育酚(CAS:10191-41-0)、β-生育酚(CAS:148-03-8)、γ-生育酚(CAS:54-28-4)、δ-生育酚(CAS:119-13-1)、α-生育三烯酚(CAS:1721-51-3)、β-生育三烯酚(CAS:490-23-3)、γ-生育三烯酚(CAS:14101-61-2)、δ-生育三烯酚(CAS:25612-59-3)均购自美国Chromadex,纯度均>96%;乙醚、石油醚均为分析纯,硅藻土。本试验所用坚果样品均购于杭州超市。
目前生育酚的检测方法主要有液相色谱(LC)法[5-9]、高效液相色谱-质谱联用(HPLC-MS)法[10-11]、气相色谱(GC)法[12]、毛细管电泳(CE)法[13]等,但对8种生育酚异构体同时检测的方法鲜有报道。CE法灵敏度较低,且对脂溶性成分的分离难度大。LC法与GC法比较,前处理过程相对简单,更适用于生育酚的检测,但要达到8种生育酚异构体同时分离检测,对分离手段有着更高的要求。本试验选用亲水液相色谱(HILIC)模式的BEH Amide氨基色谱柱,可对8种生育酚异构体实现基线分离。选用的荧光检测器能很好的满足灵敏度与选择性的需求[14]。
样品前处理过程是影响整个分析效率的决速步骤,也是造成检测结果误差的主要来源。在目前针对生育酚的检测的前处理方法中,被应用最多的是皂化-液液萃取的经典方法[15],该法过程繁琐、耗时长、有机试剂用量大。与营养强化食品不同,天然食品中生育酚异构体基本以游离态而非以酯等结合态的形式存在于油脂当中[16],因此可以直接提取。基于此,本试验将加速溶剂萃取(ASE)应用于坚果样品的前处理,该方法自动化程度高,全程避光且与氧气接触少,很好的避免了试验过程中生育酚异构体的氧化分解,而且耗时短,有机试剂消耗少,是对坚果样品理想的前处理方法[17]。
本试验研究利用ASE技术提取坚果样品中的脂溶性成分,用BEH Amide氨基柱分离-荧光检测器检测其中的8种生育酚异构体的方法。方法优化了色谱分离条件,用田口设计试验法优化了ASE的条件。试验结果表明本方法简便、快速、准确,重现性好,为8种生育酚异构体的定性与定量检测提供了一种高效可行的色谱检测方法。
1材料与方法
1.1主要仪器与试剂
加速溶剂萃取仪(配备11、22、33 ml萃取池,中国北京吉天公司)、1260高效液相色谱仪(配备荧光检测器,美国Agilent)、BUCHI旋蒸浓缩仪(瑞士BUCHI)、Biotage氮吹仪(瑞典Biotage)。正己烷、叔丁基甲基醚、四氢呋喃、甲醇均为色谱纯,α-生育酚(CAS:10191-41-0)、β-生育酚(CAS:148-03-8)、γ-生育酚(CAS:54-28-4)、δ-生育酚(CAS:119-13-1)、α-生育三烯酚(CAS:1721-51-3)、β-生育三烯酚(CAS:490-23-3)、γ-生育三烯酚(CAS:14101-61-2)、δ-生育三烯酚(CAS:25612-59-3)均购自美国Chromadex,纯度均>96%;乙醚、石油醚均为分析纯,硅藻土。本试验所用坚果样品均购于杭州超市。
1.2方法
1.2.1标准溶液的配制
取各标准物质10.0 mg,用乙醇定容至10 ml,按照GB 5009.82—2016《食品安全国家标准 食品中维生素A、D、E的测定》[18]校准储备液浓度。按需求转移一定量的储备液至进样瓶,40 ℃氮吹干后用流动相稀释成混合标准溶液系列,4种生育酚浓度为0.5、1.0、5.0、10.0、20.0、40.0、80.0 μg/ml,4种生育三烯酚浓度为0.5、1.0、2.0、4.0、8.0、15.0、30.0 μg/ml的8种混合标准工作液。
1.2.2样品处理
加速溶剂萃取:准确称取2 g坚果样品(已混匀的可食部分),2 g硅藻土,混匀后装入11 ml的萃取池中,空隙用硅藻土填充。萃取溶剂为正己烷,温度110 ℃,压强10.0 MPa,静态提取100 s,循环3次,用溶剂快速冲洗样品,氮气吹扫收集全部提取液。将收集瓶中的提取液转移至旋蒸瓶中并用正己烷冲洗收集瓶,合并正己烷提取液,用旋转蒸发仪浓缩至干,用流动相定容至10 ml,取1 ml过0.22 μm滤膜,待HPLC分析。
1.2.3仪器条件
色谱:Waters ACQUITYTM UPLC BEH Amide色谱柱(150 mm×3.0 mm, 1.7 μm);柱温30 ℃;流动相:90%正己烷,10%叔丁基甲基醚-四氢呋喃-甲醇(20∶1∶0.1,V/V);流速0.8 ml/min;等度洗脱;荧光检测波长:激发波长294 nm,发射波长328 nm;进样量5 μl。
2结果与分析
2.1加速溶剂萃取条件优化
本试验通过检测ASE所提取的植物油的量来衡量生育酚的提取效率,并通过优化ASE的试验条件来提高油脂的提取率。影响加速溶剂萃取结果的主要因素是萃取剂、萃取温度、萃取时间[19]。基于此,本试验使用田口设计试验法设计了L9(34)正交表并安排试验,3个因素分别为萃取剂[正己烷、石油醚、正己烷-石油醚(1∶1,V/V)]、萃取温度(90、110、120 ℃)、萃取时间(100、200、300 s),各因素对提取效率的影响如图1所示。通过软件分析可知在压力为10 MPa时,萃取溶剂为正己烷,温度110 ℃,静态提取100 s时为最佳萃取条件。
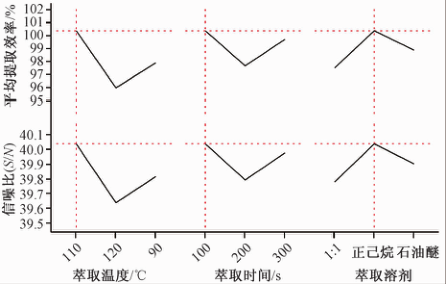
|
图1不同因素水平对加速溶剂萃取效率的影响 Figure 1Extraction ratio by different levels of factors |
2.2色谱条件的优化
为了更好地与ASE方法衔接,本试验选用了正相色谱法来分离检测8种生育酚异构体。硅胶柱是正相色谱分离生育酚异构体的常用柱[3],而本试验首次将HILIC色谱柱应用于正相色谱系统中生育酚异构体的分离检测并与硅胶柱的分离效果进行了对比(图2)。针对正相液相色谱中存在的保留时间不稳定的问题[20],本试验通过加入四氢呋喃和甲醇,并调节流动相流速来增强出峰时间的稳定性;通过对比也发现BEH Amide较普通的硅胶柱与氨基柱在分离检测生育酚异构体时消耗的有机试剂量更少,分离度更好,峰形更对称,保留时间也更稳定,因此,本方法选用BEH Amide柱作为色谱分离柱。在实际样品的检测中,优化后的色谱条件也有着较好的表现。

|
注:A为BEH Amide柱分离色谱图;B为Sunfire硅胶柱分离色谱图;1~8分别为:α-T、α-T3、β-T、γ-T、β-T3、γ-T3、δ-T、δ-T3 图2不同色谱柱分离生育酚异构体混合标准溶液色谱图 Figure 2Chromatogram of standard solution with the different columns |
2.3线性范围和灵敏度
将8种生育酚异构体系列标准工作液按1.2.3仪器条件进行测定,绘制样品浓度(x,μg/ml)与峰面积(y)的标准曲线,进行线性回归分析。方法对8种生育酚异构体的检出限(LOD,S/N=3)、定量限(LOQ,S/N=10)如表1所示。本方法在1.2.1所配制的标准浓度范围内线性良好。
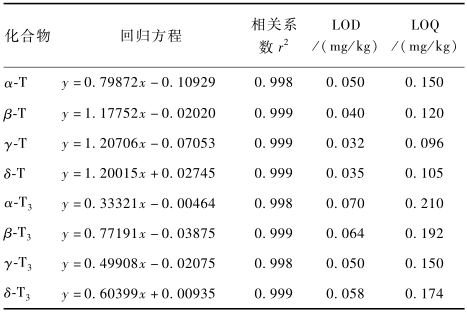
|
表1线性方程及LOD、LOQ Table 1Linear equation,limit of detection and limit of quantitation |
2.4方法的加标回收率和精密度
在低含量样品中添加0.2、0.5和2.0 mg/kg的生育酚混合标准溶液,于暗处放置30 min,按1.2.2进行前处理操作后,按1.2.3进样测定,以浓度值计算加标回收率。分别进行了日间、日内三水平3平行试验,结果见表2。各生育酚异构体的加标回收率在87.5%~114.2%之间,相对标准偏差(RSD)在1%~12%之间。方法的回收率和重现性均较理想。
2.5实际样品测定
在优化试验条件下,对扁桃仁、松仁、开心果、花生共30份样品中的生育酚含量进行了分析,采用保留时间定性,外标法定量,分析结果见表3。由此可见,坚果中皆富含多种生育酚异构体,但各生育酚异构体的含量分布差异较大,在所检测的样品中,扁桃仁具有最大的α-生育酚当量,而开心果中同时存在8种生育酚异构体,花生中生育酚的总量较低且异构体种类相对其他样品少。在本试验设定条件下样品及标准样品均能得到较好分离,样品中生育酚异构体的分离状况见图3。
3小结
本试验建立了ASE结合HILIC柱分离测定坚果中8种生育酚异构体的方法。本研究通过田口设计技术对ASE条件进行了优化,样品提取耗时仅需10 min,同时使得方法的自动化程度更高,有效减少了有机试剂的使用量,对环境更友好。本方法具有操作简单、灵敏度高、回收率和重现性好,结果准确可靠的特点。适用于坚果中8种生育酚异构体的检测,为进一步研究天然食物中脂溶性维生素异构体的分布提供了一种简单、快速的分析方法。
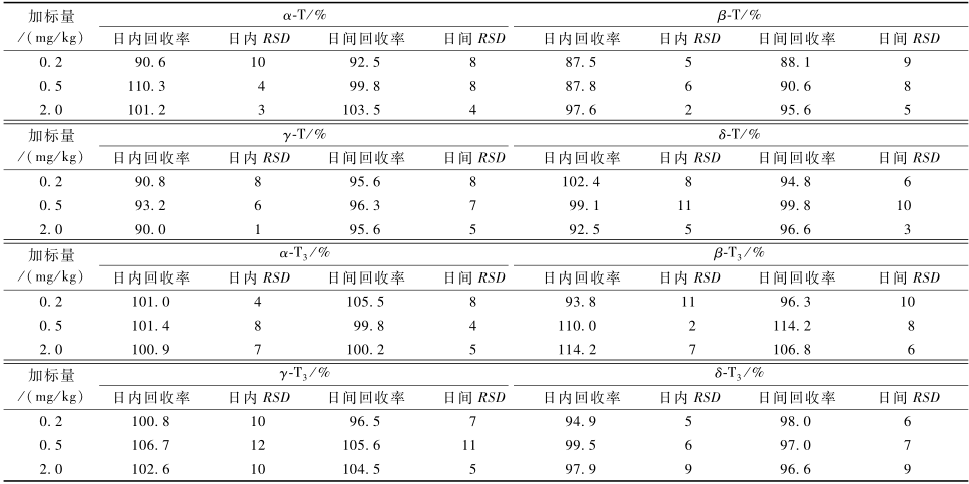
|
表2方法的日内与日间回收率(n=3) Table 2Recoveries of intraday/interday |
|
|
表3坚果样品中生育酚异构体的含量分布 (±s,mg/kg) Table 2Content of tocopherols and tocotrienols in different nuts 注:n为样品数;—表示含量低于LOQ未计算 |

|
注:a.混合标准溶液;b.扁桃仁;c.松仁;d.花生;e.开心果 图3坚果样品中生育酚异构体色谱图 Figure 3Chromatographic photogram of tocopherols and tocotrienols in different samples |
参考文献
[1]MLLER L, THEILE K, BHM V, et al. In vitro antioxidant activity of tocopherols and tocotrienols and comparison of vitamin E concentration and lipophilic antioxidant capacity in human plasma[J]. Molecular Nutrition & Food Research, 2010, 54(5):731-742.
[2]AGGARWAL B B, SUNDARAM C, PRASAD S, et al. Tocotrienols, the vitamin E of the 21st century: it‘s potential against cancer and other chronic diseases[J]. Biochemical Pharmacology, 2010, 80(11):1613-1631.
[3]KAMALELDIN A, GRGEN S, PETTERSSON J, et al. Normal-phase high-performance liquid chromatography of tocopherols and tocotrienols: comparison of different chromatographic columns[J]. Journal of Chromatography A, 2000, 881(1/2):217-227.
[4]NAKAMURA T, NOMA A, TERAO J. Location of α-tocopherol and α-tocotrienol to heterogeneous cell membranes and inhibition of production of peroxidized cholesterol in mouse fibroblasts[J]. Springerplus, 2014, 3(1):1-6.
[5]ABDALLAH I B, TLILI N, MARTINEZ-FORCE E, et al. Content of carotenoids, tocopherols, sterols, triterpenic and aliphatic alcohols, and volatile compounds in six walnuts (Juglans regia L.) varieties[J]. Food Chemistry, 2015, 173(10):972-978.
[6]CHEN H, ANGIULI M, FERRARI C, et al. Tocopherol speciation as first screening for the assessment of extra virgin olive oil quality by reversed-phase high-performance liquid chromatography/fluorescence detector[J]. Food Chemistry, 2011, 125(4):1423-1429.
[7]ALVES R C, CASAL S, OLIVEIRA M B P P. Tocopherols in coffee brews: influence of coffee species, roast degree and brewing procedure[J]. Journal of Food Composition & Analysis, 2010, 23(8):802-808.
[8]周围, 王波, 刘倩倩,等. 超高效合相色谱法同时测定复合维生素片中11种脂溶性维生素及其衍生物[J]. 分析化学, 2015, 43(1):115-120.
[9]乔海鸥, 王辛, 王敏娟. 正相高效液相色谱-荧光检测法同时测定植物油中的四种维生素E异构体[J]. 中国卫生检验杂志, 2012,22(6):1271-1274.
[10]ALBAHRANI A A, ROTAROU V, ROCHE P J, et al. Comparison of three commercial calibrators for alpha-tocopherol using liquid chromatography-tandem mass spectrometry[J]. Clinical Biochemistry, 2013, 46(18):1884-1888.
[11]MJEAN M, BRUNELLE A, TOUBOUL D. Quantification of tocopherols and tocotrienols in soybean oil by supercritical-fluid chromatography coupled to high-resolution mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2015, 407(17):5133-5142.
[12]ABID S L, THIAM S, WARNER I M. Elution behavior of unsaponifiable lipids with various capillary electrochromatographic stationary phases[J]. Journal of Chromatography A, 2002, 949(1/2):195-207.
[13]YAMAUCHI R, NORO H, SHIMOYAMADA M, et al. Analysis of vitamin E and its oxidation products by HPLC with electrochemical detection[J]. Lipids, 2002, 37(5):515-522.
[14]SEN C K, KHANNA S, ROY S. Tocotrienols in health and disease: the other half of the natural vitamin E family[J]. Molecular Aspects of Medicine, 2007, 28(5/6):692-728.
[15]VIAS P, BRAVO-BRAVO M, LPEZ-GARCA I, et al. Pressurized liquid extraction and dispersive liquid-liquid microextraction for determination of tocopherols and tocotrienols in plant foods by liquid chromatography with fluorescence and atmospheric pressure chemical ionization-mass spectrometry detection[J]. Talanta, 2014, 119(10):98-104.
[16]DIACK M, SASKA M. Separation of vitamin E and gamma-oryzanols from rice bran by normal-phase chromatography[J]. Journal of the American Oil Chemists‘ Society, 1994, 71(11):1211-1217.
[17]RICHTER B E, JONES B A, EZZELL J L, et al. Accelerated solvent extraction: a technique for sample preparation[J]. Analytical Chemistry, 1996, 68(6):1033-1039.
[18]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中维生素A、D、E的测定:GB 5009.82—2016[S]. 北京:中国标准出版社,2016.
[19]陈平, 陆卫明. 加速溶剂萃取/凝胶渗透色谱/气相色谱-质谱法测定水果中的农药残留[J]. 中国卫生检验杂志, 2016,26(23):3361-3363.
[20]DIONISI F, PRODOLLIET J, TAGLIAFERRI E. Assessment of olive oil adulteration by reversed-phase high-performance liquid chromatography/amperometric detection of tocopherols and tocotrienols[J]. Journal of the American Oil Chemists‘ Society, 1995, 72(12):1505-1511.
[2]AGGARWAL B B, SUNDARAM C, PRASAD S, et al. Tocotrienols, the vitamin E of the 21st century: it‘s potential against cancer and other chronic diseases[J]. Biochemical Pharmacology, 2010, 80(11):1613-1631.
[3]KAMALELDIN A, GRGEN S, PETTERSSON J, et al. Normal-phase high-performance liquid chromatography of tocopherols and tocotrienols: comparison of different chromatographic columns[J]. Journal of Chromatography A, 2000, 881(1/2):217-227.
[4]NAKAMURA T, NOMA A, TERAO J. Location of α-tocopherol and α-tocotrienol to heterogeneous cell membranes and inhibition of production of peroxidized cholesterol in mouse fibroblasts[J]. Springerplus, 2014, 3(1):1-6.
[5]ABDALLAH I B, TLILI N, MARTINEZ-FORCE E, et al. Content of carotenoids, tocopherols, sterols, triterpenic and aliphatic alcohols, and volatile compounds in six walnuts (Juglans regia L.) varieties[J]. Food Chemistry, 2015, 173(10):972-978.
[6]CHEN H, ANGIULI M, FERRARI C, et al. Tocopherol speciation as first screening for the assessment of extra virgin olive oil quality by reversed-phase high-performance liquid chromatography/fluorescence detector[J]. Food Chemistry, 2011, 125(4):1423-1429.
[7]ALVES R C, CASAL S, OLIVEIRA M B P P. Tocopherols in coffee brews: influence of coffee species, roast degree and brewing procedure[J]. Journal of Food Composition & Analysis, 2010, 23(8):802-808.
[8]周围, 王波, 刘倩倩,等. 超高效合相色谱法同时测定复合维生素片中11种脂溶性维生素及其衍生物[J]. 分析化学, 2015, 43(1):115-120.
[9]乔海鸥, 王辛, 王敏娟. 正相高效液相色谱-荧光检测法同时测定植物油中的四种维生素E异构体[J]. 中国卫生检验杂志, 2012,22(6):1271-1274.
[10]ALBAHRANI A A, ROTAROU V, ROCHE P J, et al. Comparison of three commercial calibrators for alpha-tocopherol using liquid chromatography-tandem mass spectrometry[J]. Clinical Biochemistry, 2013, 46(18):1884-1888.
[11]MJEAN M, BRUNELLE A, TOUBOUL D. Quantification of tocopherols and tocotrienols in soybean oil by supercritical-fluid chromatography coupled to high-resolution mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2015, 407(17):5133-5142.
[12]ABID S L, THIAM S, WARNER I M. Elution behavior of unsaponifiable lipids with various capillary electrochromatographic stationary phases[J]. Journal of Chromatography A, 2002, 949(1/2):195-207.
[13]YAMAUCHI R, NORO H, SHIMOYAMADA M, et al. Analysis of vitamin E and its oxidation products by HPLC with electrochemical detection[J]. Lipids, 2002, 37(5):515-522.
[14]SEN C K, KHANNA S, ROY S. Tocotrienols in health and disease: the other half of the natural vitamin E family[J]. Molecular Aspects of Medicine, 2007, 28(5/6):692-728.
[15]VIAS P, BRAVO-BRAVO M, LPEZ-GARCA I, et al. Pressurized liquid extraction and dispersive liquid-liquid microextraction for determination of tocopherols and tocotrienols in plant foods by liquid chromatography with fluorescence and atmospheric pressure chemical ionization-mass spectrometry detection[J]. Talanta, 2014, 119(10):98-104.
[16]DIACK M, SASKA M. Separation of vitamin E and gamma-oryzanols from rice bran by normal-phase chromatography[J]. Journal of the American Oil Chemists‘ Society, 1994, 71(11):1211-1217.
[17]RICHTER B E, JONES B A, EZZELL J L, et al. Accelerated solvent extraction: a technique for sample preparation[J]. Analytical Chemistry, 1996, 68(6):1033-1039.
[18]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中维生素A、D、E的测定:GB 5009.82—2016[S]. 北京:中国标准出版社,2016.
[19]陈平, 陆卫明. 加速溶剂萃取/凝胶渗透色谱/气相色谱-质谱法测定水果中的农药残留[J]. 中国卫生检验杂志, 2016,26(23):3361-3363.
[20]DIONISI F, PRODOLLIET J, TAGLIAFERRI E. Assessment of olive oil adulteration by reversed-phase high-performance liquid chromatography/amperometric detection of tocopherols and tocotrienols[J]. Journal of the American Oil Chemists‘ Society, 1995, 72(12):1505-1511.
