DOi:10.13590/j.cjfh.2018.01.001
4种交链孢毒素对人食管上皮细胞Het-1 A的体外毒性研究
(国家食品安全风险评估中心 卫生部食品安全风险评估重点实验室,北京 100021)
收稿日期:2017-09-15
作者简介:韩小敏 女 副研究员 研究方向为生物毒素 E-mail:hanxiaomin@cfsa.net.cn
通信作者:李凤琴 女 研究员 研究方向为生物毒素与食品微生物 E-mail:lifengqin@cfsa.net.cn
基金项目:北京市自然科学基金(7163235);科技基础工作专项(2013FY113400)
摘要:目的 研究交链孢酚(AOH)、交链孢酚单甲醚(AME)、交链孢菌酮酸(TeA)和腾毒素(TEN)4种交链孢毒素对人食管上皮细胞Het-1 A的体外急性毒性作用。方法 将Het-1 A用不同浓度的4种交链孢毒素处理,分别采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)双染法、PI单染法和分光光度法研究其对Het-1 A的增殖抑制、细胞凋亡、周期分布和含半胱氨酸的天冬氨酸蛋白水解酶-3(caspase-3)活性的影响。结果 4种交链孢毒素对Het-1 A的半数抑制浓度(IC50)值分别为54.31、43.38、121.91和141.96 μmol/L,均可引起细胞凋亡,并可通过引起G2-M期比例上升而影响细胞的周期分布。AOH和AME可通过剂量依赖增强caspase-3活性引发细胞凋亡。结论 AOH、AME、TeA和TEN可通过抑制细胞增殖、引起细胞凋亡、诱导G2-M周期阻滞等对Het-1 A产生急性毒性。
关键词:
交链孢毒素; 人食管上皮细胞Het-1 A; 急性毒性; 体外试验
文章编号:1004-8456(2018)01-0001-05
中图分类号:R155
文献标志码:A
Study on the toxicity of four kinds of Alternaria toxins on human esophageal epithelial cell Het-1 A in vitro
(Key Laboratory of Food Safety Risk Assessment of Ministry of Health,China National Centerfor Food Safety Risk Assessment,Beijing 100021,China)
Abstract:Objective To study the acute cytotoxicity of four kinds of Alternaria toxins alternaiol (AOH), alternariol monomethyl ether (AME), tenuazonic acid (TeA) and tentoxin (TEN) on human esophageal epithelium cell Het-1 A in vitro.Methods Het-1 A was treated with different concentrations of 4 kinds of Alternaria toxins. The effects of 4 kinds of Alternaria toxins on cell proliferations, cell apoptosis, cell cycle distribution and cysteinyl aspartate specific proteinase-3 (capase-3) activity were detected by 3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide(MTT), annexin V-fluorescein isothiocyanate/propidium iodide(Annexin V-FITC/PI)double staining method, PI single staining method and spectrophotometry, respectively.Results The half maximal inhibitory concentration (IC50) of AOH, AME, TeA and TEN on Het-1 A was 54.31, 43.38, 121.91 and 141.96 μmol/L, respectively. The 4 kinds of Alternaria toxins could induce the apoptosis of Het-1 A and also could affect the cell cycle distribution through increasing the percent of G2-M phase. AOH and AME could enhance the activity of caspase-3 in a positive dose-dependent manner to induce the apoptosis of Het-1 A.Conclusion AOH, AME, TeA and TEN could cause acute cytotoxicity on Het-1 A through inhibiting cell proliferation, inducing cell apoptosis and G2-M cell cycle arrest etc.
Key words:
Alternaria toxins; human esophageal epithelial cell Het-1 A; acute cytotoxicity; in vitro
交链孢毒素是由交链孢霉属(Alternaria species)的某些种产生的有毒代谢产物,主要污染谷物及其制品、番茄、水果和油料种籽等[1-4]。目前已发现70多种交链孢毒素,其中交链孢酚(alternaiol,AOH)、交链孢酚单甲醚(alternariol monomethyl ether,AME)、交链孢菌酮酸(tenuazonic acid,TeA)和腾毒素(tentoxin,TEN)是食品中最常检测到、污染水平较高、危害较大、最具有代表性的交链孢毒素[5-7]。
流行病学调查[8-9]显示,我国河南省林州市(原为林县)食管癌高发区的谷物,尤其是当地生产的主粮小麦受交链孢霉污染严重。同时,林州市居民的粮食及尿液中检测到高水平的AOH和AME[10-11]。EVA等[12]研究证实,AOH对中国仓鼠V79细胞和小鼠淋巴瘤细胞(L5178Y tk+/-)具有急性毒性,但4种交链孢毒素对人食管上皮细胞(human esophageal epithelium cell)Het-1 A的毒性作用报道较少。本研究以Het-1 A为研究对象,探索4种毒素的急性毒性作用,为交链孢毒素在食管癌病因学中的作用及控制提供依据。
Het-1 A购自美国典型培养物保藏中心(ATCC);二甲亚砜(dimethyl sulfoxide,DMSO, 美国Sigma);AOH(MSS1030-1)、AME(MSS1031-1)、TeA(MSS1032-1)和TEN(MSS1038-05)固体粉末均购自以色列Fermentek,纯度均>98%;支气管上皮细胞培养基(BEGM,瑞士LONZA);胎牛血清、含乙二胺四乙酸(EDTA)的胰蛋白酶消化液等均购自美国赛默飞世尔科技公司;碘化丙啶(propidium iodide,PI)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)试剂盒、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒、细胞周期检测试剂盒、天冬氨酸蛋白水解酶-3(caspase-3)分光光度法检测试剂盒均购自江苏凯基生物技术有限公司。
4种交链孢毒素标准储备液的配制:准确称取1.0 mg AOH、1.0 mg AME、0.5 mg TeA和1.0 mg TEN于容量瓶中,分别加入387.5、367.6、507.6和241.5 μl的DMSO,超声溶解30 min制成浓度均为10 000 μmol/L的标准储备液,备用。
细胞周期是一个连续和精准的过程,周期调控对细胞周期起着监视和调节作用,因此异常的周期调控和凋亡是引发正常细胞发生癌变的重要特征[15]。本研究发现,虽然AOH、AME、TeA和TEN的IC50值明显小于黄曲霉毒素B1等国际上明确认定与人类癌症发生相关的真菌毒素[15],但它们均能在一定浓度下抑制Het-1 A的生长。AOH、AME、TeA和TEN均可通过改变Het-1 A的G2-M期比例而引起周期阻滞,这与LEHMANN等[16]报道的AOH和AME可引起G2-M期比例增加相吻合。此外,与对照组比较,AOH、AME、TeA和TEN还可在一定浓度下引起Het-1 A的细胞凋亡,但不同毒素在不同浓度下引起细胞凋亡的方式不同,TeA和TEN主要引起早期凋亡,而高浓度的AOH和AME主要通过caspase-3引起晚期凋亡,这与FATMA等[17]报道的AME可通过caspase-3引起HCT116的细胞凋亡相一致。此外,本研究中存在没有设立DMSO溶剂对照组的缺陷,但整个设计试验是在前期不同浓度DMSO对Het-1 A细胞增殖抑制效果评价的基础上,选择适宜浓度DMSO开展的体外急性毒性研究,弥补了部分缺陷。
综上所述,AOH、AME、TeA和TEN可通过抑制Het-1 A的细胞增殖、异常的细胞凋亡和G2-M期周期阻滞等对Het-1 A产生毒性作用。考虑到它们的毒性特点及与食管癌间的流行病学调查数据,有必要开展4种毒素对Het-1 A的长期慢性毒性研究以进一步探讨交链孢毒素暴露与食管癌间的相关性。
流行病学调查[8-9]显示,我国河南省林州市(原为林县)食管癌高发区的谷物,尤其是当地生产的主粮小麦受交链孢霉污染严重。同时,林州市居民的粮食及尿液中检测到高水平的AOH和AME[10-11]。EVA等[12]研究证实,AOH对中国仓鼠V79细胞和小鼠淋巴瘤细胞(L5178Y tk+/-)具有急性毒性,但4种交链孢毒素对人食管上皮细胞(human esophageal epithelium cell)Het-1 A的毒性作用报道较少。本研究以Het-1 A为研究对象,探索4种毒素的急性毒性作用,为交链孢毒素在食管癌病因学中的作用及控制提供依据。
1材料与方法
1.1主要仪器与试剂
CO2恒温培养箱(美国Thermo Fisher Scientific)、全自动酶标仪(美国Bio-Rad)、倒置显微镜(日本奥林巴斯)、高速离心机、超净工作台。Het-1 A购自美国典型培养物保藏中心(ATCC);二甲亚砜(dimethyl sulfoxide,DMSO, 美国Sigma);AOH(MSS1030-1)、AME(MSS1031-1)、TeA(MSS1032-1)和TEN(MSS1038-05)固体粉末均购自以色列Fermentek,纯度均>98%;支气管上皮细胞培养基(BEGM,瑞士LONZA);胎牛血清、含乙二胺四乙酸(EDTA)的胰蛋白酶消化液等均购自美国赛默飞世尔科技公司;碘化丙啶(propidium iodide,PI)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)试剂盒、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒、细胞周期检测试剂盒、天冬氨酸蛋白水解酶-3(caspase-3)分光光度法检测试剂盒均购自江苏凯基生物技术有限公司。
1.2方法
1.2.1试验设计和4种交链孢毒素标准储备液的配制
试验设计:4种交链孢毒素中AOH、AME和TEN在水中的溶解度较差,试验中拟采用一定浓度的DMSO溶解4种交链孢毒素。考虑到DMSO具有一定的毒性作用,可以引起细胞的增殖抑制等,因此有必要首先考察DMSO对Het-1 A的增殖抑制效果,选择不对细胞造成损害的DMSO浓度研究4种交链孢毒素对Het-1 A的体外急性毒性作用。4种交链孢毒素标准储备液的配制:准确称取1.0 mg AOH、1.0 mg AME、0.5 mg TeA和1.0 mg TEN于容量瓶中,分别加入387.5、367.6、507.6和241.5 μl的DMSO,超声溶解30 min制成浓度均为10 000 μmol/L的标准储备液,备用。
1.2.2不同浓度的DMSO对Het-1 A的增殖抑制的影响
取准备好的Het-1 A,经含EDTA的胰蛋白酶消化1~2 min后,加入2 ml含10%胎牛血清的BEGM培养基终止消化反应,再用含2%胎牛血清的BEGM培养基将其稀释至浓度为4×104个/ml,按8×103个/孔接种于96孔培养板,每孔200 μl,培养8~10 h待细胞贴壁后弃去培养液。将DMSO分别用含2%胎牛血清的BEGM培养基梯度稀释,使稀释液中DMSO终浓度分别为0.05%、0.1%、0.2%、0.5%、1.0%、2.0%。处理组每孔中加入上述稀释液200 μl,同时设立调零组(不含细胞和毒素,仅含200 μl用2%胎牛血清稀释的BEGM培养基)和对照组(含细胞和200 μl用2%胎牛血清稀释的BEGM培养基,不含DMSO),每组设立3个平行孔。继续培养72 h,培养结束后每孔加入5 mg/ml MTT 20 μl, 37 ℃孵育4 h后弃去培养液,每孔加入200 μl DMSO悬浮细胞,测定570 nm处吸光度(OD)值,细胞增殖抑制率按照抑制率(%)=100%-(OD处理组-OD调零组)/(OD对照组-OD调零组)×100%进行计算。
1.2.34种交链孢毒素对Het-1 A的增殖抑制作用和半数抑制浓度(IC50)
取准备好的Het-1 A细胞,细胞消化和稀释步骤同1.2.2,将稀释后的细胞按8×103个/孔接种于96孔培养板,每孔200 μl,培养8~10 h待细胞贴壁后弃去培养液。将4种毒素分别用含2%胎牛血清的BEGM培养基梯度稀释,使稀释液中交链孢毒素终浓度分别为1.0、2.5、5.0、6.25、12.5、25、50、100和250 μmol/L。处理组每孔中加入上述稀释液200 μl,同时设立调零组(不含细胞和毒素,仅含200 μl用2%胎牛血清稀释的BEGM培养基)和对照组(含细胞和200 μl用2%胎牛血清稀释的BEGM培养基,不含毒素),每组设立3个平行孔。继续培养72 h,培养结束后每孔加入5 mg/ml MTT 20 μl,37 ℃孵育4 h后弃去培养液,每孔加入200 μl DMSO悬浮细胞,测定570 nm处OD值,细胞增殖抑制率按照抑制率(%)=100%-(OD处理组-OD调零组)/(OD对照组-OD调零组)×100%进行计算,以细胞增殖抑制率为纵坐标,log[M]为横坐标(M为毒素浓度),Origin 8.0计算Het-1 A在不同毒素处理下的IC50。
1.2.44种交链孢毒素对Het-1 A细胞凋亡的影响
取准备好的Het-1 A,细胞消化步骤同1.2.3,消化结束后用含2%胎牛血清的BEGM培养基将其稀释至浓度为2×105个/ml,接种于6孔培养板,每孔1 ml,再加1 ml含2%胎牛血清的BEGM培养基,混合后培养8~10 h待细胞贴壁后弃去培养液。将4种毒素分别用含2%胎牛血清的培养基梯度稀释,使稀释液中交链孢毒素终浓度分别为3.13和12.50 μmol/L。处理组每孔中加入上述稀释液3 ml,同时设立对照组(含细胞和3 ml用2%胎牛血清稀释的BEGM培养基,不含毒素),每组均设2个平行孔。继续培养72 h,培养结束后将处理组和对照组的Het-1 A均用不含EDTA的0.25%胰蛋白酶消化,800 r/min离心5 min收集处理的细胞用于后续的染色。如不能立即染色则加入含2%胎牛血清的磷酸盐缓冲液(PBS)并置4 ℃保存,备用。测定前用PBS洗涤细胞,800 r/min离心5 min,弃去上清,重复1次。随后每份样品中加入500 μl Binding Buffer重悬细胞,再加入5 μl Annexin V-FITC和5 μl PI室温下避光染色5~15 min,300目尼龙网过滤,1 h内用流式细胞仪测定并统计结果。
1.2.54种交链孢毒素对Het-1 A周期的影响
取准备好的Het-1 A,细胞消化和稀释步骤同1.2.3,随后按2×105个/孔接种至6孔培养板,每孔1 ml,再加入1 ml含2%胎牛血清的BEGM培养基,混合后培养8~10 h待细胞贴壁后弃去培养液。将4种毒素分别用含2%胎牛血清的培养基梯度稀释,使稀释液中交链孢毒素终浓度分别为5和50 μmol/L。处理组每孔中加入上述稀释液3 ml,同时设立对照组(含细胞和3 ml用2%胎牛血清稀释的BEGM培养基,不含毒素),每组均设2个平行孔。继续培养72 h,培养结束后将处理组和对照组均用不含EDTA的0.25%胰蛋白酶消化后,800 r/min离心5 min,收集处理的细胞,每组加入1.0 ml预冷的70%乙醇,4 ℃固定2 h或过夜后4 ℃保存。测定前用PBS洗涤细胞2次后将其重悬于100 μl RNase A,再加入400 μl PI(终浓度为50 μg/ml)轻轻混合均匀后37 ℃水浴避光30 min进行PI染色,300目尼龙网过滤,流失细胞仪测定488 nm处荧光强度并计算各周期的细胞比例。
1.2.64种交链孢毒素对Het-1 A caspase-3蛋白活性的影响
取准备好的Het-1 A,细胞的培养和消化过程同1.2.5,随后按4×105个/孔接种至6孔培养板,每孔1 ml,再加入1 ml含2%胎牛血清的BEGM培养基,混合后培养8~10 h待细胞贴壁后弃去培养液。用含2%胎牛血清的BEGM培养基将4种毒素分别进行稀释,使稀释液中交链孢毒素浓度分别为3.13、6.25、12.50和25.00 μmol/L。处理组每孔中加入上述稀释液3 ml,同时设立对照组(含细胞和3 ml用2%胎牛血清稀释的BEGM培养基,不含毒素),每组均设2个平行孔。继续培养72 h,培养结束后,将处理组和对照组均用不含EDTA的0.25%胰蛋白酶消化,800 r/min离心5 min,收集处理的细胞,PBS洗涤细胞,800 r/min离心5 min,弃去上清,重复1次。Het-1 A沉淀中加入caspase-3分光光度法检测试剂盒提供的细胞裂解液150~200 μl(使用前4 ℃预冷),随后将细胞置-20 ℃反复冻融裂解2~3次后,4 ℃10 000 r/min离心1 min,将上清液转移至新离心管,并用NanoDrop 2000超微量分光光度计测定260 nm下裂解液中的蛋白浓度,用裂解液调整蛋白浓度至2~4 μg/μl,吸取50 μl裂解液,并加入50 μl 2×反应缓冲液和5 μl caspase-3底物,37 ℃避光孵育4 h后,测定405 nm处OD值,计算不同浓度下OD处理组/OD对照组的比值。
2结果与分析
2.1DMSO和4种交链孢毒素对Het-1 A增殖抑制及4种交链孢毒素对Het-1 A的IC50值分析
活细胞线粒体中的琥珀酸脱氢酶可将外源性的MTT还原为水不溶性的蓝紫色结晶甲瓒,加入适量DMSO后,甲瓒可被DMSO溶解,而死细胞却无此现象发生。根据处理后的细胞在570 nm处OD值大小可间接反映活细胞或死细胞的数量,且在一定细胞数范围内,MTT结晶形成的量与活细胞数成正比,据此推断细胞的增殖抑制效果。本研究发现,0.05%~0.1%的DMSO对Het-1 A的增殖抑制影响不大,0.2%~2.0%的DMSO对Het-1 A的增殖抑制效果有影响,且随着DMSO浓度增加和培养时间延长,对细胞的增殖抑制效果增强。此外还发现,AOH、AME、TeA和TEN对Het-1 A的IC50值分别为54.31、43.38、121.91和141.96 μmol/L,且随毒素浓度增大,抑制效果增强,呈现正的剂量-反应关系。
2.24种交链孢毒素对Het-1 A凋亡的影响
Annexin V是检测细胞早期凋亡的灵敏指标,本研究采用Annexin V-PI双染法检测交链孢毒素对Het-1 A早期凋亡(Annexin V+/PI-)和晚期凋亡(Annexin V+/PI+)的影响,具体结果见表1。由此可知,与对照组比较,Het-1 A分别经低浓度(3.13 μmol/L)和高浓度(12.50 μmol/L)的AOH、AME、TeA和TEN处理72 h后,Het-1 A毒素处理组总凋亡细胞(早期凋亡和晚期凋亡)的比例均高于对照组(0.77%),且总凋亡细胞的比例随毒素浓度增加而上升。AOH、AME、TeA和TEN高浓度(12.50 μmol/L)处理组中总凋亡细胞的比例(分别为13.38%、5.20%、18.13%和25.75%)均高于低浓度(3.13 μmol/L)处理组(分别为4.82%、3.68%、5.05%和2.00%)。Het-1 A分别经高浓度(12.50 μmol/L)AOH和AME处理后,早期凋亡的细胞比例(分别为12.45%和4.35%)均高于晚期凋亡的细胞比例(分别为0.93%和0.85%);而同浓度的TeA和TEN处理Het-1 A后,早期凋亡的细胞比例(7.74%和11.78%)均低于晚期凋亡的细胞比例(10.39%和13.97%)。表明低浓度和高浓度的交链孢毒素可能通过不同的途径引起Het-1 A的细胞凋亡。
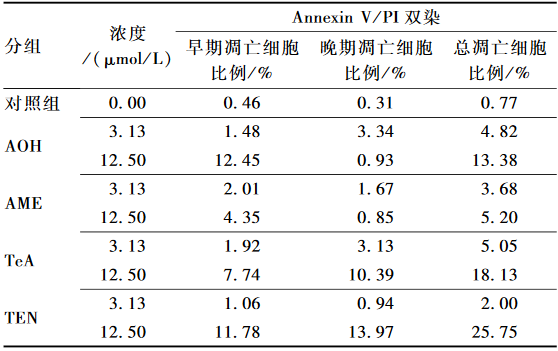
|
表1AOH、AME、TeA和TEN对Het-1 A凋亡的影响 Table 1Effects of AOH, AME, TeA and TEN on Het-1 A apoptosis |
2.34种交链孢毒素对Het-1 A细胞周期的影响
4种交链孢毒素对Het-1 A细胞周期的影响见表2。由此可知,与对照组比较,Het-1 A分别经低浓度(5.00 μmol/L)的AOH、AME、TeA和TEN作用72 h后,G0-G1期细胞比例无明显变化,S期细胞比例由对照组的41.11%下降到4种毒素处理后的27.04%(AME)~34.08%(TEN);G2-M期细胞比例由对照组的31.20%增加到4种毒素处理后的37.81%(TEN)~47.23%(AME)。当4种交链孢毒素浓度增至50.00 μmol/L时,G0-G1期细胞和S期细胞比例与对照组比较均明显减少,但G2-M期细胞比例明显增加,其中以AOH和AME处理后的G2-M期细胞比例增加最明显,分别由对照组的31.20%增加到58.00%和53.26%。可见,4种交链孢毒素均通过引起Het-1 A G2-M期的改变而发挥毒性作用。
2.44种交链孢毒素对Het-1 A中caspase-3蛋白活性的影响
天冬氨酸特异性半胱氨酸蛋白酶家族(cysteinyl aspartate specific protease)又称为caspase家族,是激活细胞凋亡过程重要蛋白酶,其中caspase-3为关键的执行分子。正常细胞的caspase-3以酶原形式存在于胞浆中,在细胞凋亡的早期阶段,该酶被激活,活化的caspase-3裂解成相应的胞浆核底物,最终导致细胞凋亡。晚期凋亡和死亡的细胞中,caspase-3的活性明显下降。从图1中可以看出,与对照 组比较,Het-1 A经低浓度(3.13 μmol/L)AOH和AME处理72 h后,细胞中的caspase-3活性无明显变化,但随着AOH和AME浓度的提高(浓度≥6.25 μmol/L),caspase-3活性逐渐提高,当AOH和AME处理浓度升至25.00 μmol/L时,与对照组比较,处理组Het-1 A中的caspase-3活性分别提高到1.84和1.75倍。但Het-1 A经不同浓度的TeA和TEN处理后,caspase-3活性均未明显增强。由此可见,AOH和AME均可呈正的剂量依赖性的引起caspase-3活性增强;这也与本研究前期发现TeA和TEN可通过晚期凋亡引起Het-1 A细胞凋亡的结果相吻合。

|
表2AOH、AME、TeA和TEN对Het-1 A细胞周期的影响 Table 2Effects of AOH, AME, TeA and TEN on Het-1 A cell cycle |
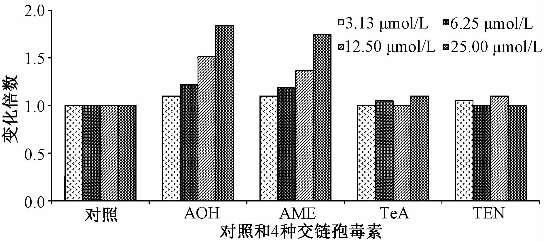
|
图1AOH、AME、TeA和TEN处理后Het-1 A中 caspase-3活性分析 Figure 1Effects of AOH, AME, TeA and TEN on Het-1 A caspase-3 activity |
3讨论
课题组前期对我国河南、山东、安徽、吉林和北京5省(市)2013年市售323份小麦粉及其制品中AOH、AME、TeA和TEN的调查[13]发现,上述地区的小麦粉及其制品普遍受4种毒素的污染,TeA、TEN和AME的检出率均在90%以上,其中TeA的检出率可达99.4%。娄振岭等[10]发现,林州市食管癌高发区人群尿排出AOH和AME水平高于低发区人群。Het-1 A是一种永生化的正常食管鳞状上皮细胞,也是研究毒素对人正常食管上皮细胞毒性的常用细胞,但目前尚无关于交链孢毒素对其毒性的研究[14]。细胞周期是一个连续和精准的过程,周期调控对细胞周期起着监视和调节作用,因此异常的周期调控和凋亡是引发正常细胞发生癌变的重要特征[15]。本研究发现,虽然AOH、AME、TeA和TEN的IC50值明显小于黄曲霉毒素B1等国际上明确认定与人类癌症发生相关的真菌毒素[15],但它们均能在一定浓度下抑制Het-1 A的生长。AOH、AME、TeA和TEN均可通过改变Het-1 A的G2-M期比例而引起周期阻滞,这与LEHMANN等[16]报道的AOH和AME可引起G2-M期比例增加相吻合。此外,与对照组比较,AOH、AME、TeA和TEN还可在一定浓度下引起Het-1 A的细胞凋亡,但不同毒素在不同浓度下引起细胞凋亡的方式不同,TeA和TEN主要引起早期凋亡,而高浓度的AOH和AME主要通过caspase-3引起晚期凋亡,这与FATMA等[17]报道的AME可通过caspase-3引起HCT116的细胞凋亡相一致。此外,本研究中存在没有设立DMSO溶剂对照组的缺陷,但整个设计试验是在前期不同浓度DMSO对Het-1 A细胞增殖抑制效果评价的基础上,选择适宜浓度DMSO开展的体外急性毒性研究,弥补了部分缺陷。
综上所述,AOH、AME、TeA和TEN可通过抑制Het-1 A的细胞增殖、异常的细胞凋亡和G2-M期周期阻滞等对Het-1 A产生毒性作用。考虑到它们的毒性特点及与食管癌间的流行病学调查数据,有必要开展4种毒素对Het-1 A的长期慢性毒性研究以进一步探讨交链孢毒素暴露与食管癌间的相关性。
参考文献
[1]AZCRATE M P,PATRIARCA A,TERMINIELLO L,et al. Alternaria toxins in wheat during the 2004 to 2005 Argentinean harvest[J]. Journal of Food Protection,2008,71(6):1262-1265.
[2]MOTTA S,SOARES L M V. A method for the determination of two Alternaria toxins, alternariol and alternariol monomethyl ether,in tomato products [J]. Brazilian Journal of Microbiology,2000,31(4):315-320.
[3]LAU B P Y,SCOTT P M,LEWIS D A,et al. Liquid chromatography-mass spectrometry and liquid chromatography-tandem mass spectrometry of the Alternaria mycotoxins alternariol and alternariol monomethyl ether in fruit juices and beverages[J]. Journal of Chromatography A,2003,998(1/2):119-131.
[4]VISCONTI A,LOGRIECO A,BOTTALICO A. Natural occur-rence of Alternaria mycotoxins in olives-their production and possible transfer into the oil[J]. Food Additives and Conta-minants,1986,3(4):323-330.
[5]LPEZ P,VENEMA D P,DE RIJK T C,et al. Occurrence of Alternaria toxins in food products in the Netherlands [J]. Food Control,2016,60(7):196-204.
[6]HICKERT S,BERGMANN M,ERSEN S, et al. Survey of Alternaria toxin contamination in food from the German market, using a rapid HPLC-MS/MS approach[J]. Mycotoxin Research,2016,32(1):7-18.
[7]ALEXANDER J,BENFORD D,BOOBIS A,et al. Risk assessment of contaminants in food and feed[J]. EFSA,2012,10(10):s1004.
[8]娄振岭,张惠芳,马丽萍,等. 食管癌高低发区有关粮食与食品中互隔交链孢霉毒素的测定[J].河南肿瘤医学杂志,1995,8(4):251-253.
[9]ZHANG Q,YANG S L,DONG Z M,et al. Determination of grain contamined by Alternaria alternate and exposure of its toxins for residents in the high incident area of esophageal cancer[J]. Life Science Journal,2007,4(4):25-28.
[10]娄振岭,苗健,裴留成,等. 食管癌高低发区人群尿互隔交链孢霉素排出水平的研究[J]. 肿瘤基础与临床,1992,5(3):23-24.
[11]杨胜利,董子明,裴留成,等. 河南林县居民粮食中互隔交链孢霉及其毒素污染和人群暴露状况研究[J]. 中国学术期刊文摘,2007,19(15):282.
[12]EVA M B,JRG W,DAVID M S, et al. Mutagenicity of the mycotoxin alternariol in cultured mammalian cells[J]. Toxicology Letters,2006,164(3):221-230.
[13]ZHAO K,SHAO B,YANG D J,et al. Natural occurrence of Alternaria toxins in wheat-based products and their dietary exposure in China[J]. PLoS One,2014,10(6):e0132019.
[14]LIU J,WU S,SHEN H T,et al. Ochratoxin A induces DNA damage and G2 phase arrest in human esophageal epithelium Het-1A cells in vitro[J]. Journal of Toxicological Sciences,2015,40(5):657-665.
[15]苏伟明,马润娣,于立坚. 细胞周期阻滞与肿瘤[J]. 广东海洋大学学报,2001,21(4):66-70.
[16]LEHMANN L,WAGNER J,METZLER M. Estrogenic and clastogenic potential of the mycotoxin alternariol in cultured mammalian cells[J]. Food and Chemical Toxicology,2006,44(3):398-408.
[17]FATMA B,CINDY G,OSSAMA S,et al. Mechanism of alter-nariol monomethyl ether-induced mitochondrial apoptosis in human colon carcinoma cells[J]. Toxicology,2011,29(2/3):230-240.
[2]MOTTA S,SOARES L M V. A method for the determination of two Alternaria toxins, alternariol and alternariol monomethyl ether,in tomato products [J]. Brazilian Journal of Microbiology,2000,31(4):315-320.
[3]LAU B P Y,SCOTT P M,LEWIS D A,et al. Liquid chromatography-mass spectrometry and liquid chromatography-tandem mass spectrometry of the Alternaria mycotoxins alternariol and alternariol monomethyl ether in fruit juices and beverages[J]. Journal of Chromatography A,2003,998(1/2):119-131.
[4]VISCONTI A,LOGRIECO A,BOTTALICO A. Natural occur-rence of Alternaria mycotoxins in olives-their production and possible transfer into the oil[J]. Food Additives and Conta-minants,1986,3(4):323-330.
[5]LPEZ P,VENEMA D P,DE RIJK T C,et al. Occurrence of Alternaria toxins in food products in the Netherlands [J]. Food Control,2016,60(7):196-204.
[6]HICKERT S,BERGMANN M,ERSEN S, et al. Survey of Alternaria toxin contamination in food from the German market, using a rapid HPLC-MS/MS approach[J]. Mycotoxin Research,2016,32(1):7-18.
[7]ALEXANDER J,BENFORD D,BOOBIS A,et al. Risk assessment of contaminants in food and feed[J]. EFSA,2012,10(10):s1004.
[8]娄振岭,张惠芳,马丽萍,等. 食管癌高低发区有关粮食与食品中互隔交链孢霉毒素的测定[J].河南肿瘤医学杂志,1995,8(4):251-253.
[9]ZHANG Q,YANG S L,DONG Z M,et al. Determination of grain contamined by Alternaria alternate and exposure of its toxins for residents in the high incident area of esophageal cancer[J]. Life Science Journal,2007,4(4):25-28.
[10]娄振岭,苗健,裴留成,等. 食管癌高低发区人群尿互隔交链孢霉素排出水平的研究[J]. 肿瘤基础与临床,1992,5(3):23-24.
[11]杨胜利,董子明,裴留成,等. 河南林县居民粮食中互隔交链孢霉及其毒素污染和人群暴露状况研究[J]. 中国学术期刊文摘,2007,19(15):282.
[12]EVA M B,JRG W,DAVID M S, et al. Mutagenicity of the mycotoxin alternariol in cultured mammalian cells[J]. Toxicology Letters,2006,164(3):221-230.
[13]ZHAO K,SHAO B,YANG D J,et al. Natural occurrence of Alternaria toxins in wheat-based products and their dietary exposure in China[J]. PLoS One,2014,10(6):e0132019.
[14]LIU J,WU S,SHEN H T,et al. Ochratoxin A induces DNA damage and G2 phase arrest in human esophageal epithelium Het-1A cells in vitro[J]. Journal of Toxicological Sciences,2015,40(5):657-665.
[15]苏伟明,马润娣,于立坚. 细胞周期阻滞与肿瘤[J]. 广东海洋大学学报,2001,21(4):66-70.
[16]LEHMANN L,WAGNER J,METZLER M. Estrogenic and clastogenic potential of the mycotoxin alternariol in cultured mammalian cells[J]. Food and Chemical Toxicology,2006,44(3):398-408.
[17]FATMA B,CINDY G,OSSAMA S,et al. Mechanism of alter-nariol monomethyl ether-induced mitochondrial apoptosis in human colon carcinoma cells[J]. Toxicology,2011,29(2/3):230-240.
 韩小敏,韩春卉,李凤琴.4种交链孢毒素对人食管上皮细胞Het-1 A的体外毒性研究[J].中国食品卫生杂志,2018,30(1):1-5.
韩小敏,韩春卉,李凤琴.4种交链孢毒素对人食管上皮细胞Het-1 A的体外毒性研究[J].中国食品卫生杂志,2018,30(1):1-5.