DOi:10.13590/j.cjfh.2018.01.006
固相萃取-超高效液相色谱-串联质谱法测定畜产品中残留的22种磺胺类药物
(1.国家食品安全风险评估中心 卫生部食品安全风险评估重点实验室,北京 100021;2.浙江省食品药品检验研究院,浙江 杭州 310052; 3.岛津企业管理(中国)有限公司,北京 100020)
收稿日期:2018-01-16
作者简介:高洁 女 助理研究员 研究方向为食品安全理化检测 E-mail:gaojie@cfsa.net.cn
通信作者:赵云峰 男 研究员 研究方向为食品安全理化检测 E-mail:zhaoyf@cfsa.net.cn
基金项目:国家自然科学基金青年科学基金项目(21607035);国家高技术研究发展计划(863计划)项目(2012AA101603)
摘要:目的 建立畜产品中22种磺胺类药物残留的超高效液相色谱-串联质谱(UPLC-MS/MS)测定方法。方法 样品经乙腈涡旋提取,正己烷除脂后,阳离子交换固相萃取柱净化,再经Waters Acquity UPLC BEH C18(2.1 mm×100 mm, 1.7 μm)色谱柱分离,在电喷雾正离子多反应监测模式下进行测定。结果 22种磺胺类药物在一定的浓度范围内线性关系良好,相关系数(r)>0.997。在猪肉、猪肝、猪肾3种基质中,22种磺胺类药物的检出限为0.03~0.3 μg/kg,定量限为0.1~1 μg/kg。在1、2、5 μg/kg 三个添加水平下,其加标回收率为63.0%~115.6%,相对标准偏差为1.2%~15.9%。结论 该方法快速、简便、准确可靠,适用于畜产品中22种磺胺类药物的同时检测。
关键词:
磺胺类药物; 畜产品; 超高效液相色谱-串联质谱; 固相萃取; 同时检测; 兽药残留; 食品污染物
文章编号:1004-8456(2018)01-0028-07
中图分类号:R155
文献标志码:A
Determination of 22 sulfonamides in livestock products by ultra high performance liquidchromatography-tandem mass spectrometry coupled with solid phase extraction
(1.Key Laboratory of Food Safety Risk Assessment of Ministry of Health, China National Center for Food Safety and Risk Assessment,Beijing 100021, China; 2.Zhejiang Institute for Food and Drug Control, Zhejiang Hangzhou 310052, China; 3.Shimadzu (China))
Abstract:Objective To establish a method for the determination of 22 sulfonamides in livestock products by ultra high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS).Methods Samples were extracted by acetonitrile and the fat was removed by hexane. Then the extract was purified by cation exchange solid phase extraction. The analytes were separated on a Waters Acquity UPLC BEH C18 column (2.1 mm×100 mm, 1.7 μm) and detected by positive electrospray ionization in multiple reactions monitoring (MRM).Results The method showed a good linearity within a certain concentration ranges with relative coefficient r>0.997. The detection limits of 22 sulfonamides in porcine muscle, liver, and kidney were 0.03-0.3 μg/kg, and the quantification limits were 0.1-1 μg/kg. The average recoveries of 22 sulfonamides at the spiking levels of 1, 2 and 5 μg/kg were in the range of 63.0%-115.6%, with the relative standard deviations in the range of 1.2%-15.9%.Conclusion The method was rapid, simple and accurate for the simultaneous determination of 22 sulfonamides in livestock products.
Key words:
Sulfonamides; livestock products; ultra high performance liquid chromatography-tandem mass spectrometry; solid phase extraction; simultaneous determination; veterinary drug residue; food contaminants
磺胺类药物是一类人工合成的具有对氨基苯磺酰胺结构的抗菌药物,对大多数革兰阳性和革兰阴性细菌有效。磺胺类药物具有抗菌谱广、抗菌力强、吸收迅速完全和价廉易得等优点,而被广泛用于畜牧业和兽医临床来预防和治疗畜禽细菌性疾病。但磺胺类药物在体内代谢时间较长,易在人体内蓄积,当蓄积浓度超过一定值时会对人体健康产生危害。短时间大剂量或长时间小剂量刺激可分别会引起急性或慢性中毒,影响机体的泌尿、免疫系统,破坏肌肉、肾脏和甲状腺等组织。另外,人体长期摄入磺胺类药物也会导致许多细菌产生抗药性[1],因此,许多国家和国际组织对食品中磺胺类药物的最大残留限量(MRL)作了相关规定。国际食品法典委员会(CAC)规定,动物肌肉、肝脏、肾脏、脂肪等食品中磺胺二甲嘧啶的MRL为100 μg/kg,牛奶中磺胺二甲嘧啶的MRL为25 μg/kg[2]。欧盟则规定动物源性食品中磺胺类药物总量的MRL为100 μg/kg[3]。我国农业部公告[4]中规定动物源性食品中磺胺类药物总量的MRL为100 μg/kg,牛奶中磺胺二甲嘧啶的MRL为25 μg/kg。
目前常用的检测磺胺类药物的方法有液相色谱法[5-6]、气相色谱法[7]、液相色谱-串联质谱法[8-9]、毛细管电泳法[10]、酶联免疫吸附法[11]等。其中,液相色谱-串联质谱法集高效的分离能力与强大的定性功能于一身,且具有灵敏度高、分析时间短、高通量等优点,已广泛应用于动植物源性食品中农兽药残留的痕量分析中。测定动物源性食品样品中磺胺类药物的前处理方法则主要有液液萃取法[12]、固相萃取法[13-14]、分散固相萃取法[15]、基质固相分散萃取法[16]、超临界流体萃取法[17]等。本试验利用磺胺类药物芳伯氨基的弱碱性,选取基于强阳离子交换的固相萃取前处理技术,通过对提取溶剂、净化条件等的优化,实现对目标化合物的有效净化,结合超高效液相色谱-串联质谱技术,建立了同时测定畜产品中22种常见磺胺类药物残留的检测方法。
磺胺醋酰(CAS:144-80-9, SAA)、磺胺嘧啶(CAS:68-35-9, SDZ)、磺胺索嘧啶(CAS:515-64-0, SIM)、磺胺噻唑(CAS:72-14-0, STZ)、磺胺吡啶(CAS:144-83-2, SPD)、磺胺甲嘧啶(CAS:127-79-7, SMR)、磺胺对甲氧嘧啶(CAS:651-06-9, SMD)、磺胺噁唑(CAS:729-99-7, SMO)、甲氧苄啶(CAS:738-70-5, TMP)、磺胺甲二唑(CAS:144-82-1, SMT)、磺胺二甲嘧啶(CAS:57-68-1, SDM)、磺胺甲氧嗪(CAS:80-35-3, SMP)、磺胺氯哒嗪(CAS:80-32-0, SCP)、磺胺甲噁唑(CAS:723-46-6, SMZ)、磺胺间甲氧嘧啶(CAS:1220-83-3,SMM)、磺胺多辛(CAS:2447-57-6, SDX)、磺胺异噁唑(CAS:127-69-5, SFZ)、磺胺苯酰(CAS:127-71-9, SBA)、磺胺苯吡唑(CAS:526-08-9, SPA)、磺胺氯吡嗪(CAS:102-65-8, SPZ)、磺胺地索辛(CAS: 155-91-9, SDT)、磺胺喹啉(CAS:59-40-5, SQX)均购自加拿大Dr. Ehrenstorfer,纯度均>98.0%;同位素内标13C6-磺胺嘧啶(13C6-SDZ)、13C6-磺胺噻唑(13C6-STZ)、13C6-磺胺吡啶(13C6-SPD)、13C6-磺胺甲嘧啶(13C6-SMR)、13C6-磺胺二甲嘧啶(13C6-SDM)、D3-磺胺甲氧嗪(D3-SMP)、D3-磺胺多辛(D3-SDX)、13C6-磺胺异噁唑(13C6-SFZ)、13C6-磺胺地索辛(13C6-SDT)、13C6-磺胺喹啉(13C6-SQX)均购自德国Witega(纯度均>98.0%);D3-甲氧苄啶(D3-TMP,加拿大Dr. Ehrenstorfer)、D4-磺胺间甲氧嘧啶(D4-SMM,加拿大TRC)纯度均>98.0%;试验用纯净水(经Milli-Q纯水器纯化);甲醇、乙腈、正己烷、甲酸铵均为色谱纯;盐酸、氨水均为分析纯。
净化:用3 ml甲醇活化MCX固相萃取柱,用3 ml 0.1 mol/L盐酸平衡小柱后,加入全部待净化液,弃去流出液,依次加入3 ml 0.1 mol/L盐酸和3 ml甲醇淋洗,弃去流出液,最后用3 ml 5%氨水-甲醇溶液洗脱,收集洗脱液。洗脱液氮吹至干,用1 ml初始流动相复溶,过0.22 μm滤膜后,待上机测定。
质谱:采用电喷雾正离子(ESI+)模式,扫描模式为多反应监测(MRM)。毛细管电压4 kV, 雾化气流速3 L/min, 干燥气流速10 L/min, 加热气流速10 L/min, 脱溶剂气温度250 ℃, 接口温度 300 ℃, 加热模块温度400 ℃,碰撞气压力270 kPa。
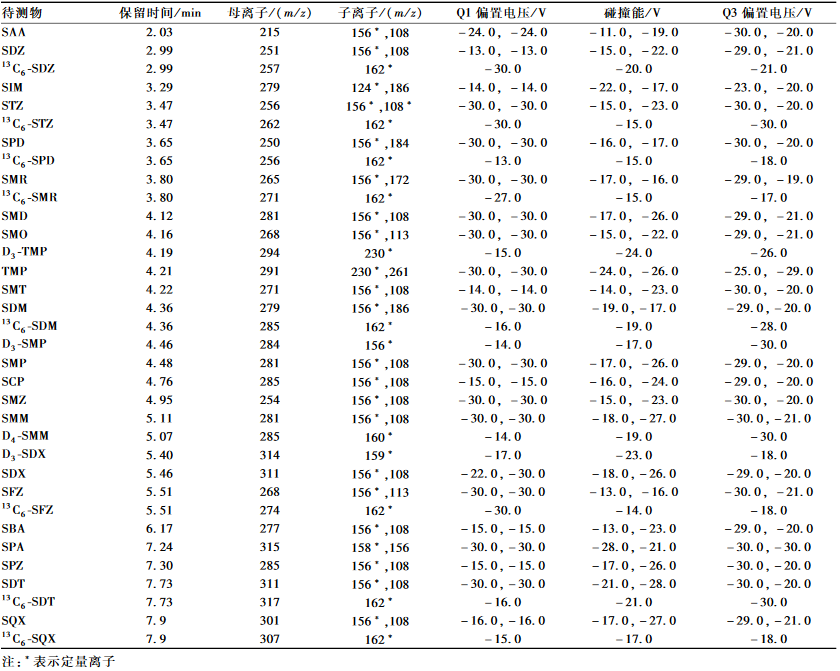
定性定量离子、保留时间、预四极偏置电压及碰撞能等参数见表2。
液相色谱条件的优化需兼顾分离效果及待测组分的离子化效率,以获得最佳的分辨率和最高的灵敏度。本试验涉及22种待测组分,并有多组同分异构体的存在,母离子和子离子均相同,须在保留时间上实现完全分离。根据磺胺类药物的极性大小,首先选取通用型色谱柱UPLC BEH C18进行分析,流动相选取水-甲醇体系,同时在水相中加入甲酸来提高待测物在电喷雾离子源中的正离子化效率,为进一步改善峰形及提高分离度,考虑在体系中加入甲酸铵。比较0.1%甲酸水溶液-甲醇和0.1%甲酸-5 mmol/L甲酸铵-甲醇体系,少量甲酸铵的加入使22种待测物在较短时间内实现了更好的分离,得到了理想的灵敏度和分辨率,且峰形良好。优化后的梯度洗脱程序见1.2.3,在此优化条件下测定的空白猪肉基质加标样品(加标水平为5 μg/kg)中22种磺胺类药物的MRM色谱图见图1。
2.8实际样品的测定
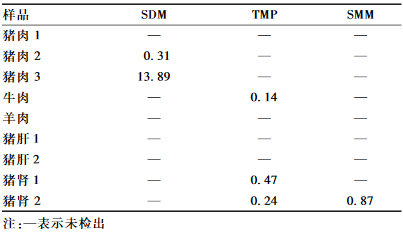
采用已建立的方法对北京市市售的9份畜类样品(猪肉、牛肉、羊肉、猪肝及猪肾)进行了检测,其中,有5份样品检出有磺胺类药物,检出的磺胺类药物包括SDM、TMP、SMM,其余19种磺胺类药物均未检出,检出的磺胺类药物含量均未超过国家限量标准(农业部235号公告)[4],具体结果见表5。
目前常用的检测磺胺类药物的方法有液相色谱法[5-6]、气相色谱法[7]、液相色谱-串联质谱法[8-9]、毛细管电泳法[10]、酶联免疫吸附法[11]等。其中,液相色谱-串联质谱法集高效的分离能力与强大的定性功能于一身,且具有灵敏度高、分析时间短、高通量等优点,已广泛应用于动植物源性食品中农兽药残留的痕量分析中。测定动物源性食品样品中磺胺类药物的前处理方法则主要有液液萃取法[12]、固相萃取法[13-14]、分散固相萃取法[15]、基质固相分散萃取法[16]、超临界流体萃取法[17]等。本试验利用磺胺类药物芳伯氨基的弱碱性,选取基于强阳离子交换的固相萃取前处理技术,通过对提取溶剂、净化条件等的优化,实现对目标化合物的有效净化,结合超高效液相色谱-串联质谱技术,建立了同时测定畜产品中22种常见磺胺类药物残留的检测方法。
1材料与方法
1.1主要仪器与试剂
LCMS-8050超高效液相色谱-三重四极杆质谱联用仪(日本岛津)、2510E-DTH型超声清洗器、Vortex-Genie2涡旋振荡器、3K15离心机、Oasis MCX柱(60 mg/3 ml,美国Waters)。磺胺醋酰(CAS:144-80-9, SAA)、磺胺嘧啶(CAS:68-35-9, SDZ)、磺胺索嘧啶(CAS:515-64-0, SIM)、磺胺噻唑(CAS:72-14-0, STZ)、磺胺吡啶(CAS:144-83-2, SPD)、磺胺甲嘧啶(CAS:127-79-7, SMR)、磺胺对甲氧嘧啶(CAS:651-06-9, SMD)、磺胺噁唑(CAS:729-99-7, SMO)、甲氧苄啶(CAS:738-70-5, TMP)、磺胺甲二唑(CAS:144-82-1, SMT)、磺胺二甲嘧啶(CAS:57-68-1, SDM)、磺胺甲氧嗪(CAS:80-35-3, SMP)、磺胺氯哒嗪(CAS:80-32-0, SCP)、磺胺甲噁唑(CAS:723-46-6, SMZ)、磺胺间甲氧嘧啶(CAS:1220-83-3,SMM)、磺胺多辛(CAS:2447-57-6, SDX)、磺胺异噁唑(CAS:127-69-5, SFZ)、磺胺苯酰(CAS:127-71-9, SBA)、磺胺苯吡唑(CAS:526-08-9, SPA)、磺胺氯吡嗪(CAS:102-65-8, SPZ)、磺胺地索辛(CAS: 155-91-9, SDT)、磺胺喹啉(CAS:59-40-5, SQX)均购自加拿大Dr. Ehrenstorfer,纯度均>98.0%;同位素内标13C6-磺胺嘧啶(13C6-SDZ)、13C6-磺胺噻唑(13C6-STZ)、13C6-磺胺吡啶(13C6-SPD)、13C6-磺胺甲嘧啶(13C6-SMR)、13C6-磺胺二甲嘧啶(13C6-SDM)、D3-磺胺甲氧嗪(D3-SMP)、D3-磺胺多辛(D3-SDX)、13C6-磺胺异噁唑(13C6-SFZ)、13C6-磺胺地索辛(13C6-SDT)、13C6-磺胺喹啉(13C6-SQX)均购自德国Witega(纯度均>98.0%);D3-甲氧苄啶(D3-TMP,加拿大Dr. Ehrenstorfer)、D4-磺胺间甲氧嘧啶(D4-SMM,加拿大TRC)纯度均>98.0%;试验用纯净水(经Milli-Q纯水器纯化);甲醇、乙腈、正己烷、甲酸铵均为色谱纯;盐酸、氨水均为分析纯。
1.2方法
1.2.1标准溶液配制
准确称取各标准品及同位素内标10 mg(精确至0.1 mg)分别于10 ml棕色容量瓶中,用甲醇溶解并定容,配制成1 000 mg/L的标准储备液及同位素内标储备液,于-20 ℃贮存。移取各标准储备液及同位素内标储备液1 ml分别于10 ml棕色容量瓶中,用甲醇稀释并定容至刻度,配制成100 mg/L标准中间液及同位素内标中间液,于-4 ℃贮存。准确移取22种标准中间液各100 μl于10 ml棕色容量瓶中,用甲醇稀释并定容至刻度,配制成1.0 mg/L混合标准使用液。准确移取12种同位素内标中间液各100 μl于10 ml棕色容量瓶中,用甲醇稀释并定容至刻度,配制成1.0 mg/L混合内标使用液,于-4 ℃贮存。
1.2.2样品前处理
提取:用搅碎机将样品充分混匀后搅碎,放入分装容器中,密封,于-20 ℃以下冷冻存放。称取1 g(精确至0.001 g)样品,于15 ml离心管中,加入5 μl 1.0 mg/L同位素内标混合溶液,加入5 ml乙腈溶液,涡旋混匀2 min,9 500 r/min离心5 min,转移上清液于另一离心管中,再加入5 ml乙腈溶液,重复提取一次,合并上清液,氮吹至干。残渣用4 ml 0.1 mol/L盐酸涡旋1 min溶解,再加入3 ml正己烷,涡旋30 s,静置分层,弃去上层,重复加入3 ml正己烷,涡旋30 s,静置分层,弃去上层,下层待净化。净化:用3 ml甲醇活化MCX固相萃取柱,用3 ml 0.1 mol/L盐酸平衡小柱后,加入全部待净化液,弃去流出液,依次加入3 ml 0.1 mol/L盐酸和3 ml甲醇淋洗,弃去流出液,最后用3 ml 5%氨水-甲醇溶液洗脱,收集洗脱液。洗脱液氮吹至干,用1 ml初始流动相复溶,过0.22 μm滤膜后,待上机测定。
1.2.3仪器条件
色谱:Waters Acquity UPLC BEH C18柱(2.1 mm×100 mm, 1.7 μm),流速0.3 ml/min,柱温40 ℃,进样体积10 μl,流动相A为0.1%甲酸-5 mmol/L甲酸铵、流动相B为甲醇,梯度洗脱,参考梯度洗脱条件见表1。质谱:采用电喷雾正离子(ESI+)模式,扫描模式为多反应监测(MRM)。毛细管电压4 kV, 雾化气流速3 L/min, 干燥气流速10 L/min, 加热气流速10 L/min, 脱溶剂气温度250 ℃, 接口温度 300 ℃, 加热模块温度400 ℃,碰撞气压力270 kPa。
|
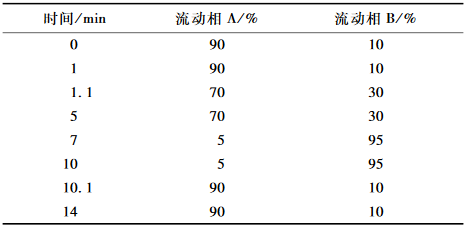
表122种磺胺类药物超高效液相色谱参考梯度洗脱条件 Table 1UPLC analysis conditions for 22 sulfonamides |
|
表2磺胺类药物主要质谱参数 Table 2Mass spectrometry parameters for 22 sulfonamides |
2结果与分析
2.1提取溶剂的选择
在已报道的动物源性食品中磺胺类药物检测方法的文献[14-15,18]中,多用乙腈和EDTA-Mcllvaine缓冲液(pH=4.0)进行提取,由于EDTA-Mcllvaine缓冲液很难用氮气吹干,直接用于MCX净化步骤回收率又很低,故在该方法中不考虑使用。乙腈提取效果良好,同时有沉淀蛋白的作用,加入酸可能会促进提取。比较乙腈和1%甲酸-乙腈溶液的提取效率,差别不大,故仍采用乙腈作为提取溶剂。
2.2净化条件的选择
磺胺类药物为两性化合物,利用其芳伯氨基的弱碱性,选用阳离子交换固相萃取柱进行净化处理。待净化液pH值对净化步骤回收率有很大影响。比较水及不同浓度盐酸溶液0.05、0.1、0.5、1 mol/L作为待净化液时的绝对回收率。用水作待净化液时,除TMP回收率为76.2%,其他化合物回收率均在1%以下。用0.05、0.1、0.5、1 mol/L盐酸溶液作待净化液,22种磺胺类药物绝对回收率均在60%以上,无明显差别。说明当盐酸溶液浓度≥0.05 mol/L时,目标化合物均以阳离子形式存在,可与固相萃取柱上的磺酸基(-SO3H)的H+发生交换。故本试验选用0.1 mol/L盐酸溶液作为待净化液。
2.3液相色谱-质谱条件优化
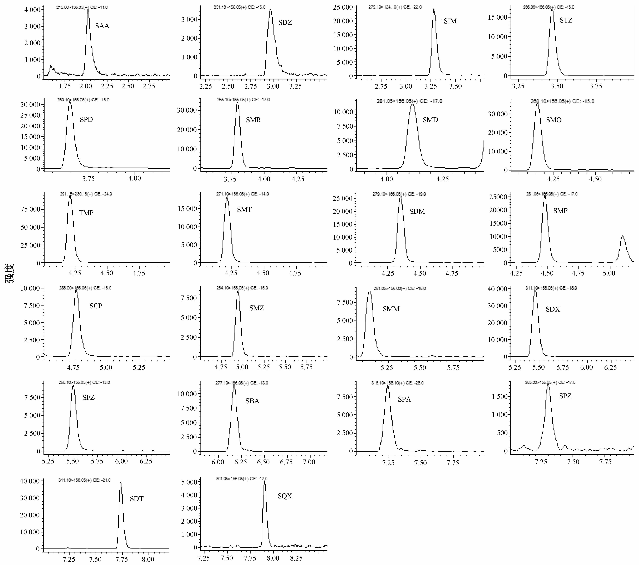
采用直接进样方式,分别对浓度为1.0 μg/ml的22种磺胺类药物标准溶液做正离子和负离子全扫描分析,发现22种磺胺类药物在ESI+模式下均可获得丰度较高的[M+H]+。在此基础上,对各待测物的[M+H]+进行子离子扫描,选取响应最优的两对MRM离子对,分别作为定量离子对和定性离子对,优化其Q1、Q3偏置电压及碰撞能等质谱参数,使子离子的响应达到最佳。磺胺类药物的二级质谱裂解碎片主要包括m/z 156和m/z 108等碎片离子,这主要是其分子结构中桥键部分(-SO2-)的特异性断裂所导致。同时根据待测物的定量离子对,选取相应的离子对作为同位素内标化合物的监测离子对,优化其质谱参数以获得最佳响应。液相色谱条件的优化需兼顾分离效果及待测组分的离子化效率,以获得最佳的分辨率和最高的灵敏度。本试验涉及22种待测组分,并有多组同分异构体的存在,母离子和子离子均相同,须在保留时间上实现完全分离。根据磺胺类药物的极性大小,首先选取通用型色谱柱UPLC BEH C18进行分析,流动相选取水-甲醇体系,同时在水相中加入甲酸来提高待测物在电喷雾离子源中的正离子化效率,为进一步改善峰形及提高分离度,考虑在体系中加入甲酸铵。比较0.1%甲酸水溶液-甲醇和0.1%甲酸-5 mmol/L甲酸铵-甲醇体系,少量甲酸铵的加入使22种待测物在较短时间内实现了更好的分离,得到了理想的灵敏度和分辨率,且峰形良好。优化后的梯度洗脱程序见1.2.3,在此优化条件下测定的空白猪肉基质加标样品(加标水平为5 μg/kg)中22种磺胺类药物的MRM色谱图见图1。
|
图1正离子模式下空白猪肉基质加标样品的MRM色谱图(加标水平均为5 μg/kg) Figure 1MRM chromatograms of a porcine muscle sample at the spiked level of 5 μg/kg in ESI+ mode |
2.4基质效应
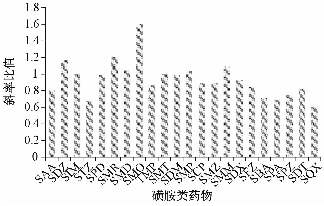
用初始流动相配制22种磺胺类药物混合标准溶液系列,同时用空白猪肝样品,按照1.2.2提取净化,用空白基质溶液配制同浓度水平的系列基质匹配标准溶液。通常以基质匹配标准曲线的斜率与纯溶剂配制标准曲线的斜率之比来评价基质效应,比值越接近1.0,说明基质效应越弱,大于1.0表明存在基质增强效应,小于1.0表明存在基质抑制效应。22种磺胺类药物的基质效应如图2所示,比值在0.61~1.60范围内,表明22种磺胺类药物存在不同程度的基质增强或抑制效应。本试验采用同位素内标稀释法进行定量,既可以补偿基质效应对定量结果的影响,同时也可抵消前处理过程的损失,保证了定量测定的准确性。
|
图2猪肝样品中22种磺胺类药物的基质效应 Figure 2Matrix effects of 22 sulfonamides in porcine liver |
2.5方法的线性范围
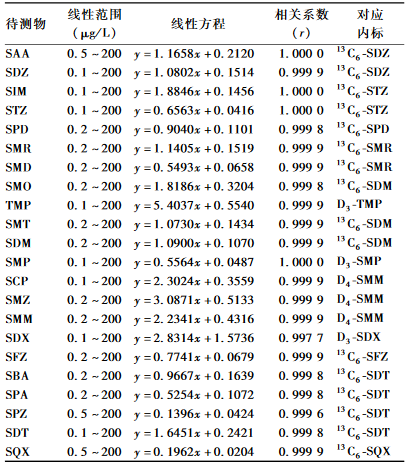
配制0.1、0.2、0.5、1、2、5、10、20、50、200 μg/L的磺胺类药物标准溶液系列,同位素内标浓度均为5 μg/L,将标准溶液注入仪器中,以磺胺类药物浓度与对应内标浓度的比为横坐标,峰面积比为纵坐标,绘制标准曲线。结果表明,待测物在浓度范围 内均呈良好的线性关系,相关系数(r)>0.997,见表3。
|
表3磺胺类药物的线性试验结果 Table 3Linear ranges, linear equations, correlation coefficients of 22 sulfonamides |
2.6方法检出限和定量限
对空白样品进行低水平加标试验,以3倍信噪比对应的浓度为方法的检出限(LOD),以10倍信噪比对应的浓度作为方法的定量限(LOQ),得到22种磺胺类药物的方法检出限及定量限见表4。结果显示,22种待测物的方法检出限均≤0.3 μg/kg,定量限均≤1 μg/kg,能够满足畜产品中磺胺类药物残留检测的要求。
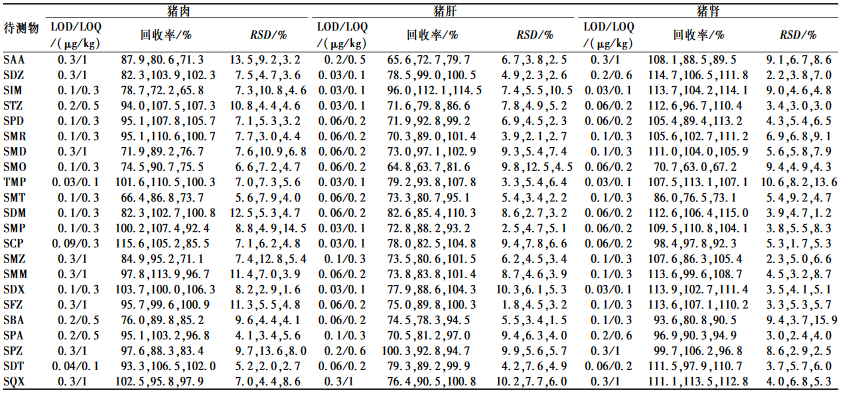
|
表422种磺胺类药物在猪肉、猪肝、猪肾基质中的检出限、定量限及空白加标回收试验结果(n=6) Table 4Detection and quantification limit, recoveries and relative standard deviations(RSDs) of 22 sulfonamides in porcine muscle, liver, kidney |
2.7方法的准确度和精密度
以空白猪肉样品加标的回收率表示方法的准确度,以回收率的相对标准偏差(RSD)表示方法的精密度。取空白猪肉、猪肝和猪肾样品进行低、中、高3个水平(1、2和5 μg/kg)的加标回收试验,每个添加水平重复6次,结果见表4。结果显示,22种磺胺类药物在3个加标水平下的平均回收率为63.0%~115.6%,RSD为1.2%~15.9%,表明本方法的准确度和精密度良好。2.8实际样品的测定
采用已建立的方法对北京市市售的9份畜类样品(猪肉、牛肉、羊肉、猪肝及猪肾)进行了检测,其中,有5份样品检出有磺胺类药物,检出的磺胺类药物包括SDM、TMP、SMM,其余19种磺胺类药物均未检出,检出的磺胺类药物含量均未超过国家限量标准(农业部235号公告)[4],具体结果见表5。
|
表5畜类样品中磺胺类药物的含量(μg/kg) Table 5Concentration of sulfonamides in livestock samples |
3小结
本试验采用阳离子交换固相萃取技术与同位素稀释的超高效液相色谱-串联质谱技术联用,建立了同时测定畜产品中22种磺胺类药物残留量的方法。该方法简便快速、灵敏度高,且准确度及精密度均能满足兽药残留检测的要求,为我国动物源性食品中磺胺类药物的常规监测和监管提供了可靠的技术手段。
参考文献
[1]吴永宁,邵兵, 沈建忠. 兽药残留检测与监控技术[M]. 北京: 化学工业出版社, 2007: 189.
[2]Codex Alimentarius Commission. Maximum Residue Limits (MRLs) and Risk Management Recommendations (RMRs) for residue of veterinary drugs in foods:CAC/MRL 2-2015 [S].The 38th Session of the Codex Alimentarus Commission,2015:33.
[3]European Union. Commission Regulation (EU) No 37/2010 of 22 December 2009 on pharmacologically active substances and their classification regarding maximum residue limits in foodstuffs of animal origin[Z].2009-12-22.
[4]中华人民共和国农业部. 动物性食品中兽药最高残留限量:农业部235号公告[A]. 2002-12-24.
[5]HUANG J G, LIU J J, ZHANG C, et al. Determination of sulfonamides in food samples by membrane-protected micro-solid phase extraction coupled with high performance liquid chromatography[J]. J Chromatogr A, 2012, 1219(2):66-74.
[6]GAMBA V, TERZANO C, FIORONI L, et al. Development and validation of a conrmatory method for the determination of sulphonamides in milk by liquid chromatography with diode array detection[J]. Anal Chim Acta, 2009,637(1/2):18-23.
[7]CHIAVARINO B, CRESTONI M E, MARZIO A D, et al. Determination of sulfonamide antibiotics by gas chromatography coupled with atomic emission detection[J]. J Chromatogr B, 1998, 706(2):269-277.
[8]LU K H, CHEN C Y, LEE M R. Trace determination of sulfonamides residues in meat with a combination of solid-phase microextraction and liquid chromatography-mass spectrometry[J].Talanta, 2007, 72(3):1082-1087.
[9]REEVES V B. Confirmation of multiple sulfonamide residues in bovine milk by gas chromatography-positive chemical ionization mass spectrometry[J]. J Chromatogr B, 1999, 723(1/2):127-137.
[10]FONT G, JUAN-GARCAR A, PICCONT G. Pressurized liquid extraction combined with capillary electrophoresis-mass spectrometry as an improved methodology for the determination of sulfonamide residues in meat[J]. J Chromatogr A, 2007, 1159(1/2):233-241.
[11]ZHOU Q, PENG D P, WANG Y L, et al. A novel hapten and monoclonal-based enzyme-linked immunosorbent assay for sulfonamides in edible animal tissues[J]. Food Chem, 2014, 154(7):52-62.
[12]VOLMER D A. Multiresidue determination of sulfonamide antibiotics in milk by short-column liquid chromatography coupled with electrospray ionization tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 1996, 10(13):1615-1620.
[13]LI H, SUN H W, ZHANG J X, et al. Highly sensitive and simultaneous determination of sixteen sulphonamide antibiotics, four acetyled metabolites and trimethoprim in meat by rapid resolution liquid chromatography-tandem mass spectrometry[J]. Food Control, 2013, 31(2): 359-365.
[14]ZHANG Z W, LI X W, DING S Y, et al. Multiresidue analysis of sulfonamides, quinolones, and tetracyclines in animal tissues by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Chem, 2016, 204(2):252-262.
[15]KUNG T A, TSAI C W, KU B C, et al. A generic and rapid strategy for determining trace multiresidues of sulfonamides in aquatic products by using an improved QuEChERS method and liquid chromatography-electrospray quadrupole tandem mass spectrometry[J]. Food Chem, 2015, 175(11):189-196.
[16]王重洋,王远鹏,王宁,等.基质固相分散-超快速液相色谱法测定牛肉中磺胺类兽药[J].分析化学,2013,41(1):83-87.
[17]MAXWELL R J, LIGHTFIELD A R. Multiresidue supercritical fluid extraction method for the recovery at low ppb levels of three sulfonamides from fortified chicken liver[J]. J Chromatogr B, 1998, 715(2):431-435.
[18]许旭,耿丹丹,肖远灿,等. 改良QuEChERS/HPLC-光化学在线衍生荧光检测法测定猪肉中18种磺胺类药物残留量[J].分析测试学报,2015, 34(7):807-812.
[2]Codex Alimentarius Commission. Maximum Residue Limits (MRLs) and Risk Management Recommendations (RMRs) for residue of veterinary drugs in foods:CAC/MRL 2-2015 [S].The 38th Session of the Codex Alimentarus Commission,2015:33.
[3]European Union. Commission Regulation (EU) No 37/2010 of 22 December 2009 on pharmacologically active substances and their classification regarding maximum residue limits in foodstuffs of animal origin[Z].2009-12-22.
[4]中华人民共和国农业部. 动物性食品中兽药最高残留限量:农业部235号公告[A]. 2002-12-24.
[5]HUANG J G, LIU J J, ZHANG C, et al. Determination of sulfonamides in food samples by membrane-protected micro-solid phase extraction coupled with high performance liquid chromatography[J]. J Chromatogr A, 2012, 1219(2):66-74.
[6]GAMBA V, TERZANO C, FIORONI L, et al. Development and validation of a conrmatory method for the determination of sulphonamides in milk by liquid chromatography with diode array detection[J]. Anal Chim Acta, 2009,637(1/2):18-23.
[7]CHIAVARINO B, CRESTONI M E, MARZIO A D, et al. Determination of sulfonamide antibiotics by gas chromatography coupled with atomic emission detection[J]. J Chromatogr B, 1998, 706(2):269-277.
[8]LU K H, CHEN C Y, LEE M R. Trace determination of sulfonamides residues in meat with a combination of solid-phase microextraction and liquid chromatography-mass spectrometry[J].Talanta, 2007, 72(3):1082-1087.
[9]REEVES V B. Confirmation of multiple sulfonamide residues in bovine milk by gas chromatography-positive chemical ionization mass spectrometry[J]. J Chromatogr B, 1999, 723(1/2):127-137.
[10]FONT G, JUAN-GARCAR A, PICCONT G. Pressurized liquid extraction combined with capillary electrophoresis-mass spectrometry as an improved methodology for the determination of sulfonamide residues in meat[J]. J Chromatogr A, 2007, 1159(1/2):233-241.
[11]ZHOU Q, PENG D P, WANG Y L, et al. A novel hapten and monoclonal-based enzyme-linked immunosorbent assay for sulfonamides in edible animal tissues[J]. Food Chem, 2014, 154(7):52-62.
[12]VOLMER D A. Multiresidue determination of sulfonamide antibiotics in milk by short-column liquid chromatography coupled with electrospray ionization tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 1996, 10(13):1615-1620.
[13]LI H, SUN H W, ZHANG J X, et al. Highly sensitive and simultaneous determination of sixteen sulphonamide antibiotics, four acetyled metabolites and trimethoprim in meat by rapid resolution liquid chromatography-tandem mass spectrometry[J]. Food Control, 2013, 31(2): 359-365.
[14]ZHANG Z W, LI X W, DING S Y, et al. Multiresidue analysis of sulfonamides, quinolones, and tetracyclines in animal tissues by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Chem, 2016, 204(2):252-262.
[15]KUNG T A, TSAI C W, KU B C, et al. A generic and rapid strategy for determining trace multiresidues of sulfonamides in aquatic products by using an improved QuEChERS method and liquid chromatography-electrospray quadrupole tandem mass spectrometry[J]. Food Chem, 2015, 175(11):189-196.
[16]王重洋,王远鹏,王宁,等.基质固相分散-超快速液相色谱法测定牛肉中磺胺类兽药[J].分析化学,2013,41(1):83-87.
[17]MAXWELL R J, LIGHTFIELD A R. Multiresidue supercritical fluid extraction method for the recovery at low ppb levels of three sulfonamides from fortified chicken liver[J]. J Chromatogr B, 1998, 715(2):431-435.
[18]许旭,耿丹丹,肖远灿,等. 改良QuEChERS/HPLC-光化学在线衍生荧光检测法测定猪肉中18种磺胺类药物残留量[J].分析测试学报,2015, 34(7):807-812.
 高洁,陈达炜,丁宇琦,李长坤,赵云峰.固相萃取-超高效液相色谱-串联质谱法测定畜产品中残留的22种磺胺类药物[J].中国食品卫生杂志,2018,30(1):28-34.
高洁,陈达炜,丁宇琦,李长坤,赵云峰.固相萃取-超高效液相色谱-串联质谱法测定畜产品中残留的22种磺胺类药物[J].中国食品卫生杂志,2018,30(1):28-34.