DOi:10.13590/j.cjfh.2018.01.009
高效液相色谱-串联质谱法同时测定复合维生素片中的叶酸和生物素
(浙江省食品药品检验研究院,浙江 杭州 310052)
收稿日期:2017-09-01
作者简介: 王任 女 中级工程师 研究方向为保健品、食品和化妆品检验 E-mail:mention123456@aliyun.com
基金项目:
摘要:目的 建立高效液相色谱-串联质谱法同时定性和定量分析复合维生素片中叶酸和生物素的方法。方法 样品用水溶液溶解,经Eclipse C18色谱柱(2.1 mm×100 mm,1.8 μm)分离,流动相为0.1%甲酸溶液和乙腈梯度洗脱,流速0.2 ml/min,采用电喷雾离子源正离子模式,多反应监测(MRM)进行检测。结果 叶酸和生物素在5 min内得到较好的分离。叶酸和生物素的线性范围分别为42~523和47~583 ng/ml,线性回归方程分别为y=1157.63x-6698.38 (r2=0.999 9)和y=207.93x-3052.26 (r2=0.998 2),低、中、高3个添加水平的回收率分别为99.9%~108.7%和90.1%~94.5%,相对标准偏差(RSD)均为1.0% (n=6),检出限分别为0.33和0.08 μg/g。结论 高效液相色谱-串联质谱法可靠、灵敏、准确,可用于复合维生素片中叶酸和生物素同时定性和定量分析。
关键词:
叶酸; 生物素; 高效液相色谱-串联质谱; 复合维生素片; 测定
文章编号:1004-8456(2018)01-0042-05
中图分类号:R155
文献标志码:A
Simultaneous determination of folic acid and biotin in compound vitamin pills by high performance liquid chromatography-tandem mass spectrometry
((Zhejiang Institute for Food and Drug Control,Zhejiang Hangzhou 310052, China)
Abstract:Objective A method using high performance liquid chromatography tandem mass spectrometry for simultaneous determination of folic acid and biotin in compound vitamin pills was presented.Methods Samples were extracted by water. The analysis was carried out on an Agilent Eclipse C18(2.1 mm×100 mm,1.8 μm)column with isocratic elution using a mobile phase of 0.1% aqueous formic acid and acetonitrile at 0.2 ml/min. Mass spectrometry acquisition was done in the positive ion mode and the analytes were detected in the multiple reaction monitoring(MRM)mode.Results Folic acid and biotin in samples could be well separated within 5 min. The calibration cures were linear over the concentration range of 42-523 ng/ml and 47-583 ng/ml for folic acid and biotin, respectively. The linear regression equations were y=1157.63x-6698.38(r2=0.999 9) and y=207.93x-3052.26(r2=0.998 2), respectively. The average recoveries were 99.9%-108.7% and 90.1%-94.5% for folic acid and biotin at low, medium and high adding levels, respectively. The relative standard deviation(RSD)were both 1.0% (n=6). The detection limit was 0.33 and 0.08 μg/g for folic acid and biotin, respectively.Conclusion The developed method was precise, accurate and sensitive, which therefore could be applied for the analysis of folic acid and biotin in compound vitamin pills.
Key words:
Folic acid; biotin; high performance liquid chromatography-tandem mass spectrometry; compound vitamin pills; test
叶酸是一种重要的B族维生素,与人体重要的生化过程密切相关,直接影响核酸的合成及氨基酸代谢,对细胞分裂、增殖和组织生长具有极其重要的作用[1]。生物素即维生素H或辅酶R,是一种水溶性含硫维生素,溶于水而不溶于酒精、氯仿及乙醚[2]。许多保健食品尤其是营养素补充剂和强化食品中均添加叶酸和生物素[3]。但是由于保健品中其他维生素类和辅料的影响,分离达不到良好的效果,同时叶酸和生物素含量较低[4],所以建立同时适用于保健品中叶酸和生物素含量测定的高效液相色谱-串联质谱法有一定意义。
测定叶酸和生物素单种或2种以上维生素的高效液相色谱法[5-9]和高效液相色谱-串联质谱法等方法[10-11]在国内外已有报道。但是同时测定复合维生素片中的叶酸和生物素的研究鲜有报道。本试验参考相关文献[5-12],针对复合维生素片中的叶酸和生物素,优化系统条件,建立了同时测定叶酸和生物素的分析方法,且该方法具有简便、灵敏、准确等优点。
乙腈、甲酸、甲酸铵均为色谱纯,氨水为分析纯,生物素标准品(纯度为99.6%,100291-201303)、叶酸标准品(纯度为89.7%,8100074-201214)均购自中国食品药品检定研究院。
生物素标准储备液(58.27 μg/ml):准确称取11.70 mg 生物素标准品于200 ml棕色容量瓶中,超纯水溶解,超声,放冷,定容,作为生物素标准储备液,避光,现用现配。
混合标准曲线溶液制备:分别移取叶酸标准储备液和生物素标准储备液各1.0 ml于100 ml棕色容量瓶中,用纯水定容至刻度,混匀,得到混合标准储备液(叶酸:522.95 ng/ml,生物素:582.66 ng/ml)作为ST5,放置在4 ℃冰箱中储存。分别准确移取25、4、2 ml ST5,用纯水定容至50、10、10 ml作为ST4、ST3和ST2。准确移取4 ml ST2,用纯水定容至10 ml作为ST1。配制成混合标准曲线溶液(叶酸线性范围为41.81~522.95 ng/ml,生物素线性范围为46.61~582.66 ng/ml),混合标准曲线溶液现用现配,全程避光操作。
质谱条件:电喷雾离子源正离子模式(ESI+),多反应监测(MRM)扫描,毛细管电压为2.5 kV,毛细管温度为400 ℃,脱鞘气流速为11 L/min,具体质谱参数见表2。
测定叶酸和生物素单种或2种以上维生素的高效液相色谱法[5-9]和高效液相色谱-串联质谱法等方法[10-11]在国内外已有报道。但是同时测定复合维生素片中的叶酸和生物素的研究鲜有报道。本试验参考相关文献[5-12],针对复合维生素片中的叶酸和生物素,优化系统条件,建立了同时测定叶酸和生物素的分析方法,且该方法具有简便、灵敏、准确等优点。
1材料与方法
1.1材料
1.1.1受试样品
复合维生素片为浙江省食品药品检验研究院国家、省级抽检样品。
1.1.2主要仪器与试剂
1290-G6490三重四极杆质谱仪(美国安捷伦),Eclipse C18色谱柱(2.1 mm×100 mm,1.8 μm),AE-163电子天平,Mini-Q水纯化系统。乙腈、甲酸、甲酸铵均为色谱纯,氨水为分析纯,生物素标准品(纯度为99.6%,100291-201303)、叶酸标准品(纯度为89.7%,8100074-201214)均购自中国食品药品检定研究院。
1.2方法
1.2.1标准溶液的配制
叶酸标准储备液(52.30 μg/ml):准确称取11.66 mg叶酸标准品于200 ml棕色容量瓶中,约100 ml 0.5%氨水溶解,超声,放冷,超纯水定容,作为叶酸标准储备液,避光,现用现配。生物素标准储备液(58.27 μg/ml):准确称取11.70 mg 生物素标准品于200 ml棕色容量瓶中,超纯水溶解,超声,放冷,定容,作为生物素标准储备液,避光,现用现配。
混合标准曲线溶液制备:分别移取叶酸标准储备液和生物素标准储备液各1.0 ml于100 ml棕色容量瓶中,用纯水定容至刻度,混匀,得到混合标准储备液(叶酸:522.95 ng/ml,生物素:582.66 ng/ml)作为ST5,放置在4 ℃冰箱中储存。分别准确移取25、4、2 ml ST5,用纯水定容至50、10、10 ml作为ST4、ST3和ST2。准确移取4 ml ST2,用纯水定容至10 ml作为ST1。配制成混合标准曲线溶液(叶酸线性范围为41.81~522.95 ng/ml,生物素线性范围为46.61~582.66 ng/ml),混合标准曲线溶液现用现配,全程避光操作。
1.2.2样品溶液的制备
取复合维生素片研细,准确称取0.45 g,置于250 ml棕色容量瓶中,约100 ml 0.5%氨水溶解,超声,放冷,超纯水定容,移取10 ml置于20 ml棕色容量瓶,超纯水定容,10 000 r/min离心10 min,取上清液供测定,全程避光操作。
1.2.3仪器条件
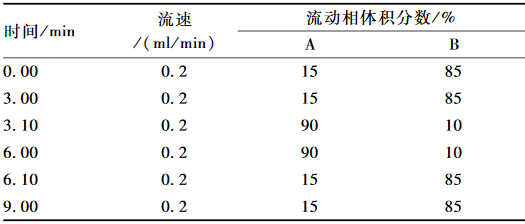
色谱条件:采用Eclipse C18色谱柱(2.1 mm×100 mm,1.8 μm),进样体积为1.0 μl,流动相A为乙腈,流动相B为0.1%甲酸溶液,流速为0.2 ml/min,采用梯度洗脱,流动梯度洗脱程序见表1。
|
表1梯度洗脱程序 Table 1Gradient elution program |
|
|
表2质谱MRM参数 Table 2Mass spectrometry parameters |
2结果与分析
2.1试验条件的优化
2.1.1提取溶剂的选择
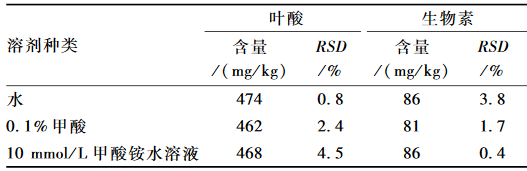
由于叶酸和生物素都是水溶性维生素,所以采用超声提取被测物质。根据文献报道[2,13],本试验分别考察水、0.1%甲酸和10 mmol/L甲酸铵水溶液作为溶剂对被测物质的溶解效果。结果表明3种溶剂都能够较好地提取被测物质,鉴于成本考虑,本试验选用水作为溶剂,见表3。
|
表3不同溶剂提取待测样品的含量(n=2) Table 3Comparison effect of different solutions on sample content |
2.1.2子离子选择及碰撞能优化
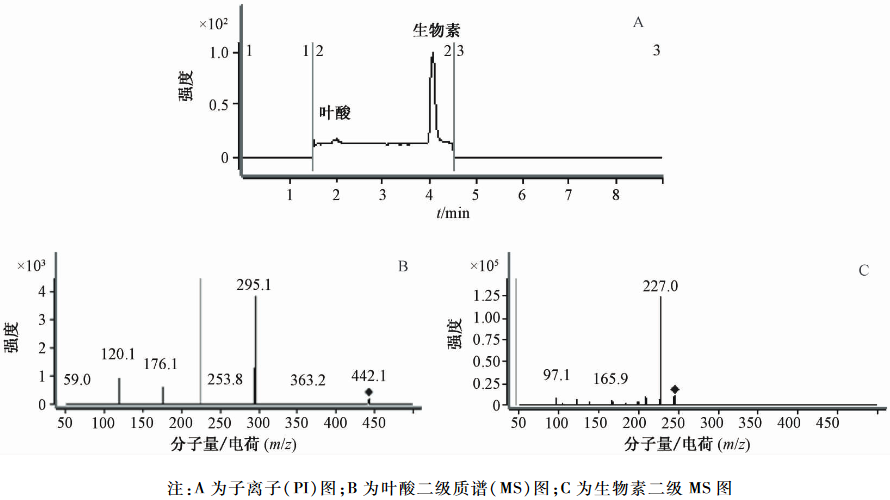
根据叶酸和生物素的理化性质及其母离子,参考相关文献[4,10-11],选择信号强度大的两个子离子碎片作为定性离子和定量离子,并以此为基础,对碰撞能量进行优化,以MRM为检测方式,使目标化合物的离子化达到最佳水平。本试验选择295.1 m/z为叶酸定量离子,176.1 m/z为叶酸定性离子,227 m/z为生物素定量离子,97.1 m/z为生物素定性离子,碰撞能量为20 eV,见图1。注:A为子离子(PI)图;B为叶酸二级质谱(MS)图;C为生物素二级MS图
|
图1叶酸和生物素的PI图及其二级MS图 Figure 1Folic acid and biotin pictures of PI and two stage MS |
2.1.3流动相的选择
流动相的组成和比例既影响物质的分离又影响灵敏度。由于被检测的化合物都是水溶性化合物,同时参考其他文献[10],本试验使用乙腈作为流动相A,并考察水、0.1%甲酸和10 mmol/L甲酸铵水溶液作为流动相B的分离效果。结果表明,水作为流动相B时,叶酸有拖尾现象,0.1%甲酸和10 mmol/L甲酸铵水溶液作为流动相B时,叶酸拖尾现象有所改善。在保证试验灵敏度并考虑成本的前提下,最终选择0.1%甲酸作为流动相B。流动相比例采用梯度洗脱可以使化合物分离效果更好,并获得更好的峰型,见图2。

|
图2叶酸和生物素的MRM质谱图 Figure 2Folic acid and biotin pictures of MRM |
2.2标准曲线和检出限
以标准溶液峰面积为纵坐标,浓度为横坐标,分别绘制标准曲线。结果显示,叶酸的线性范围为42~523 ng/ml,线性回归方程为y=1157.63x-6698.38,相关系数r2=0.999 9;生物素的线性范围为47~583 ng/ml,线性回归方程为y=207.93x-3052.26,r2=0.998 2。以3倍信噪比为检出限,叶酸和生物素的检出限分别为0.33和0.08 μg/g;以10倍信噪比为定量限,叶酸和生物素的定量限分别为1.10和0.27 μg/g。试验表明可以对叶酸和生物素这2种维生素含量较低的样品进行定量分析。
2.3精密度和重复性
取同一浓度混合标准曲线溶液,连续进样6次,分别计算叶酸和生物素对照品峰面积的相对标准偏差(RSD),叶酸和生物素的峰面积RSD均为1.0%,可见仪器的精密度良好,适用于定性定量分析。精密称取阴性空白样品(待测样品辅料,不含叶酸和生物素的样品)共6份,按1.2.2样品溶液的制备进行操作,得到叶酸和生物素的重复性RSD分别为1.0%和1.6%。
2.4稳定性
取同一浓度混合标准曲线溶液,于1.0、3.0、8.0、20.0、23.0、24.0 h分别注入高效液相色谱-串联质谱仪进行测定,以叶酸和生物素峰面积积分值为指标,测定其稳定性。结果表明叶酸和生物素的稳定性RSD分别为6.7%和1.5%。
2.5加标回收率
称取阴性空白样品共9份,分别添加3个不同浓度混合标准曲线溶液(约为样品标示量的80%、100%和120%),按1.2.2进行操作,叶酸和生物素的回收率范围分别为99.9%~108.7%和90.1%~94.5%,RSD分别为0.8%~1.7%和0.8%~2.4%,具体结果见图3和表4。结果表明,该方法在不同添加水平均有较好的回收率和重复性,方法的准确度与精密度满足试验需求。|
|
图3阴性空白基质MRM图(左)及叶酸和生物素对照品加标MRM图(右) Figure 3Negative sample blank, folic acid and biotin pictures of MRM |

|
表4加标回收率(n=3) Table 4Recovery rate |
2.6实际样品测定
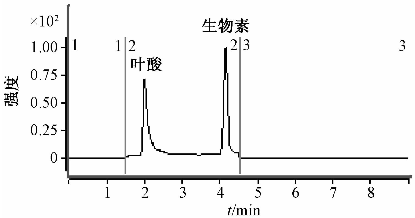
应用本方法测定市售某品牌保健品中叶酸和生物素的含量,其中叶酸含量为474 mg/kg (n=2,RSD=0.8%),生物素含量为86 mg/kg (n=2,RSD=3.8%),样品MRM图见图4。
|
图4样品MRM图 Figure 4Sample picture of MRM |
3小结
本试验采用了高效液相色谱-串联质谱的方法,同时对复合维生素片中的叶酸和生物素进行定性和定量分析。复合维生素片中叶酸和生物素的含量相对偏低,利用三重四极质谱的MRM高选择性检测,提高检出限,分析时间变短、减少其他基质干扰等问题。结果表明,该方法比传统的检测方法简单快速,结果准确可靠,可作为复合维生素片中叶酸和生物素的定性和定量的方法。
参考文献
[1]李超群. 保健品中叶酸含量检测研究[J]. 中国保健营养(上旬刊),2013,23(9):5281-5282.
[2]肖晶,杨大进,张馨之. 高效液相色谱法测定保健食品中的生物素[J]. 中国食品卫生杂志, 2006, 18(3):234-236.
[3]王敬,马育松,刘彩虹,等. 液相色谱-串联质谱法测定强化食品中叶酸的含量[J]. 分析测试学报, 2014, 33(11): 1224-1230.
[4]蔡伟江,王耀平. 液相色谱-串联质谱法测定保健品中的生物素[J]. 医药前沿, 2014, 5(28): 28-29.
[5]罗建波. 保健食品中叶酸的高效液相色谱测定法[J]. 职业与健康, 2003, 19(9): 36-37.
[6]秦瑜丽. HPLC法检测复合维生素片中叶酸和维生素B12的含量[J].安徽农业科学, 2013, 41(5):2248-2249.
[7]石丹,包怡红,贾云虹,等. 反相高效液相色谱法检测婴幼儿配方乳粉中叶酸的含量[J]. 食品工业科技, 2009,30(3): 319-322.
[8]商允鹏,张志国,韩建春,等. SPE-HPLC法检测婴幼儿配方乳粉中生物素的质量分数[J]. 中国乳品工业, 2009, 37(2): 53-56.
[9]ALBAL-HURTADO S,CID S,IZQUIERDO-PULIDO M,et al. Determination of available lysine in infant milk formulae by high-performance liquid chromatography[J]. Journal of Chromatography A, 1997, 778(1/2): 235-241.
[10]陈美君,王曼,亢美娟,等. 超高压液相色谱-串联质谱法同时测定婴幼儿配方乳粉中11种B族维生素[J]. 食品科学, 2016, 37(4): 144-153.
[11]王凤玲,刘爱国,孙佳佳,等. 高效液相色谱-质谱法同时测定婴幼儿配方奶粉中叶酸、VB12和生物素[J]. 食品科学, 2013, 34(22): 269-272.
[12]彭科怀,杨长晓,刘广辉. 高效液相色谱法测定添加维生素保健食品中叶酸[J].预防医学情报杂志, 2015, 31(2): 123-125.
[13]粱波. 超高效液相色谱-串联质谱法同时测定功能饮料中多种维生素的含量[J]. 浙江农业科学, 2015, 56(8):1276-1279.
[2]肖晶,杨大进,张馨之. 高效液相色谱法测定保健食品中的生物素[J]. 中国食品卫生杂志, 2006, 18(3):234-236.
[3]王敬,马育松,刘彩虹,等. 液相色谱-串联质谱法测定强化食品中叶酸的含量[J]. 分析测试学报, 2014, 33(11): 1224-1230.
[4]蔡伟江,王耀平. 液相色谱-串联质谱法测定保健品中的生物素[J]. 医药前沿, 2014, 5(28): 28-29.
[5]罗建波. 保健食品中叶酸的高效液相色谱测定法[J]. 职业与健康, 2003, 19(9): 36-37.
[6]秦瑜丽. HPLC法检测复合维生素片中叶酸和维生素B12的含量[J].安徽农业科学, 2013, 41(5):2248-2249.
[7]石丹,包怡红,贾云虹,等. 反相高效液相色谱法检测婴幼儿配方乳粉中叶酸的含量[J]. 食品工业科技, 2009,30(3): 319-322.
[8]商允鹏,张志国,韩建春,等. SPE-HPLC法检测婴幼儿配方乳粉中生物素的质量分数[J]. 中国乳品工业, 2009, 37(2): 53-56.
[9]ALBAL-HURTADO S,CID S,IZQUIERDO-PULIDO M,et al. Determination of available lysine in infant milk formulae by high-performance liquid chromatography[J]. Journal of Chromatography A, 1997, 778(1/2): 235-241.
[10]陈美君,王曼,亢美娟,等. 超高压液相色谱-串联质谱法同时测定婴幼儿配方乳粉中11种B族维生素[J]. 食品科学, 2016, 37(4): 144-153.
[11]王凤玲,刘爱国,孙佳佳,等. 高效液相色谱-质谱法同时测定婴幼儿配方奶粉中叶酸、VB12和生物素[J]. 食品科学, 2013, 34(22): 269-272.
[12]彭科怀,杨长晓,刘广辉. 高效液相色谱法测定添加维生素保健食品中叶酸[J].预防医学情报杂志, 2015, 31(2): 123-125.
[13]粱波. 超高效液相色谱-串联质谱法同时测定功能饮料中多种维生素的含量[J]. 浙江农业科学, 2015, 56(8):1276-1279.
 王任,吴鸳鸯,程巧鸳,周明昊.高效液相色谱-串联质谱法同时测定复合维生素片中的叶酸和生物素[J].中国食品卫生杂志,2018,30(1):42-46.
王任,吴鸳鸯,程巧鸳,周明昊.高效液相色谱-串联质谱法同时测定复合维生素片中的叶酸和生物素[J].中国食品卫生杂志,2018,30(1):42-46.