DOi:10.13590/j.cjfh.2018.02.002
2016年上海市市售肉制品中沙门菌耐药谱与分型研究
(上海市疾病预防控制中心,上海200336)
收稿日期:2018-02-11
作者简介:刘玥女主管技师研究方向为食品微生物E-mail:sllapy@163.com
通信作者:张红芝女副主任技师研究方向为食品微生物E-mail:zhanghongzhi@scdc.sh.cn
基金项目:上海市卫生和计生委员会青年课题(20174Y0141);健康危险因素监测与相关疾病预防控制(GWIV27.1)
摘要:目的研究上海市市售肉制品中沙门菌血清型、耐药谱和分子分型特征。方法2016年1~8月在上海市所辖16个行政区,随机选择1个密集型社区,抽取1家超市或市场作为哨点,定期采集畜、禽类肉制品,按国家食品安全风险评估中心(CFSA)食源性疾病监测方案进行沙门菌分离、血清分型、抗生素定量检测与剂量评估、优势菌的分子分型。结果606份样品包括猪、鸡、鸭、牛、羊、鹅肉制品,共分离沙门菌158株,总阳性率为26.1%,畜肉和禽肉来源分别占52.5%(83/158)和47.5%(75/158)。前5位沙门菌血清型依次为肠炎沙门菌、鼠伤寒沙门菌、德尔卑沙门菌、罗森沙门菌和印第安纳沙门菌,畜肉和禽肉来源优势菌型间差异有统计学意义(P<0.05);菌株对磺胺异噁唑耐药率最高(79.7%,126/158),对链霉素、萘啶酸、氨苄西林、四环素和氯霉素耐药率在38.0%~77.8%,多重耐药(MDR)菌株(≥3类)占77.8%(123/158),猪肉来源沙门菌对庆大霉素、链霉素、磺胺异噁唑、复方新诺明、氯霉素、四环素耐药率均高于鸡肉来源沙门菌,鸡肉来源沙门菌对头孢噻呋、头孢曲松、萘啶酸耐药率均高于猪肉来源沙门菌,差异均有统计学意义(P<0.05),32.9%(52/158)的菌株对至少6种抗生素超检测限值;肠炎沙门菌有15个分型,以1型和3型为优势型;鼠伤寒沙门菌有23个分型,具有遗传多样性特征。结论上海市市售肉制品沙门菌暴露以猪肉和鸡肉来源为主,肉制品中多重耐药沙门菌污染严重。猪肉来源的罗森沙门菌和鸡肉来源的吉韦沙门菌是新输入性的血清型。
关键词:
沙门菌; 血清型; 多重耐药; 分子分型; 食源性致病菌; 肉制品; 上海
文章编号:1004-8456(2018)02-0132-07
中图分类号:R155
文献标志码:A
Serotyping, molecular subtyping and drug resistance patterns of Salmonella isolates from retail meat in Shanghai,2016
(Municipal Center for Disease Control and Prevention, Shanghai 200336, China)
Abstract:ObjectiveTo find out the serotype distribution, molecular subtyping and drug resistance patterns of Salmonella isolates from marketed meat products in Shanghai. MethodsA sentinel supermarket or market near an intensive community from each of 16 administrative regions in Shanghai were randomly selected, in which livestock and poultry meat products were collected regularly from January to August in 2016. Salmonella isolation and serotyping, antibiotic susceptibility testing, as well as molecular subtyping were conducted according to the foodborne disease surveillance monitoring program of the China National Center for Food Safety Risk Assessment. ResultsA total of 158 Salmonella strains were isolated from 606 commercially available meat products including pork, chicken, duck, beef, mutton and goose. Total positive rate was 26.1% (158/606), separation rates for livestock and poultry were 52.5% (83/158) and 47.5% (75/158) respectively. Salmonella enteritis, Salmonella typhimurium, Salmonella derby, Salmonella rissen and Salmonella indiana were the top 5 Salmonella serovars for meat products in Shanghai, but serovar type distributions in livestock and poultry were significantly different (P<0.05). Sulfisoxazole had the highest drug resistance rate for 158 Salmonella strains(79.7%,126/158), followed by streptomycin, nalidixic acid, ampicillin, tetracycline and chloramphenicol (38.0%~77.8%). Moreover, 123 strains (77.8%) were multi-drug resistant (MDR) strains. Drug resistance rates of gentamicin, streptomycin, sulfonamides, trimethoprim/sulfamethoxazole, chloramphenicol, tetracycline and ceftiofur, ceftriaxone and nalidixic acid were significant different in Salmonella strains from pigs and chicken(P<0.05). Six antibiotics exceeded the detection limits in almost half of the Salmonella strains. Salmonella enteritis strains had 15 PFGE patterns, in which type 1 and type 3 were predominant clones. Salmonella typhimurium strains had 23 significant different PFGE patterns, which showed genetic polymorphism features. ConclusionSalmonella contamination in retail meat and poultry is the main reason which leads to high Salmonella positive rate in Shanghai, the multidrug-resistant of Salmonella in meat products is serious and must be paid attention to. Salmonella rissen from pigs and Salmonella give from chicken are the newly imported animal originated Salmonella serovars.
Key words:
Salmonella; serovars; multi drug resistance; molecular subtyping; foodborne pathogenic bacteria; meat products; Shanghai
沙门菌是重要的人畜共患病的病原菌之一,可致易感人群出现食源性腹泻,无论是隐匿的分散暴发或典型的点源暴发,都严重威胁着人类健康。美国疾病预防控制中心(CDC)主动监测数据[1]显示,每年约有150万例沙门菌食物中毒病例,疾病负担约26亿美元。近年,沙门菌也逐渐成为我国公共卫生和食品安全领域最常见的食源性致病菌,占年度报告病例数的70%~80%[2]。2016年,本研究在上海市开展针对超市和农贸市场流通生鲜肉制品的全覆盖和连续性监测,旨在了解沙门菌在高危食品中的污染分布、血清型、耐药谱和分子分型特征,准确掌握上海市生鲜肉制品中沙门菌优势型的抗生素耐药与分子流行病学特征,为后续有效针对肉类食品安全的政策干预与精准防控提供科学依据。
缓冲蛋白胨水(BPW)和木糖赖氨酸脱氧胆酸盐(XLD)琼脂平板均购自上海华康生物科技有限公司,沙门菌显色(CAS)琼脂平板和亚硒酸盐煌绿增菌液(SBG)均购自广州迪景微生物技术有限公司,生化鉴定板API20E(法国生物梅里埃),140种沙门菌分型诊断血清(丹麦国家血清研究所),14种抗生素定量检测板(CMV3AGNF,美国赛默飞),限制性内切酶XbaⅠ(日本TAKARA),低熔点琼脂糖。以上试剂和血清等均避光置10 ℃以下保存,有效期内使用。
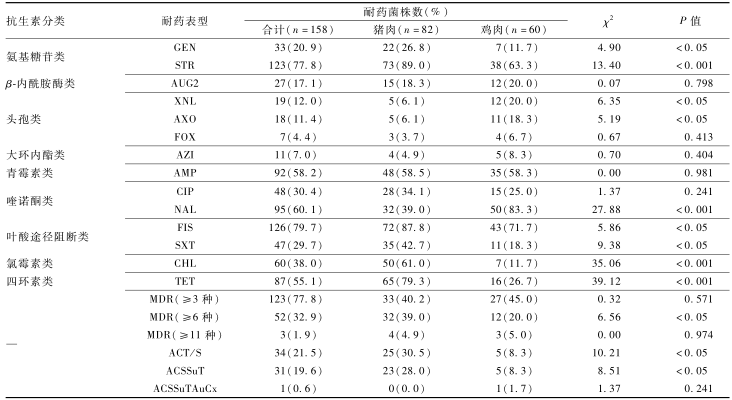
(30.4%,48/158)也明显高于头孢类抗生素(4.4%~12.0%);猪肉来源沙门菌对GEN、STR、FIS、SXT、CHL、TET耐药率均明显高于鸡肉来源沙门菌,差异有统计学意义(P<0.05);鸡肉来源沙门菌对XNL、AXO、NAL的耐药率均明显高于猪肉来源沙门菌,差异有统计学意义(P<0.05);MDR菌株(ACT/S和ACSSuT)统计发现,猪肉来源沙门菌耐药菌株数明显高于鸡肉来源沙门菌,差异有统计学意义(P<0.05),见表2。
沙门菌血清型和食品种类存在关联性[7]。本次监测发现20种血清型,较10年前更具多样性。初步确认上海市猪肉来源和鸡肉来源的优势菌型存在差异,间接提示养殖动物可能存在种群差异,为后续关联感染性腹泻菌型和溯源污染源提供依据。另比较发现,罗森沙门菌(猪肉来源)和吉韦沙门菌(鸡肉来源)属上海市食品新输入的血清型[8]。沙门菌在各地食品和人源腹泻的优势暴露不同,欧盟鸡肉中沙门菌主要血清型是婴儿沙门菌和肠炎沙门菌[9];我国北方鸡肉中高耐药的沙门菌血清型是印第安纳沙门菌[10-13]。汤卜逊沙门菌是我国主要的食物中毒血清型[14-17]。罗森沙门菌是亚洲猪肉中最常见血清型,近20年持续成为泰国食源性优势血清型[18-20]。在我国南方地区,罗森沙门菌也逐渐成为人源沙门菌的优势血清型[21-22]。
养殖业者过度使用兽用抗生素致沙门菌产生高耐药现象已成为全球关注问题。美国NARMS持续20年监测食源性致病菌耐药基线的变迁[23]。本次菌株耐药特征发现,猪肉来源沙门菌对GEN、STR、FIS、STX、CHL、TET及1类整合子相关MDR菌株(ACT/S和ACSSuT)耐药性明显高于鸡肉来源沙门菌,鸡肉来源沙门菌对XNL、AXO和NAL的耐药性明显高于猪肉来源,差异均有统计学意义(P<0.05)。间接反映在不同物种养殖过程中可能存在抗生素的使用差异,而MIC值和抗生素剂量-反应关系证实STR、AMP、NAL、FIS、SXT和CHL等超过检测上限值30%~50%,我国肉制品来源沙门菌耐药基线高于美国[4],本研究为完善设计适宜抗生素工作稀释度提供科学证据。
2014年NARMS[4]报告的XNL(2.4%)、AXO(2.4%)和FOX(2.0%)的耐药率明显低于本研究结果(12.0%、11.4%和4.4%),且前2种抗生素已超过10%的耐药预警线。此外还发现5株ACSSuT菌株同时对3种头孢类抗生素耐药,且均对CIP敏感性降低,其中1株鸡肉来源鼠伤寒沙门菌对AZI耐药,其耐药谱与超级耐药鼠伤寒沙门菌DT104的耐药谱类似[24-25]。有学者[26-27]认为,人源沙门菌对头孢类和CIP耐药归因临床经验用药等诊疗行为。本次肉制品来源沙门菌对CIP(30.4%)和FOX(4.4%)的高耐药率再次证实人和动物源菌株间存在耐药的势能压力,食品安全监管机构需警惕和防控来自动物源耐药株的扩散传播至人群,导致耐药疾病负担的增加,建议国家加强对人和动物使用抗生素的管控。
分子分型为研究沙门菌克隆传播提供遗传证据[2,22]。本研究中沙门菌优势血清型肠炎沙门菌的优势分子型为1型(MDR克隆)和3型(非MDR克隆),两者的遗传特征高度同源,3型亦是上海市人感染肠炎沙门菌的流行分子型[25],提示上海市肠炎沙门菌暴露因素多和鸡肉有关;鼠伤寒沙门菌分子分型显示广泛的生物多样性特征,不同于上海市人源感染鼠伤寒沙门菌病例流行克隆[28],除77型相对优势外,菌株间遗传差异较大,分型结果提示采样前或在超市零售环节已经发生交叉污染的可能性。
本次监测的对象主要针对肉制品的零售环节,在揭示污染证据链上可能存在一定局限性,不能排除养殖和加工过程中污染沙门菌的可能。基于食物链的主动监测需要多个部门的合作与设计,精准追溯到养殖、屠宰、运输和销售等食物链全产业供应环节,建立健全国家食品安全主动监测和预警管理的大数据。
1材料与方法
1.1材料
1.1.1试验菌株
大肠埃希菌(ATCC 25922)和布伦登卢普沙门菌(H9812)作为药敏试验和脉冲场凝胶电泳(PFGE)标准分子量的质控菌株,均购自中国科学院微生物研究所。
1.1.2主要仪器与试剂
抗生素自动分液和读数系统均购自美国赛默飞,PFGE电泳仪(CHEF mapper)和成像系统(GEL Doc2000)均购自美国伯乐,菌液比浊仪(法国生物梅里埃)。缓冲蛋白胨水(BPW)和木糖赖氨酸脱氧胆酸盐(XLD)琼脂平板均购自上海华康生物科技有限公司,沙门菌显色(CAS)琼脂平板和亚硒酸盐煌绿增菌液(SBG)均购自广州迪景微生物技术有限公司,生化鉴定板API20E(法国生物梅里埃),140种沙门菌分型诊断血清(丹麦国家血清研究所),14种抗生素定量检测板(CMV3AGNF,美国赛默飞),限制性内切酶XbaⅠ(日本TAKARA),低熔点琼脂糖。以上试剂和血清等均避光置10 ℃以下保存,有效期内使用。
1.2方法
1.2.1采样及监测
设置覆盖上海市16个行政区的监测点,在各区人群密集居住区域附近挑选1家农贸市场或1家超市;在2016年1~8月间定期定点,随机采集生鲜肉制品共606份,包括猪肉254份、鸡肉235份、鸭肉70份、牛肉42份、羊肉4份、鹅肉1份,所有样品均独立包装低温送至实验室待检。检测流程遵照2016年国家食源性疾病监测网络工作手册[3],称取样品25 g均质后置225 ml BPW中,于36 ℃培养18 h,吸取增菌液1 ml接种SBG培养基后置36 ℃培养18 h,将选择性增菌液分别接种XLD和CAS琼脂平板,置36 ℃培养24 h,挑取3~5个典型菌落进行革兰染色、镜检,选择革兰阴性细菌重新进行纯化,纯化培养物做生化和血清学鉴定,若生化结果和血清型符合沙门菌特征则报告。
1.2.2抗生素定量检测和量程评估
参考美国国家肠道病原菌耐药监测系统(NARMS)2014年更新的9类14种抗生素定量检测板和操作流程(SOP)及最低抑菌浓度(MIC)判读标准[4],14种抗生素包括氨基糖苷类:庆大霉素(GEN)、链霉素(STR),β-内酰胺酶类:阿莫西林-克拉维酸(AUG2),头孢类:头孢西丁(FOX)、头孢曲松(AXO)、头孢噻呋(XNL),大环内酯类:阿奇霉素(AZI),青霉素类:氨苄西林(AMP),喹诺酮类:环丙沙星(CIP)、萘啶酸(NAL),叶酸途径阻断类:磺胺异噁唑(FIS)、复方新诺明(SXT),氯霉素类:氯霉素(CHL),四环素类:四环素(TET)。多重耐药(MDR)菌株为同时耐3类及以上抗生素的菌株,ACT/S为耐AMP-CHL-SXT的菌株,ACSSuT为耐AMP-CHL-STR-SXT-TET的菌株,ACSSuTAuCx为耐AMP-CHL-STR-SXT-TET-AUG2-AXO的菌株。
1.2.3PFGE
挑选优势菌型进行PFGE-Xba I酶切,遵照2016年国家食源性疾病监测网络工作手册[3]中非伤寒沙门菌分子分型,分别进行菌落纯化、制胶、酶切、电泳和图谱成像等,使用BioNumerics(Version 6.0)软件进行聚类分析。
1.3统计学分析
使用卡方检验分析不同源菌株间的耐药差异,以P<0.05为差异有统计学意义;根据受试菌株对每种抗生素浓度梯度的剂量-反应值,评估上海市食源性沙门菌对14种抗生素量程的耐药基线。
2结果
2.1监测结果
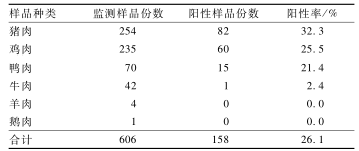
采集6类生鲜肉制品共606份,从158份样品中分离沙门菌158株,总检出率为26.1%,不同种类样品的检出率由高到低依次为猪肉(32.3%,82/254)、鸡肉(25.5%,60/235)和鸭肉(21.4%,15/70),见表1。检出率最低和最高值分别是3月(10.2%,10/98)和6月(39.5%,30/76),5~8月的检出率高于1~4月,提示有典型的峰值升高现象,见图1。
|
表1监测样品数和沙门菌阳性样品数 Table 1Number of samples monitored and the positive number of Salmonella |

|
图1阳性样品时间分布和检出率 Figure 1Sample distribution monthly and positive |
2.2沙门菌血清型分布特征
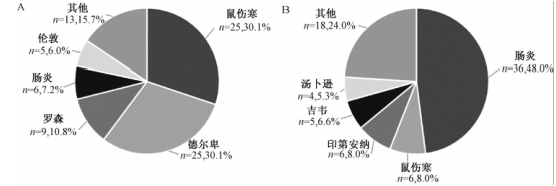
158株沙门菌涵盖20种血清型,前5位血清型依次为肠炎沙门菌(42株)、鼠伤寒沙门菌(31株)、德尔卑沙门菌(25株)、伦敦沙门菌(9株)、印第安纳沙门菌(6株)。来源于畜类肉制品(猪肉和牛肉)的83株沙门菌的优势血清型分别为鼠伤寒沙门菌(25株)、德尔卑沙门菌(25株)、罗森沙门菌(9株),见图2A;来源于禽类肉制品(鸡肉和鸭肉)的75株沙门菌的优势血清型分别为肠炎沙门菌(36株)、鼠伤寒沙门菌(6株)、印第安纳沙门菌(6株),见图2B。
2.3沙门菌耐药表型特征
158株肉制品沙门菌,耐药率超过50%的抗生素依次是FIS(79.7%,126/158)、STR(77.8%,123/158)、NAL(60.1%,95/158)、AMP(58.2%,92/158)、TET(55.1%,87/158),对CIP的耐药率注:A为畜类肉制品中沙门菌优势血清型;B为禽类肉制品中沙门菌优势血清型
|
图2沙门菌优势血清型分布 Figure 2Preponderant Salmonella serovars |
2.4抗生素稀释度与MIC值的剂量-反应关系
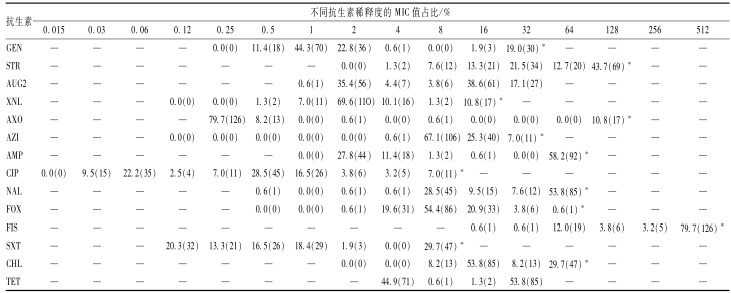
统计158株肉制品沙门菌经商业化抗生素定量检测板的MIC值,结果发现,14种抗生素均有不同程度超过其稀释度量程上限值的情况,接近或超过50%的有STR、AMP、NAL、FIS,SXT和CHL超限率达29.7%,提示国内肉制品中沙门菌对此类抗生素耐药基线值较NARMS高(表3)。
|
表2肉制品沙门菌对14种抗生素耐药的差异化耐药分布 Table 2Differential drug resistance distribution of Salmonella in meat products to 14 antibiotics 注:—表示无分类 |
|
表3158株肉制品沙门菌对14种抗生素MIC值的占比情况 Table 3Proportion of 158 isolated Salmonella from meat to 14 antibiotics’ MIC 注:—表示无此抗生素检测浓度;*表示超出此抗生素最高检测浓度的菌株数;括号中数字为对应菌株数;抗生素稀释度单位为μg/ml |
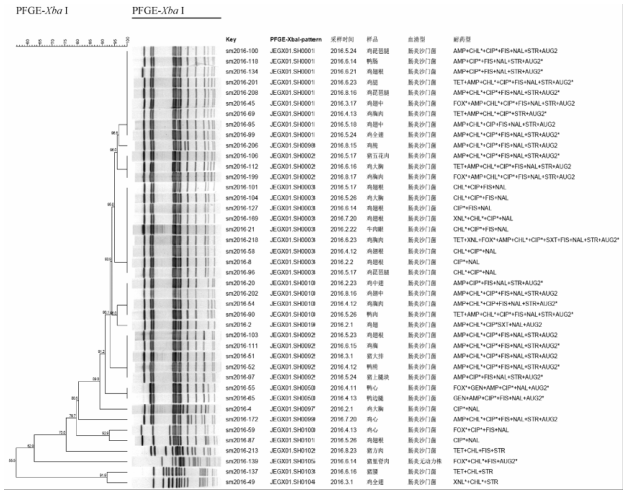
|
图3肠炎沙门菌PFGE聚类分析图谱 Figure 3PFGE cluster analysis atlas of Salmonella enteritidis |
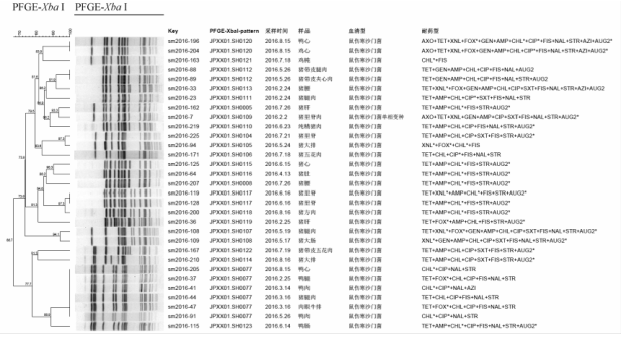
|
图4鼠伤寒沙门菌PFGE聚类分析图谱 Figure 4PFGE cluster analysis atlas of Salmonella typhimurium |
2.5分子分型
肉制品的42株肠炎沙门菌和31株鼠伤寒沙门菌经Xba I酶切,显示42株肠炎沙门菌分为15个带型,1型(9株)和3型(9株)均为优势带型,其次为92型(5株)、10型(4株)、2型(3株)、50型(2株),其他带型均仅有1株,肠炎沙门菌的聚类图提示菌株间有90%的遗传同源性(图3);31株鼠伤寒沙门菌分为23个带型,77型(6株)为优势带型,其次为120型(2株)、112型(2株)、117型(2株),其余带型均仅有1株,而120型、112型和117型均属于同一采样点、同一时间而不同品牌肉制品样品中的3个带型,提示采样前在零售场所存在食品材料之间的交叉污染(图4)。以菌株来源和MDR特征比较肠炎沙门菌和鼠伤寒沙门菌的分子分型差异,发现鼠伤寒沙门菌作为上海市畜类肉制品(主要是猪肉)的优势血清型,其分子遗传多样性和MDR耐药菌指标均高于鸡肉的肠炎沙门菌,而肠炎沙门菌的2个优势带型(1型和3型)之间具有明显不同的耐药性特征(图3)。
3讨论
美 国农业部2015年确认沙门菌位列15种食源性病原菌疾病负担首位。沙门菌在工业化国家的流行特征和发展中国家不同,上海市作为我国特大型城市的代表,开展食物链相关的沙门菌血清型和耐药为主的监测,可以为全球食品原料溯源、预警和风险控制提供重要的基因组遗传关系树[5]。本次研究表明,沙门菌在上海市市售畜肉(27.7%,83/300)和禽肉(24.5%,75/306)分离率高于2010年的报道(生猪肉11.6%,禽肉7.5%)[6],提示食品安全机构应关注持续升高的肉制品污染现象,保障食品供应链安全。沙门菌血清型和食品种类存在关联性[7]。本次监测发现20种血清型,较10年前更具多样性。初步确认上海市猪肉来源和鸡肉来源的优势菌型存在差异,间接提示养殖动物可能存在种群差异,为后续关联感染性腹泻菌型和溯源污染源提供依据。另比较发现,罗森沙门菌(猪肉来源)和吉韦沙门菌(鸡肉来源)属上海市食品新输入的血清型[8]。沙门菌在各地食品和人源腹泻的优势暴露不同,欧盟鸡肉中沙门菌主要血清型是婴儿沙门菌和肠炎沙门菌[9];我国北方鸡肉中高耐药的沙门菌血清型是印第安纳沙门菌[10-13]。汤卜逊沙门菌是我国主要的食物中毒血清型[14-17]。罗森沙门菌是亚洲猪肉中最常见血清型,近20年持续成为泰国食源性优势血清型[18-20]。在我国南方地区,罗森沙门菌也逐渐成为人源沙门菌的优势血清型[21-22]。
养殖业者过度使用兽用抗生素致沙门菌产生高耐药现象已成为全球关注问题。美国NARMS持续20年监测食源性致病菌耐药基线的变迁[23]。本次菌株耐药特征发现,猪肉来源沙门菌对GEN、STR、FIS、STX、CHL、TET及1类整合子相关MDR菌株(ACT/S和ACSSuT)耐药性明显高于鸡肉来源沙门菌,鸡肉来源沙门菌对XNL、AXO和NAL的耐药性明显高于猪肉来源,差异均有统计学意义(P<0.05)。间接反映在不同物种养殖过程中可能存在抗生素的使用差异,而MIC值和抗生素剂量-反应关系证实STR、AMP、NAL、FIS、SXT和CHL等超过检测上限值30%~50%,我国肉制品来源沙门菌耐药基线高于美国[4],本研究为完善设计适宜抗生素工作稀释度提供科学证据。
2014年NARMS[4]报告的XNL(2.4%)、AXO(2.4%)和FOX(2.0%)的耐药率明显低于本研究结果(12.0%、11.4%和4.4%),且前2种抗生素已超过10%的耐药预警线。此外还发现5株ACSSuT菌株同时对3种头孢类抗生素耐药,且均对CIP敏感性降低,其中1株鸡肉来源鼠伤寒沙门菌对AZI耐药,其耐药谱与超级耐药鼠伤寒沙门菌DT104的耐药谱类似[24-25]。有学者[26-27]认为,人源沙门菌对头孢类和CIP耐药归因临床经验用药等诊疗行为。本次肉制品来源沙门菌对CIP(30.4%)和FOX(4.4%)的高耐药率再次证实人和动物源菌株间存在耐药的势能压力,食品安全监管机构需警惕和防控来自动物源耐药株的扩散传播至人群,导致耐药疾病负担的增加,建议国家加强对人和动物使用抗生素的管控。
分子分型为研究沙门菌克隆传播提供遗传证据[2,22]。本研究中沙门菌优势血清型肠炎沙门菌的优势分子型为1型(MDR克隆)和3型(非MDR克隆),两者的遗传特征高度同源,3型亦是上海市人感染肠炎沙门菌的流行分子型[25],提示上海市肠炎沙门菌暴露因素多和鸡肉有关;鼠伤寒沙门菌分子分型显示广泛的生物多样性特征,不同于上海市人源感染鼠伤寒沙门菌病例流行克隆[28],除77型相对优势外,菌株间遗传差异较大,分型结果提示采样前或在超市零售环节已经发生交叉污染的可能性。
本次监测的对象主要针对肉制品的零售环节,在揭示污染证据链上可能存在一定局限性,不能排除养殖和加工过程中污染沙门菌的可能。基于食物链的主动监测需要多个部门的合作与设计,精准追溯到养殖、屠宰、运输和销售等食物链全产业供应环节,建立健全国家食品安全主动监测和预警管理的大数据。
参考文献
[1]MINOR T, LASHER A, KLONTZ K C, et al. The per case and total annual costs of foodborne illness in the United States[J]. Risk Analysis, 2015, 35(6):1125-1139.
[2]张代涛, 阚飙.沙门菌属分子分型技术研究进展[J].中国人畜共患病学报,2009,25(5):465-468.
[3]2016年国家食品污染物和有害因素风险监测工作手册(内部资料)[Z].国家食品安全风险评估中心,2016.
[4]CDC. National antimicrobial resistance monitoring system-enteric bacteria (NARMS): human isolates final report, 2014[R]. Atlanta, Georgia: U.S. Department of Health and Human Services, CDC, 2016.
[5]周玫, 罗铭, 陈峰, 等. 源于东南亚的韦太夫雷登沙门菌在全球的传播扩散[J].疾病监测,2016,31(1):73-81.
[6]郑雷军, 王颖, 彭少杰,等. 2010年上海市市售食品中食源性致病菌监测结果分析[J]. 中国食品卫生杂志, 2012, 24(3):264-267.
[7]JACKSON B R, GRIFFIN P M, COLE D, et al. Outbreak-associated Salmonella enterica serotypes and food commodities, United States, 1998-2008 [J]. Emerging Infectious Diseases, 2013, 19(8):1239-1244.
[8]许学斌, 顾宝柯, 金汇明,等. 免疫磁珠法检测食品中的沙门菌及分离菌株的耐药性[J]. 中国食品卫生杂志, 2006, 18(3):202-204.
[9]European Food Safety Authority.Report of the task force on zoonoses data collection on the analysis of the baseline survey on the prevalence of Salmonella in broiler flocks of gallusgallus,in the EU,2005-2006.Part A: Salmonella prevalence estimates[J].The EFSA Journal,2007,98:1-85.
[10]李薇薇,白莉,张秀丽,等.中国四省肉鸡生产加工环节沙门菌的污染及耐药谱分布状况[J].中华预防医学杂志,2013,47(5):435-438.
[11]朱丹丹, 遇晓杰, 薛成玉,等. 黑龙江省肉鸡养殖和屠宰加工环节中沙门菌调查[J]. 中国食品卫生杂志, 2016, 28(4):485-488.
[12]张华宁, 陈玉贞, 侯配斌, 等. 2012年山东省肉鸡生产加工环节沙门菌污染水平及耐药分析[J]. 卫生研究, 2014, 43(6):933-938.
[13]任行星. 广东省动物源沙门菌流行特点及HRM检测鸡白痢和鸡伤寒沙门菌方法的建立[D]. 广州:华南农业大学, 2016.
[14]顾宝柯, 袁政安, 金汇明, 等. 上海市沙门菌病流行特征分析[J]. 环境与职业医学,2008, 25(3):245-247.
[15]张冬民, 毛斐, 赵茜. 汤卜逊沙门菌引起的食物中毒的检验报告[J]. 中国卫生检验杂志,2012,22(10):2443,2448.
[16]邓陈哲, 邓瑶, 甫祝云. 沙门菌及志贺菌混合感染引起食源性疾病暴发疫情的调查[J]. 中国热带医学, 2016, 16(9):940-942.
[17]许学斌, 崔玲, 王红霞, 等. 上海市C群沙门菌暴发菌株鉴别诊断研究[J]. 中国卫生检验杂志, 2010,20(12):3077-3080.
[18]BANGTRAKULNONTH A,PORNREONGWONG S,PULSRIKARN C,et al.Salmonella serovars from humans and other sources in Thailand,1993-2002[J].Emerg Infect Dis,2004,10(1):131-136.
[19]ANGKITITRAKUL S, CHOMVARIN C, CHAITA T, et al. Epidemiology of antimicrobial resistance in Salmonella isolated from pork, chicken meat and humans in Thailand[J]. Southeast Asian Journal of Tropical Medicine & Public Health, 2005, 36(6):1510-1515.
[20]KUMAR Y, SHARMA A, SEHGAL R, et al. Distribution trends of Salmonella serovars in India (2001-2005)[J]. Transactions of the Royal Society of Tropical Medicine & Hygiene, 2009, 103(4):390-394.
[21]LIANG Z M, KE B X, DENG X L, et al. Serotypes, seasonal trends, and antibiotic resistance of non-typhoidal Salmonella from human patients in Guangdong Province, China, 2009-2012[J]. BMC Infectious Diseases, 2015, 15(1):53.
[22]许学斌, 顾宝柯, 金汇明,等. 上海市沙门菌血清型流行特征[J]. 中国人兽共患病学报, 2009, 25(2):156-158.
[23]Centers for Disease Control and Prevention. National antimicrobial resistance monitoring system for enteric bacteria (NARMS)[EB/OL].(2013-04-02)[2017-10-10].http://www.cdc.gov/narms.
[24]LEEKITCHAROENPHON P, HENDRIKSEN R S, HELLO S L, et al. Global genomic epidemiology of Salmonella enterica serovar typhimurium DT104[J]. Applied & Environmental Microbiology, 2016, 82(8):2516-2526.
[25]许学斌, 袁政安, 金汇明,等. 上海市肠炎沙门氏菌流行特征和分子分型研究[J].上海预防医学, 2009, 21(4):149-152.
[26]ZHANG J M, WANG F, JIN H M, et al. Laboratory monitoring of bacterial gastroenteric pathogens Salmonella and Shigella in Shanghai, China 2006-2012[J]. Epidemiol Infect, 2015, 143(3):478-485. DOI:10.1017/S0950268814001162.
[27]LI Y F, XIE X B, XU X B, et al. Nontyphoidal Salmonella infection in children with acute gastroenteritis:prevalence, serotypes, and antimicrobial resistance in Shanghai, China [J].Foodborne Pathogens and Disease, 2013,11(3):200-206. DOI: 10.1089/fpd.2013.1629.
[28]许学斌, 金汇明, 肖文佳,等. 上海市鼠伤寒沙门菌流行特征及分子分型研究[J].上海预防医学, 2010, 22(2):57-61.
[2]张代涛, 阚飙.沙门菌属分子分型技术研究进展[J].中国人畜共患病学报,2009,25(5):465-468.
[3]2016年国家食品污染物和有害因素风险监测工作手册(内部资料)[Z].国家食品安全风险评估中心,2016.
[4]CDC. National antimicrobial resistance monitoring system-enteric bacteria (NARMS): human isolates final report, 2014[R]. Atlanta, Georgia: U.S. Department of Health and Human Services, CDC, 2016.
[5]周玫, 罗铭, 陈峰, 等. 源于东南亚的韦太夫雷登沙门菌在全球的传播扩散[J].疾病监测,2016,31(1):73-81.
[6]郑雷军, 王颖, 彭少杰,等. 2010年上海市市售食品中食源性致病菌监测结果分析[J]. 中国食品卫生杂志, 2012, 24(3):264-267.
[7]JACKSON B R, GRIFFIN P M, COLE D, et al. Outbreak-associated Salmonella enterica serotypes and food commodities, United States, 1998-2008 [J]. Emerging Infectious Diseases, 2013, 19(8):1239-1244.
[8]许学斌, 顾宝柯, 金汇明,等. 免疫磁珠法检测食品中的沙门菌及分离菌株的耐药性[J]. 中国食品卫生杂志, 2006, 18(3):202-204.
[9]European Food Safety Authority.Report of the task force on zoonoses data collection on the analysis of the baseline survey on the prevalence of Salmonella in broiler flocks of gallusgallus,in the EU,2005-2006.Part A: Salmonella prevalence estimates[J].The EFSA Journal,2007,98:1-85.
[10]李薇薇,白莉,张秀丽,等.中国四省肉鸡生产加工环节沙门菌的污染及耐药谱分布状况[J].中华预防医学杂志,2013,47(5):435-438.
[11]朱丹丹, 遇晓杰, 薛成玉,等. 黑龙江省肉鸡养殖和屠宰加工环节中沙门菌调查[J]. 中国食品卫生杂志, 2016, 28(4):485-488.
[12]张华宁, 陈玉贞, 侯配斌, 等. 2012年山东省肉鸡生产加工环节沙门菌污染水平及耐药分析[J]. 卫生研究, 2014, 43(6):933-938.
[13]任行星. 广东省动物源沙门菌流行特点及HRM检测鸡白痢和鸡伤寒沙门菌方法的建立[D]. 广州:华南农业大学, 2016.
[14]顾宝柯, 袁政安, 金汇明, 等. 上海市沙门菌病流行特征分析[J]. 环境与职业医学,2008, 25(3):245-247.
[15]张冬民, 毛斐, 赵茜. 汤卜逊沙门菌引起的食物中毒的检验报告[J]. 中国卫生检验杂志,2012,22(10):2443,2448.
[16]邓陈哲, 邓瑶, 甫祝云. 沙门菌及志贺菌混合感染引起食源性疾病暴发疫情的调查[J]. 中国热带医学, 2016, 16(9):940-942.
[17]许学斌, 崔玲, 王红霞, 等. 上海市C群沙门菌暴发菌株鉴别诊断研究[J]. 中国卫生检验杂志, 2010,20(12):3077-3080.
[18]BANGTRAKULNONTH A,PORNREONGWONG S,PULSRIKARN C,et al.Salmonella serovars from humans and other sources in Thailand,1993-2002[J].Emerg Infect Dis,2004,10(1):131-136.
[19]ANGKITITRAKUL S, CHOMVARIN C, CHAITA T, et al. Epidemiology of antimicrobial resistance in Salmonella isolated from pork, chicken meat and humans in Thailand[J]. Southeast Asian Journal of Tropical Medicine & Public Health, 2005, 36(6):1510-1515.
[20]KUMAR Y, SHARMA A, SEHGAL R, et al. Distribution trends of Salmonella serovars in India (2001-2005)[J]. Transactions of the Royal Society of Tropical Medicine & Hygiene, 2009, 103(4):390-394.
[21]LIANG Z M, KE B X, DENG X L, et al. Serotypes, seasonal trends, and antibiotic resistance of non-typhoidal Salmonella from human patients in Guangdong Province, China, 2009-2012[J]. BMC Infectious Diseases, 2015, 15(1):53.
[22]许学斌, 顾宝柯, 金汇明,等. 上海市沙门菌血清型流行特征[J]. 中国人兽共患病学报, 2009, 25(2):156-158.
[23]Centers for Disease Control and Prevention. National antimicrobial resistance monitoring system for enteric bacteria (NARMS)[EB/OL].(2013-04-02)[2017-10-10].http://www.cdc.gov/narms.
[24]LEEKITCHAROENPHON P, HENDRIKSEN R S, HELLO S L, et al. Global genomic epidemiology of Salmonella enterica serovar typhimurium DT104[J]. Applied & Environmental Microbiology, 2016, 82(8):2516-2526.
[25]许学斌, 袁政安, 金汇明,等. 上海市肠炎沙门氏菌流行特征和分子分型研究[J].上海预防医学, 2009, 21(4):149-152.
[26]ZHANG J M, WANG F, JIN H M, et al. Laboratory monitoring of bacterial gastroenteric pathogens Salmonella and Shigella in Shanghai, China 2006-2012[J]. Epidemiol Infect, 2015, 143(3):478-485. DOI:10.1017/S0950268814001162.
[27]LI Y F, XIE X B, XU X B, et al. Nontyphoidal Salmonella infection in children with acute gastroenteritis:prevalence, serotypes, and antimicrobial resistance in Shanghai, China [J].Foodborne Pathogens and Disease, 2013,11(3):200-206. DOI: 10.1089/fpd.2013.1629.
[28]许学斌, 金汇明, 肖文佳,等. 上海市鼠伤寒沙门菌流行特征及分子分型研究[J].上海预防医学, 2010, 22(2):57-61.
 刘玥,顾其芳,刘诚,朱颖莹,刘弘,陈敏,许学斌,张红芝.2016年上海市市售肉制品中沙门菌耐药谱与分型研究[J].中国食品卫生杂志,2018,30(2):132-138.
刘玥,顾其芳,刘诚,朱颖莹,刘弘,陈敏,许学斌,张红芝.2016年上海市市售肉制品中沙门菌耐药谱与分型研究[J].中国食品卫生杂志,2018,30(2):132-138.