DOi:10.13590/j.cjfh.2018.02.008
国内外法规对水解乳蛋白在婴幼儿配方食品中使用的规定
(国家食品药品监督管理总局保健食品审评中心,北京100070)
收稿日期:2018-02-26
作者简介:王星女主管药师研究方向为特殊医学用途配方食品E-mail:ymwangxing@163.com
基金项目:
摘要:目的整理分析国内外对水解乳蛋白在婴幼儿配方食品中的应用规定及研究文献,为该类产品的研发、使用和监管提供参考。方法系统整理国内外水解乳蛋白在婴幼儿配方食品中使用的相关研究、法律法规和临床应用,并结合我国现状进行讨论分析。结果通过整理比较,我国相关法规及标准明确了水解乳蛋白在特殊医学用途婴儿配方食品中使用的技术要求;国际法典委员会和欧盟也对水解乳蛋白在婴儿配方食品中的使用有相应规定;美国虽未出台具体法规,但有大量的权威文献及科学研究资料;中国台湾地区食品标准对水解乳蛋白的使用要求与国际法典委员会一致;澳大利亚/新西兰、日本等国家和地区暂未查询到相关规定。结论我国应当借鉴国际先进经验,加强水解乳蛋白的基础性研究和临床研究,不断完善相关标准、法规和技术要求,促进并规范水解乳蛋白在婴幼儿配方食品中的应用。
关键词:
水解乳蛋白; 婴幼儿配方食品; 特殊医学用途配方食品; 致敏蛋白; 食品安全; 标准; 法规
文章编号:1004-8456(2018)02-0164-05
中图分类号:R155
文献标志码:A
Overview of domestic and foreign standards and regulations for hydrolyzed milk proteins used in infant formula food
(Center for Health Food Evaluation, China Food and Drug Administration, Beijing 100070, China)
Abstract:ObjectiveThis paper reviewed the studies on hydrolyzed milk proteins used in infant formula food, and provides suggestions for research and development, supervision and clinical application of hydrolysate formulas. Methods
Requirements in laws and regulations, clinical trial studies and related researches for hydrolyzed milk proteins and hydrolysate formulas were collected and analyzed. ResultsRegulations and standards for hydrolyzed milk proteins used in formula food for special medical purposes had been released in China; Codex Alimentarius Commission (CAC) and European Union also had regulations and standards for hydrolyzed milk proteins used in infant formula; The US had a large number of literatures and studies for hypoallergenic infant formulas. The requirements of China Taiwan were in accordance with CAC. The relevant regulations of Australia, New Zealand, Japan and other countries and regions had not been found. ConclusionScientific institutions should pay attention to the basic research of hydrolyzed milk proteins and hydrolysate formulas. Administration department should improve the standards and regulations.
Key words:
Hydrolyzed milk proteins ; infant formula food; formula food for special medical purposes; protein allergy; food safety; standards; regulations
婴幼儿是食物过敏反应患病率较高的群体,由于其内源性基因调控和免疫系统未发育完全,往往会出现皮肤、消化道等部位的过敏症状, 乳蛋白便是其中主要的致敏成分之一。婴幼儿过敏性疾病食物方面的一级预防策略包括母乳喂养、应用水解乳蛋白和添加益生菌等[1-2]。鉴于水解乳蛋白在婴幼儿配方食品中使用的必要性及重要性,本研究将对水解乳蛋白配方的应用、分类和影响其性质的主要因素进行介绍,并对国内外相关法规进行整理和分析,希望为该类产品的研发、使用和监管提供一定的参考。
2016年3月,国家食品药品监督管理总局正式发布《特殊医学用途配方食品注册管理办法》[12],规定特殊医学用途配方食品包括适用于0~12月龄的特殊医学用途婴儿配方食品和适用于1岁以上人群的特殊医学用途配方食品,其中乳蛋白部分水解配方食品和乳蛋白深度水解配方食品或者氨基酸配方食品也在注册管理范围内。
通过比较可以看出,不同蛋白来源的婴儿配方产品中,蛋白指标值的要求基本一致,大豆分离
蛋白配方的最小值指标略高,牛奶或羊奶蛋白的最大值指标略低,主要是由于各种蛋白来源在体内生物利用度等指标的不同;不同蛋白来源较大婴儿配方产品的蛋白指标要求与婴儿配方产品完全一致。
(1)蛋白的来源。经凝乳酶沉淀牛乳中的酪蛋白后提取的脱盐甜乳清蛋白由以下部分组成:63%的无酪蛋白糖巨肽乳清蛋白(分离自干物质蛋白含量不低于95%、变性蛋白质小于70%、灰分不超过3%的牛乳);37%的甜乳清蛋白(浓缩自干物质蛋白含量不少于87%、变性蛋白质小于70%、灰分不超过3.5%的牛乳)。
(2)蛋白的生产工艺。采用胰蛋白酶两步水解工艺,并在两步水解中进行热处理(80~100 ℃加热3~10 min)。
美国儿科学会营养委员会认为新的低变应原配方进行婴儿人体试验前,必须进行毒性和正氮平衡适用性的临床前综合评价,并预测牛奶蛋白过敏婴儿是否会对配方不耐受,试验应当包括未水解肽的分子量确定、免疫学可识别物质数量的确定以及产品的动物模型致敏反应。临床试验应当在对牛奶或牛奶配方过敏的婴儿中进行,并通过适当的消除试验证实[20],且在双盲、安慰剂控制法下,至少具有95%的把握对90%已证实的牛奶过敏婴儿不会产生配方所定义的症状,并建议在双盲试验成功开展后,再通过7天的开放性过敏症状客观评分系统证实临床试验结果,用于监测配方的迟发性反应[21]。
美国儿科学会营养委员会推荐深度水解蛋白配方用于治疗和预防婴儿的过敏性疾病。经研究证实[3,22],深度水解蛋白配方和游离氨基酸配方具有低变应原性,而部分牛奶蛋白水解配方在牛奶蛋白过敏的婴儿中引起明显反应的概率较大。低变应原配方用于过敏高风险婴儿时,应当在可控的、随机的条件下单独喂养至少6个月,并继续观察至少12个月。声称预防或延迟过敏配方应当在观察期结束时,与标准牛奶配方相比具有普遍降低过敏反应的统计学显著性[21]。美国食品药品监督管理局(FDA)对于使用100%部分水解乳蛋白的婴儿配方食品,规定其有条件的健康声称应当措辞适当和对特定用途部分文字加粗等[21,23]。
(1)大部分国家具有相应的法规或标准。中国于2010年出台了相应的食品安全国家标准,并自2016年起按照特殊医学用途配方食品的注册制度进行管理;国际法典委员会关于婴儿配方食品和特殊医学用途婴儿配方食品的标准中对水解乳蛋白配方的蛋白做出了要求,中国台湾对该项内容的要求与国际法典委员会一致;欧盟在2006年首次授权了水解乳蛋白在婴幼儿配方食品中的使用,并不断完善相关规定;美国、澳大利亚/新西兰、日本,中国香港目前暂未查询到针对水解乳蛋白或其配方产品的具体法规。
(2)法规的适用范围略有不同。中国明确规定了水解乳蛋白在特殊医学用途婴儿配方食品中的使用要求;国际法典委员会的婴儿配方食品和特殊医学用途婴儿配方食品为同一标准;欧盟相关法规的适用范围为婴儿和较大婴儿配方食品。
(3)技术要求侧重点不同。中国规定了蛋白质指标范围、适用的医学状况和配方的主要技术要求;国际法典委员会及中国台湾要求配方中的蛋白含量应当在1.8~3.0 g/100 kcal,非水解乳蛋白婴儿配方的蛋白质含量小于2 g/100 kcal时,水解蛋白婴儿配方的蛋白质含量小于2.25 g/100 kcal时,应当进行临床评价;欧盟对蛋白的指标范围、来源及工艺、添加氨基酸的要求等都做出了详细规定,是目前针对水解乳蛋白原料及配方最为全面、细致的标准;美国目前针对水解乳蛋白原料及配方还没有相关法规,但针对配方的研发、标签标识、临床试验等已有大量的科学文献和官方指导意见,具有多年的使用历史。
一是加强水解乳蛋白配方的基础性研究。国外己将开发低敏性营养食品配方列为研究重点,与欧美国家比较,国内相关资料及研究报道较少,建议国内企业及科研单位等加强水解乳蛋白的工艺开发及优化、性质测定等方面的探索和基础性研究,为此类产品的安全性、营养性和有效性提供科学依据。
二是加强水解乳蛋白配方的临床研究。一个产品能否用于治疗或预防食物蛋白过敏仍需通过适当的临床试验决定,包括皮肤点刺试验、斑贴试验和激发试验等[1,21,25]。目前水解乳蛋白婴幼儿配方食品在我国临床研究严重不足,多依赖于西方国家的研究资料,缺乏针对我国婴幼儿牛奶蛋白过敏原的研究,需要医疗机构、政府部门、科研单位以及消费者的积极配合,不断积累数据、促进产业发展。并在加强国际交流的同时,积极与亚洲国家沟通合作,共同积累水解乳蛋白配方在亚裔婴幼儿人群使用的研究数据,为国际相关法规及标准的制定提供参考。
三是完善相关标准、法规和技术要求。近年来相关部门对使用水解乳蛋白的特殊医学用途婴儿配方食品出台了系列标准及法规,但针对水解乳蛋白原料的标准和规定还有待完善,涉及配方、工艺和质量标准等方面的技术要求有待细化。
1水解乳蛋白定义及影响其性质的主要因素
1.1水解乳蛋白配方的应用及分类
水解乳蛋白是通过化学和酶水解降低牛奶蛋白的分子量和肽链长度,减低或消除牛奶蛋白的变应原性,继而减少蛋白致敏的可能性[1,3-4]。水解蛋白配方(protein hydrolysate formulas)根据蛋白水解度分为部分水解蛋白配方(partially hydrolyzed formula,PHF)和深度水解蛋白配方(extensively hydrolyzed formula,EHF)两类。部分水解蛋白配方通常推荐用于对牛奶蛋白过敏高风险婴儿的初级干预,以及使用深度水解蛋白配方的后续治疗,以期诱导耐受[3,5];深度水解蛋白配方中的蛋白质经深度水解生成游离氨基酸、二肽、三肽和短肽的混合物,大部分氮以游离氨基酸和分子量小于1 500 kDa肽的形式存在,用于严重性肠炎和对牛奶蛋白过敏的婴儿已超过50年[6]。
1.2影响水解乳蛋白性质的主要因素
影响水解乳蛋白配方预防过敏的因素主要包括蛋白来源(如牛奶酪蛋白、牛奶乳清蛋白或两者联合使用等)、水解方法(如水解酶的种类、温度、pH值等)及水解度[7]。水解乳蛋白的生产工艺一般是先对不同来源的蛋白进行酶切水解,然后进一步对酶切后的组分进行加热处理和(或)超滤[1],不同水解酶作用后形成的肽段、氨基酸数量及种类均有差异,从而对婴儿胃肠道吸收率产生不同的影响[8]。酶解蛋白带来的功能性改善或释放出的生理活性肽都与蛋白质的水解程度有很大关系,目前国内外常用的蛋白水解度测定的方法有pH-stat法、邻苯二甲醛(OPA)法、三硝基苯磺酸(TNBS)法、水合茚三酮法及甲醛滴定法等[8-9]。
2国内外针对水解乳蛋白配方的相关法规及科学研究
2.1中国
为满足特殊医学状况婴儿的营养需求,指导和规范我国婴幼儿配方食品的生产经营,国家卫生和计划生育委员会制定了GB 25596—2010《食品安全国家标准 特殊医学用途婴儿配方食品通则》[10]。该标准规定了蛋白质含量需控制在0.45~0.70 g/100 kJ(1.88~2.93 g/100 kcal),并在附录A《常见特殊医学用途婴儿配方食品》中列举了6类常见配方,其中包括了乳蛋白部分水解配方和乳蛋白深度水解配方或氨基酸配方(见表1)[10-11]。 |
|
表1GB 25596—2010附录A相关内容 Table 1Requirements of standards of food for special medical purpose for infant formula GB 25596-2010 |
2.2国际法典委员会(CAC)
国际法典委员会在关于婴儿配方食品和特殊婴儿配方食品的标准Codex Stan 72—1981 (Revision 2007)[13]中规定:蛋白质的含量应当在1.8~3.0 g/100 kcal,非水解乳蛋白婴儿配方的蛋白质含量小于2 g/100 kcal时,水解蛋白婴儿配方的蛋白质含量小于2.25 g/100 kcal时,应当进行临床评价。
2.3欧盟
2.3.1欧盟相关法规的基本情况
欧盟委员会法规(EC) No 1609/2006授权了水解乳蛋白在上市婴儿配方中的使用,且应当符合其附录中蛋白来源、生产工艺和质量的相关规定,同时发布了使用水解乳蛋白婴儿配方科学性和营养适用性(2005)的科学建议[14-15]。该规定两年期满后,涉及蛋白质用量的规定通过欧盟委员会法规(EC) No 1243/2008合并至欧盟委员会指令2006/141/EC中[16]。欧盟委员会指令2013/46/EU又将该项指令扩充至使用水解牛奶蛋白的较大婴儿配方[17]。欧盟委员会授权法案(EU) 2016/127于2015年9月通过,婴儿和较大婴儿配方组成和标签标识的要求将代替现行规定2006/141/EC[18-19]。
2.3.2(EU) 2016/127对水解乳蛋白配方的相关规定[19]
欧盟委员会授权法案(EU) 2016/127将在2020年正式实施,该法案整合了涉及婴儿及较大婴儿的系列规定,并对部分指标进行了调整,涉及水解乳蛋白的具体规定如下:
2.3.2.1 蛋白指标值的规定
该法案附录1及附录2分别对使用牛奶或羊奶、大豆分离蛋白、水解乳蛋白的婴儿配方产品和较大婴儿配方产品中的蛋白指标值进行了规定(表2)。通过比较可以看出,不同蛋白来源的婴儿配方产品中,蛋白指标值的要求基本一致,大豆分离
|
|
表2(EU) 2016/127关于婴儿配方和较大婴儿配方蛋白指标值的规定 Table 2Requirements for protein content of Commission Delegated Regulation (EU) 2016/127 |
2.3.2.2蛋白来源及生产工艺
该法案附录1和附录2对使用水解乳蛋白的婴儿和较大婴儿配方中蛋白的来源和生产工艺进行了一致的规定:(1)蛋白的来源。经凝乳酶沉淀牛乳中的酪蛋白后提取的脱盐甜乳清蛋白由以下部分组成:63%的无酪蛋白糖巨肽乳清蛋白(分离自干物质蛋白含量不低于95%、变性蛋白质小于70%、灰分不超过3%的牛乳);37%的甜乳清蛋白(浓缩自干物质蛋白含量不少于87%、变性蛋白质小于70%、灰分不超过3.5%的牛乳)。
(2)蛋白的生产工艺。采用胰蛋白酶两步水解工艺,并在两步水解中进行热处理(80~100 ℃加热3~10 min)。
2.3.2.3添加氨基酸的规定
为保证能量平衡,水解乳蛋白婴儿和较大婴儿配方必须包括一定数量的必需和条件必需氨基酸,其含量至少应当与该法案附录3《母乳中必需和条件必需氨基酸》第二部分“水解蛋白婴儿和较大婴儿配方”的参考值一致。其中,水解蛋白婴儿配方还规定了L-左旋肉碱的含量至少应当等于0.3 mg/100 kJ(1.2 mg/100 kcal)。
2.4美国
美国儿科学会营养委员会于2000年发布的关于低变应原婴儿配方的文章中介绍了水解乳蛋白配方的研发、标签标识、临床试验、预防等内容[6]。美国儿科学会营养委员会认为新的低变应原配方进行婴儿人体试验前,必须进行毒性和正氮平衡适用性的临床前综合评价,并预测牛奶蛋白过敏婴儿是否会对配方不耐受,试验应当包括未水解肽的分子量确定、免疫学可识别物质数量的确定以及产品的动物模型致敏反应。临床试验应当在对牛奶或牛奶配方过敏的婴儿中进行,并通过适当的消除试验证实[20],且在双盲、安慰剂控制法下,至少具有95%的把握对90%已证实的牛奶过敏婴儿不会产生配方所定义的症状,并建议在双盲试验成功开展后,再通过7天的开放性过敏症状客观评分系统证实临床试验结果,用于监测配方的迟发性反应[21]。
美国儿科学会营养委员会推荐深度水解蛋白配方用于治疗和预防婴儿的过敏性疾病。经研究证实[3,22],深度水解蛋白配方和游离氨基酸配方具有低变应原性,而部分牛奶蛋白水解配方在牛奶蛋白过敏的婴儿中引起明显反应的概率较大。低变应原配方用于过敏高风险婴儿时,应当在可控的、随机的条件下单独喂养至少6个月,并继续观察至少12个月。声称预防或延迟过敏配方应当在观察期结束时,与标准牛奶配方相比具有普遍降低过敏反应的统计学显著性[21]。美国食品药品监督管理局(FDA)对于使用100%部分水解乳蛋白的婴儿配方食品,规定其有条件的健康声称应当措辞适当和对特定用途部分文字加粗等[21,23]。
2.5其他国家
澳大利亚/新西兰、日本,中国香港等国家和地区均针对婴幼儿配方食品出台了相应法规,但暂未查询到针对水解乳蛋白使用的具体规定,仅中国台湾食品标准CNS 6849 N5174《婴儿配方食品》中规定了婴儿配方食品中蛋白的含量应当在1.8~3.0 g/100 kcal,非水解乳蛋白含量低于2 g/100 kcal,水解乳蛋白含量低于2.25 g/100 kcal时,应经临床试验证明[23-24]。
2.6国内外相关规定的比较分析
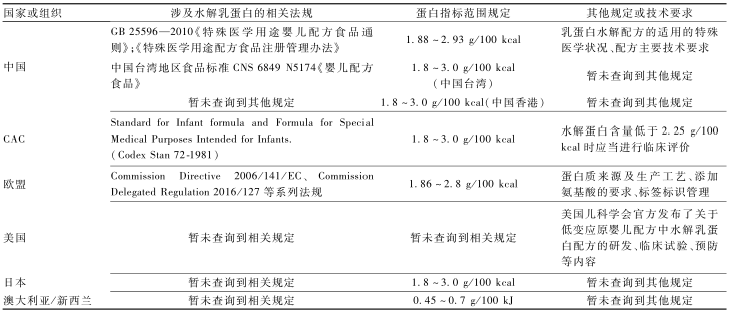
对国内外相关规定的比较总结见表3。通过比较可知,不同国家或组织对水解乳蛋白的使用和管理在以下3方面存在异同点:(1)大部分国家具有相应的法规或标准。中国于2010年出台了相应的食品安全国家标准,并自2016年起按照特殊医学用途配方食品的注册制度进行管理;国际法典委员会关于婴儿配方食品和特殊医学用途婴儿配方食品的标准中对水解乳蛋白配方的蛋白做出了要求,中国台湾对该项内容的要求与国际法典委员会一致;欧盟在2006年首次授权了水解乳蛋白在婴幼儿配方食品中的使用,并不断完善相关规定;美国、澳大利亚/新西兰、日本,中国香港目前暂未查询到针对水解乳蛋白或其配方产品的具体法规。
(2)法规的适用范围略有不同。中国明确规定了水解乳蛋白在特殊医学用途婴儿配方食品中的使用要求;国际法典委员会的婴儿配方食品和特殊医学用途婴儿配方食品为同一标准;欧盟相关法规的适用范围为婴儿和较大婴儿配方食品。
(3)技术要求侧重点不同。中国规定了蛋白质指标范围、适用的医学状况和配方的主要技术要求;国际法典委员会及中国台湾要求配方中的蛋白含量应当在1.8~3.0 g/100 kcal,非水解乳蛋白婴儿配方的蛋白质含量小于2 g/100 kcal时,水解蛋白婴儿配方的蛋白质含量小于2.25 g/100 kcal时,应当进行临床评价;欧盟对蛋白的指标范围、来源及工艺、添加氨基酸的要求等都做出了详细规定,是目前针对水解乳蛋白原料及配方最为全面、细致的标准;美国目前针对水解乳蛋白原料及配方还没有相关法规,但针对配方的研发、标签标识、临床试验等已有大量的科学文献和官方指导意见,具有多年的使用历史。
|
表3国内外关于水解乳蛋白的规定 Table 3Domestic and foreign standards and regulations for hydrolyzed milk proteins used |
3讨论
婴幼儿是最脆弱的人群,建议从以下3个方面加强我国使用水解乳蛋白婴幼儿配方食品的相关工作:一是加强水解乳蛋白配方的基础性研究。国外己将开发低敏性营养食品配方列为研究重点,与欧美国家比较,国内相关资料及研究报道较少,建议国内企业及科研单位等加强水解乳蛋白的工艺开发及优化、性质测定等方面的探索和基础性研究,为此类产品的安全性、营养性和有效性提供科学依据。
二是加强水解乳蛋白配方的临床研究。一个产品能否用于治疗或预防食物蛋白过敏仍需通过适当的临床试验决定,包括皮肤点刺试验、斑贴试验和激发试验等[1,21,25]。目前水解乳蛋白婴幼儿配方食品在我国临床研究严重不足,多依赖于西方国家的研究资料,缺乏针对我国婴幼儿牛奶蛋白过敏原的研究,需要医疗机构、政府部门、科研单位以及消费者的积极配合,不断积累数据、促进产业发展。并在加强国际交流的同时,积极与亚洲国家沟通合作,共同积累水解乳蛋白配方在亚裔婴幼儿人群使用的研究数据,为国际相关法规及标准的制定提供参考。
三是完善相关标准、法规和技术要求。近年来相关部门对使用水解乳蛋白的特殊医学用途婴儿配方食品出台了系列标准及法规,但针对水解乳蛋白原料的标准和规定还有待完善,涉及配方、工艺和质量标准等方面的技术要求有待细化。
参考文献
[1]向莉. 水解蛋白婴儿配方研究进展[J]. 临床儿科杂志,2009,27(8):794-797.
[2]HILL D J, FIRER M A, SHELTON M J, et al. Manifestations of milk allergy in infancy: clinical and immunologic findings [J].J Pediatr, 1986, 109(2):270-276.
[3]ALEXANDER D D, CABANA M D. Partially hydrolyzed 100% whey protein infant formula and reduced risk of atopic dermatitis: a meta-analysis [J]. Hepatology and Nutrition, 2010, 50 (4): 422-430.
[4]HAYS T, WOOD R A. A systematic review of the role of hydrolyzed infant formulas in allergy prevention [J]. Arch Pediatr Adolesc Med, 2005, 159(9):810-816.
[5]齐晓彦,苏米亚,刘翠平,等. 水解配方乳粉的抗过敏性研究进展及其市场开发应用[J]. 食品工业,2015,36(9):247-251.
[6]American Academy of Pediatrics Committee on Nutrition. Hypoallergenic infant formulas [J]. Pediatrics, 2000,106 (2):346-349.
[7]OSBORN D A, SINN J. Formulas containing hydrolysed protein for prevention of allergy and food intolerance in infants[J]. Cocharane Database Syst Rev,2006(4):CD003664.
[8]齐晓彦,苏米亚. 婴幼儿水解配方奶粉的研究进展[J]. 中国乳品工业,2016,44(3):46-50.
[9]李晓东,牛治霞,张柏林. 乳清蛋白水解物水解度3种测定方法的比较[J]. 中国乳品工业,2006,34(10):59-62.
[10]中华人民共和国卫生部. 食品安全国家标准 特殊医学用途配方食品通则:GB 25596—2010 [S].北京:中国标准出版社,2010.
[11]韩军花. 特殊医学用途配方食品系列标准实施指南[M]. 北京: 中国标准出版社, 2015.
[12]国家食品药品监督管理总局.特殊医学用途配方食品注册管理办法:国家食品药品监督管理总局令第24号[A/OL].(2016-03-10)[2018-01-26]. http://www.sda.gov.cn/WS01/CL0053/146741.html.
[13]Standard for infant formula and formula for special medical purposes intended for infants:Codex Stan 72-1981 (Revision 2007) [S]. Food and Agriculture Organization of the United Nations/World Health Organization,2007.
[14]The Commission of the European Communities. Commission Regulation (EC) No 1609/2006 of 27 October 2006 authorising the placing on the market of infant formulae based on hydrolysates of whey protein derived from cows milk protein for a two-year period [J]. Official Journal of the European Communities, 2006(299):9-10.
[15]European Food Safety Authority. Opinion of the scientific panel on dietetic products, nutrition and allergies on a request from the commission related to the safety and suitability for particular nutritional use by infants of formulae based on whey protein partial hydrolysates with a protein content of at least 1.9 g protein/100 kcal [J].The EFSA Journal, 2005, L(280): 1-16.
[16]The Commission of the European Communities. Commission Regulation (EC) No 1243/2008 of 12 December 2008 amending Annexes III and VI to Directive 2006/141/EC as regards compositional requirements for certain infant formulae [J]. Official Journal of the European Communities, 2008, L(335):25-27.
[17]The European Commission. Commission Directive 2013/46/EU of 28 August 2013 amending Directive 2006/141/EC with regard to protein requirements for infant formulae and follow-on formulae [J]. Official Journal of the European Communities, 2013, L(230):16-19.
[18]The Commission of the European Communities. Commission Directive 2006/141/EC of 22 December 2006 on infant formulae and follow-on formulae and amending Directive 1999/21/EC[J]. Official Journal of the European Communities, 2006, L (401):1-29.
[19]The European Commission. Commission Delegated Regulation (EU) 2016/127 of 25 September 2015 supplementing Regulation (EU) No 609/2013 of the European Parliament and of the Council as regards the specific compositional and information requirements for infant formula and follow-on formula and as regards requirements on information relating to infant and young children feeding [J]. Official Journal of the European Communities, 2016, L(25):1-29.
[20]KLEINMAN R E, BAHNA S, POWELL G F, et al. Use of infant formulas in infants with cow milk allergy: a review and recommendations [J]. Pediatr Allergy Immunol, 1991,2(4):146-155.
[21]FDA. 100% Whey protein partially hydrolyzed in infant formula and reducing the risk of allergy in infants [S/OL].2015 [2018-01-26]. https://www.fda.gov/ohrms/dockets/dockets/05q0298/05q-0298-qhc0001-004_tab-a-exec-sum-vol1.pdf.
[22]BOCK S A, SAMPSON H A, ATKINS F M, et al. Double-blind, placebo-controlled food challenge (DBPCFC) as an office procedure: a manual[J]. J Allergy Clin Immunol, 1988, 82(6):986-997.
[23]韩军花,李晓瑜. 特殊食品国内外法规标准对比研究[M]. 北京: 中国医药科技出版社, 2017.
[24]经济部标准检验局. 婴儿配方食品:CNS 6849 N5174 [S]. 中国台湾:经济部标准检验局,1997.
[25]HOST A, HALKEN S. Hypoallergenic formulas-when, to whom and how long: after more than 15 years we know the right indication[J]. Allergy, 2004,59 (Suppl 78):45-52.
[2]HILL D J, FIRER M A, SHELTON M J, et al. Manifestations of milk allergy in infancy: clinical and immunologic findings [J].J Pediatr, 1986, 109(2):270-276.
[3]ALEXANDER D D, CABANA M D. Partially hydrolyzed 100% whey protein infant formula and reduced risk of atopic dermatitis: a meta-analysis [J]. Hepatology and Nutrition, 2010, 50 (4): 422-430.
[4]HAYS T, WOOD R A. A systematic review of the role of hydrolyzed infant formulas in allergy prevention [J]. Arch Pediatr Adolesc Med, 2005, 159(9):810-816.
[5]齐晓彦,苏米亚,刘翠平,等. 水解配方乳粉的抗过敏性研究进展及其市场开发应用[J]. 食品工业,2015,36(9):247-251.
[6]American Academy of Pediatrics Committee on Nutrition. Hypoallergenic infant formulas [J]. Pediatrics, 2000,106 (2):346-349.
[7]OSBORN D A, SINN J. Formulas containing hydrolysed protein for prevention of allergy and food intolerance in infants[J]. Cocharane Database Syst Rev,2006(4):CD003664.
[8]齐晓彦,苏米亚. 婴幼儿水解配方奶粉的研究进展[J]. 中国乳品工业,2016,44(3):46-50.
[9]李晓东,牛治霞,张柏林. 乳清蛋白水解物水解度3种测定方法的比较[J]. 中国乳品工业,2006,34(10):59-62.
[10]中华人民共和国卫生部. 食品安全国家标准 特殊医学用途配方食品通则:GB 25596—2010 [S].北京:中国标准出版社,2010.
[11]韩军花. 特殊医学用途配方食品系列标准实施指南[M]. 北京: 中国标准出版社, 2015.
[12]国家食品药品监督管理总局.特殊医学用途配方食品注册管理办法:国家食品药品监督管理总局令第24号[A/OL].(2016-03-10)[2018-01-26]. http://www.sda.gov.cn/WS01/CL0053/146741.html.
[13]Standard for infant formula and formula for special medical purposes intended for infants:Codex Stan 72-1981 (Revision 2007) [S]. Food and Agriculture Organization of the United Nations/World Health Organization,2007.
[14]The Commission of the European Communities. Commission Regulation (EC) No 1609/2006 of 27 October 2006 authorising the placing on the market of infant formulae based on hydrolysates of whey protein derived from cows milk protein for a two-year period [J]. Official Journal of the European Communities, 2006(299):9-10.
[15]European Food Safety Authority. Opinion of the scientific panel on dietetic products, nutrition and allergies on a request from the commission related to the safety and suitability for particular nutritional use by infants of formulae based on whey protein partial hydrolysates with a protein content of at least 1.9 g protein/100 kcal [J].The EFSA Journal, 2005, L(280): 1-16.
[16]The Commission of the European Communities. Commission Regulation (EC) No 1243/2008 of 12 December 2008 amending Annexes III and VI to Directive 2006/141/EC as regards compositional requirements for certain infant formulae [J]. Official Journal of the European Communities, 2008, L(335):25-27.
[17]The European Commission. Commission Directive 2013/46/EU of 28 August 2013 amending Directive 2006/141/EC with regard to protein requirements for infant formulae and follow-on formulae [J]. Official Journal of the European Communities, 2013, L(230):16-19.
[18]The Commission of the European Communities. Commission Directive 2006/141/EC of 22 December 2006 on infant formulae and follow-on formulae and amending Directive 1999/21/EC[J]. Official Journal of the European Communities, 2006, L (401):1-29.
[19]The European Commission. Commission Delegated Regulation (EU) 2016/127 of 25 September 2015 supplementing Regulation (EU) No 609/2013 of the European Parliament and of the Council as regards the specific compositional and information requirements for infant formula and follow-on formula and as regards requirements on information relating to infant and young children feeding [J]. Official Journal of the European Communities, 2016, L(25):1-29.
[20]KLEINMAN R E, BAHNA S, POWELL G F, et al. Use of infant formulas in infants with cow milk allergy: a review and recommendations [J]. Pediatr Allergy Immunol, 1991,2(4):146-155.
[21]FDA. 100% Whey protein partially hydrolyzed in infant formula and reducing the risk of allergy in infants [S/OL].2015 [2018-01-26]. https://www.fda.gov/ohrms/dockets/dockets/05q0298/05q-0298-qhc0001-004_tab-a-exec-sum-vol1.pdf.
[22]BOCK S A, SAMPSON H A, ATKINS F M, et al. Double-blind, placebo-controlled food challenge (DBPCFC) as an office procedure: a manual[J]. J Allergy Clin Immunol, 1988, 82(6):986-997.
[23]韩军花,李晓瑜. 特殊食品国内外法规标准对比研究[M]. 北京: 中国医药科技出版社, 2017.
[24]经济部标准检验局. 婴儿配方食品:CNS 6849 N5174 [S]. 中国台湾:经济部标准检验局,1997.
[25]HOST A, HALKEN S. Hypoallergenic formulas-when, to whom and how long: after more than 15 years we know the right indication[J]. Allergy, 2004,59 (Suppl 78):45-52.
 王星.国内外法规对水解乳蛋白在婴幼儿配方食品中使用的规定[J].中国食品卫生杂志,2018,30(2):164-168.
王星.国内外法规对水解乳蛋白在婴幼儿配方食品中使用的规定[J].中国食品卫生杂志,2018,30(2):164-168.