DOi:10.13590/j.cjfh.2018.03.002
中国水产品中副溶血性弧菌耐药性及遗传特征分析
(1.国家食品安全风险评估中心 卫生部食品安全风险评估重点实验室,北京100021; 2.北京农学院食品科学与工程学院,北京102206; 3.西北农林科技大学食品 科学与工程学院,陕西 杨凌712100)
收稿日期:2018-03-23
作者简介:白瑶女助理研究员研究方向为食品微生物E-mail:baiyao@cfsa.net.cn
通信作者:李凤琴女研究员研究方向为食品微生物E-mail:lifengqin@cfsa.net.cn
基金项目:国家重点研发计划“食品中全谱致癌物内源代谢规律及监测技术研究”(2017YFC1601103)
摘要:目的研究我国水产品中分离的副溶血性弧菌耐药性、产毒特性及遗传特征。方法对我国26个省、直辖市和自治区水产品中分离的1 137株副溶血性弧菌进行耐药性分析和毒力基因检测,并用脉冲场凝胶电泳方法比对产毒菌株的遗传特征。结果1 137株副溶血性弧菌中有254株(22.3%)受试菌株对测定的12种抗生素全部敏感,883株(77.7%)对测定的抗生素呈现不同程度耐药。所有受试菌株对左氧氟沙星和庆大霉素抗生素敏感,主要耐受的抗生素为氨苄西林(53.7%,611/1 137)、阿莫西林/克拉维酸(46.3%,526/1 137)和头孢唑林(24.2%,275/1 137)。1 137株副溶血性弧菌分离株全部检出tlh基因,有3株检出tdh基因,有19株检出trh基因,其中2株同时检出tdh和trh基因。20株产毒菌株遗传特征分散,与其食品来源和耐药谱之间也无密切关联,其中4株对测定的抗生素均敏感,其余菌株主要对青霉素类和头孢类抗生素耐药。结论我国水产品中副溶血性弧菌对青霉素类抗生素普遍耐药,毒力基因携带率较低,产毒菌株遗传特征多样。
关键词:
副溶血性弧菌; 水产品; 耐药性; 毒力基因; 遗传特征; 食源性致病菌
文章编号:1004-8456(2018)03-0229-06
中图分类号:R155
文献标志码:A
Antimicrobial resistance and genetic characteristics of Vibrio parahaemolyticus isolated from aquatic products in China
(1.Key Laboratory of Food Safety Risk Assessment of Ministry of Health, China National Centre for Food Safety Risk Assessment, Beijing 100021, China; 2.College of Food Science and Engineering, Beijing University of Agriculture, Beijing 102206)
Abstract:ObjectiveTo evaluate antimicrobial resistance, virulence and genetic characteristics of Vibrio parahaemolyticus isolated from aquatic products in China. MethodsThe susceptibility of 1 137 isolates of Vibrio parahaemolyticus from 26 provinces was determined, and virulence genes including tlh, tdh and trh were detected. The genetic characteristics of Vibrio parahaemolyticus were analyzed by pulsed field gel electrophoresis method. ResultsTwo hundred and fifty-four strains (22.3%) were susceptible to all the antibiotics tested and 883 strains (77.7%) presented resistance to single or multiple antibiotics. All strains were susceptible to gentamicin and levofloxacin. The highest resistance rates were ampicillin (53.7%,611/1 137), amoxicillin/clavulanic acid (46.3%,526/1 137) and cefazolin (24.2%,275/1 137). All the 1 137 isolates were positive for tlh gene, including 3 isolates were positive for tdh gene and 19 isolates were positive for trh gene. Twenty strains with virulence genes were resistance to mainly penicillins and cephalosporin and 4 strains of them were snsceptible to all the antibiotics tested. There was no certain relation between the source and drug-resistant spectrum in these strains with virulence genes, and they displayed different genetic characteristics. ConclusionVibrio parahaemolyticus isolated from aquatic products were resistant to penicillins widely in China, but the rate of virulence genes of strains isolated from food was lower than clinical. The genetic characteristics of virulent strains were varied.
Key words:
Vibrio parahaemolyticus; aquatic products; antimicrobial resistance; virulence genes; genetic characteristics; foodborne pathogenic bacteria
副溶血性弧菌(Vibrio parahaemolyticus,VP)是近年来我国特别是沿海地区引发细菌性食源性疾病的首要致病菌[1]。副溶血性弧菌属于革兰阴性嗜盐性弧菌,在各类海产品、海水环境等沿海海域广泛分布,淡水产品和淡水环境中也可检出该菌。副溶血性弧菌可在水生动物的肠道内粘附、聚集和繁殖,引发水生动物疾病,给海水养殖业带来巨大损失,亦可引起人类胃肠炎等疾病,严重者可引发伤口感染和败血症等[2]。副溶血性弧菌致病的毒素包括溶血素、尿素酶和荚膜多糖等[3],其中溶血素是主要的致病因子,包括不耐热溶血素(thermolabile hemolysin,TLH)、直接耐热溶血素(thermostable direct hemolysin,TDH)和TDH相关溶血素(TDH related hemolysin,TRH),分别由tlh、tdh和trh毒力基因编码[4-5]。TDH具有细胞毒性、致死毒性和肠毒性,能溶解血红细胞,是区分致病性和非致病性副溶血性弧菌的重要标志[6]。TRH具有肠毒性,有些菌株同时具有以上两种毒素。TDH和TRH与副溶血性弧菌的致病性密切相关。随着抗生素在动物养殖业和人类医疗中的普遍使用,副溶血性弧菌的耐药现状不容乐观,而耐药菌株一旦通过食物链传递或将耐药基因水平转移至人体,将给人类健康带来潜在危害[7-8]。为全面了解我国水产品中副溶血性弧菌的耐药性、产毒性和遗传特征,本研究选用我国26个省、直辖市和自治区水产品中分离的1 137株副溶血性弧菌,选择临床治疗细菌感染常用的12种抗生素进行耐药性分析,用聚合酶链式反应(PCR)方法进行毒力基因检测,并用脉冲场凝胶电泳(PFGE)方法分析产毒菌株的分子型别,为全面评估食源性疾病的风险、提出防治策略提供科学理论依据。
药敏试验所用质控菌株为大肠埃希菌标准菌株(ATCC 25922)。分子鉴定所用质控菌株为副溶血性弧菌标准菌株(ATCC 17802、CICC 21528和CICC 21618)。分子分型所用参考菌株为沙门菌标准菌株(H9812)。所有质控菌株和参考菌株均为本实验室保藏。
弧菌显色培养基(法国CHROMagar),脑心浸液肉汤(BHI)、脑心浸液琼脂(BHA)、MH肉汤均购自英国OXOID,PCR Master Mix和DNA Ladder均购自天根生化科技公司,革兰阴性细菌药敏板(上海星佰生物技术有限公司),限制性内切酶Xba I和Sfi I均购自大连宝生物公司,氯化钠(NaCl)、硼酸均为分析纯。
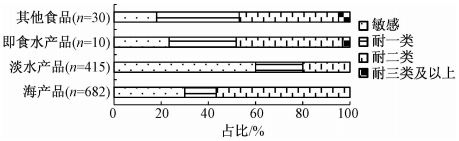
本研究所用副溶血性弧菌中有682株从海产品分离得到,其中123株(18.0%,123/682)为抗生素敏感性分离株,33株(4.8%,33/682)耐受三类及以上抗生素。415株分离株源自淡水产品,其中97株(23.4%,97/415)为抗生素敏感性分离株,13株(3.1%,13/415)耐受三类及以上抗生素。淡水产品中的副溶血性弧菌敏感菌株比例略高于海产品,同时耐受三类及以上抗生素的多重耐药菌株比例略低于海产品分离株。10株分离株源自即食水产品,其中6株(60.0%,6/10)为抗生素敏感性菌株。30株分离株源自寿司等其他含有水产品的食品,其中9株(30.0%,9/30)为抗生素敏感性菌株。不同类型食品来源的菌株药敏试验结果详见图1。
本研究测定的副溶血性弧菌中有77.7%的菌株呈现不同程度的耐药现象,尤其是对青霉素类(AMP)和头孢类(CFZ)等β-内酰胺类抗生素耐药严重,与国内外报道[11-16]基本一致。文献[17-18]报道我国近海养殖海域内可检测到对β-内酰胺类抗生素高度耐药的副溶血性弧菌,而β-内酰胺类抗生素常用于动物养殖中,预防养殖过程中动物感染发病,由于水产养殖环境的特殊性,抗生素更易通过水体而迅速扩散,携带耐药菌株的养殖动物也会通过食物链传递导致耐药性的传播。本研究发现8株对IMP耐药的菌株,IMP等碳青霉烯类抗生素是临床治疗严重细菌感染的最后一道防线,此类耐药菌株一旦通过食物链传播到人类,将会带来严重的疾病负担和医疗困境,因此,食品中抗生素耐药的现象亟需得到重视,动物养殖环节中需加强对抗生素使用的监管,同时注重医疗卫生行业中的抗生素规范使用迫在眉睫。
携带tdh、trh基因的副溶血性弧菌菌株能够产生溶血素,被认为是对人类有致病性的菌株,分子流行病学研究[19-20]表明携带tdh、trh毒力基因的产毒株与人类食源性疾病的暴发密切相关。本研究分析的1 137株副溶血性弧菌中,检出tdh、trh基因的菌株占所有待测菌株的1.9%(22/1 137),与其他研究[21-24]中食品来源的产毒株比例基本一致,远低于我国临床报道[24-28]的产毒株比例。本研究检测的20株副溶血性弧菌产毒菌株中4株为抗生素敏感菌株,16株产毒菌株对青霉素类(AMP)或头孢类(CFZ)抗生素耐药。20株产毒菌株分别来自不同地域的海产品和淡水产品,除河北省的5株淡水产品分离株之间同源性较高,其他菌株之间遗传特征分析并无明显的相似性,显示出我国水产品中副溶血性弧菌产毒菌株遗传特征多样,暂未发现同种遗传特征的产毒菌株在不同水产品之间交叉传播现象。产毒菌株的耐药谱、遗传特征与其菌株地域来源、食品种类之间无明显关联。
综合分析我国水产品中副溶血性弧菌的耐药性、产毒特性和分子遗传特征,可为临床治疗副溶血性弧菌感染导致的食源性疾病提供科学理论依据。下一步研究中应持续关注我国水产品中副溶血性弧菌的高检出率与其引发的食源性疾病是否密切相关,对食源性副溶血性弧菌和临床分离株的致病性和同源性等分子特征进行比对分析,对副溶血性弧菌的耐药性产生及传播规律、产毒菌株携带的毒力基因是否水平转移等予以重点研究,以期提高食源性疾病的防控效果,多角度、全方位保障我国食品安全。
1材料与方法
1.1材料
1.1.1菌株
本研究所用1 137株副溶血性弧菌由2015年国家食品污染和有害因素风险监测网采集的食品样品中分离,样品来自全国26个省、直辖市和自治区,样品种类涵盖市售常见海产品(包括带鱼、牡蛎、海虾等海产鱼、虾、贝、蟹类)和淡水产品(包括鲤鱼、小龙虾、河蚌等淡水产的鱼、虾、贝、蟹类)等,以及含有水产品的混合食品(如寿司等)。所有菌株经生化复核和分子鉴定均已确认为副溶血性弧菌。药敏试验所用质控菌株为大肠埃希菌标准菌株(ATCC 25922)。分子鉴定所用质控菌株为副溶血性弧菌标准菌株(ATCC 17802、CICC 21528和CICC 21618)。分子分型所用参考菌株为沙门菌标准菌株(H9812)。所有质控菌株和参考菌株均为本实验室保藏。
1.1.2主要仪器与试剂
基因扩增仪、PFGE仪和凝胶成像系统均购自美国Bio-Rad,Vitek 2细菌浊度计、全自动生化鉴定系统和API 20E生化试验鉴定试剂条均购自法国BioMérieux,生物安全柜,高压灭菌器,隔水式恒温培养箱,恒温水浴装置,恒温金属浴装置,台式高速离心机。弧菌显色培养基(法国CHROMagar),脑心浸液肉汤(BHI)、脑心浸液琼脂(BHA)、MH肉汤均购自英国OXOID,PCR Master Mix和DNA Ladder均购自天根生化科技公司,革兰阴性细菌药敏板(上海星佰生物技术有限公司),限制性内切酶Xba I和Sfi I均购自大连宝生物公司,氯化钠(NaCl)、硼酸均为分析纯。
1.2方法
1.2.1菌株纯化与鉴定
使用一次性无菌接种环,将副溶血性弧菌接种在弧菌显色平板上,37 ℃过夜培养,挑取单颗紫色菌落,再次划线接种于含3%NaCl的BHA平板培养过夜。挑取新鲜菌落至3 ml无菌生理盐水中充分混匀,使用全自动生化鉴定系统和API 20E生化试验鉴定试剂条进行生化鉴定。同时采用水煮法提取副溶血性弧菌基因组DNA,具体步骤为:挑取适量新鲜菌落,制备成浓度约2.0麦氏浊度的菌悬液,100 ℃金属浴加热10 min后,12 000 r/min离心1 min,取上清液移至无菌EP管中作为分子鉴定的DNA模板,保存于-20 ℃备用。采用PCR方法检测tlh基因。PCR所用引物序列、反应体系和扩增条件等均参照文献[9]。
1.2.2微量肉汤稀释法抗生素敏感性测定
本研究采用的革兰阴性细菌药敏板含有12种抗生素,分别是青霉素类:氨苄西林(AMP),β-内酰胺/β-内酰胺酶抑制剂复合物类:阿莫西林/克拉维酸(AMC),头孢类:头孢噻肟(CTX)、头孢唑林(CFZ)、头孢他啶(CAZ),氯霉素类:氯霉素(CHL),氟喹诺酮类:环丙沙星(CIP)、左氧氟沙星(LEV),氨基糖苷类:庆大霉素(GEN),四环素类:四环素(TET),碳青霉烯类:亚胺培南(IMP)和叶酸代谢途径抑制剂类:复方新诺明(SXT)。药敏测定时依据说明书操作,使用一次性无菌接种环,将待测菌株划线接种于含3%NaCl的BHA平板,37 ℃过夜培养复苏后,挑取单个菌落,再次划线接种于含3%NaCl的BHA平板培养过夜。挑取新鲜菌落至3 ml无菌生理盐水中充分混匀,用比浊仪调整菌悬液浓度至0.5麦氏浊度。取上述菌悬液60 μl加至12 ml营养肉汤中,充分混匀后按照每孔100 μl加至药敏板中,置于37 ℃恒温培养箱中培养18~24 h后,肉眼观察读取每种抗生素对副溶血性弧菌的最小抑菌浓度(minimum inhibitory concentrations, MIC)。以大肠埃希菌标准菌株(ATCC 25922)作为质控菌株,依据美国临床实验室标准化协会(clinical and laboratory standards institute,CLSI)的标准[10]判定药敏结果。
1.2.3毒力基因检测
使用副溶血性弧菌鉴定后冻存的DNA模板,挑选出待测菌株,依据已报道的PCR检测方法[9],检测菌株中tdh和trh两个毒力基因的携带情况
1.2.4PFGE
参照美国疾病预防控制中心PulseNet实验室使用的标准化分子分型方法,对分离纯化的副溶血性弧菌进行PFGE分型。用比浊仪将细菌菌悬液浓度调至4.0麦氏浊度;副溶血性弧菌使用限制性内切酶Sfi I(40 U/μl)在50 ℃水浴条件下酶切4 h,参考菌株沙门菌标准菌株(H9812)使用限制性内切酶Xba I(40 U/μl)在37 ℃水浴条件下酶切2 h;电压6.0 V/cm,脉冲参数10~35 s,电泳19 h。将胶块用Gel Red染料染色后,在凝胶成像系统中拍照,随后将图像导入BioNumerics 7.6软件中分析并聚类作图。
2结果
2.1药敏试验结果
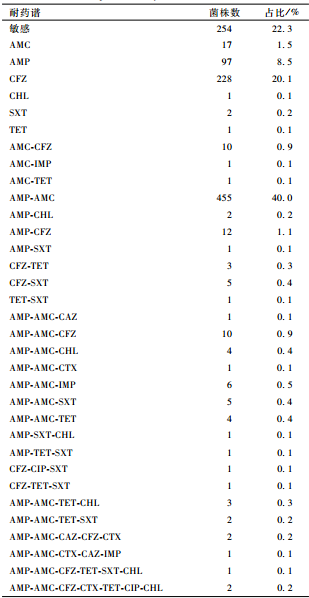
不同程度耐药,主要耐受的抗生素分别为AMP(53.7%,611/1 137)、AMC(46.3%,526/1 137)和CFZ(24.2%,275/1 137),对CHL、TET和SXT的耐药率在1%~2%之间,对其他测定抗生素的耐药率均低于1%,但出现8株(0.7%,8/1 137)对IMP耐药的菌株。所有受试副溶血性弧菌形成的单一抗生素耐药谱中CFZ和AMP是最主要耐药谱,耐受2种及以上抗生素的耐药谱中主要为AMP-AMC(40.0%,455/1 137),其次分别为AMP-CFZ(1.1%,12/1 137)、AMC-CFZ(0.9%,10/1 137)和AMP-AMC-CFZ(0.9%,10/1 137),其他耐药谱的菌株较为分散,但多数耐药谱中包含有AMP、AMC或CFZ。所有受试菌株的耐药谱分布见表1。
|
表11 137株副溶血性弧菌耐药谱分布 Table 1Resistant spectrum distribution of 1 137 Vibrio parahaemolyticus stains |
|
图1不同类型食品来源的副溶血性弧菌药敏结果 Figure 1Results of antibiotic susceptibility test of Vibrio parahaemolyticus isolated from different types of food |
2.2毒力基因检测结果
PCR方法检测副溶血性弧菌毒力基因结果显示,1 137株副溶血性弧菌分离株全部检测出tlh基因,有3株检出tdh基因,检出率为0.3%(3/1 137),19株检出trh基因,检出率为1.7%(19/1 137),其中2株同时检出tdh和trh基因。
2.3分子分型结果
选择检出tdh基因或trh基因的副溶血性弧菌产毒菌株20株,使用限制性内切酶Sfi I酶切后,使用BioNumerics软件将PFGE图谱进行聚类分析,结果如图2所示,20株产毒菌株产生16种不同的PFGE型别,酶切带型分布分散,优势带型不明显。20株菌的带型可分为两大簇,每簇分别包括11株和9株分离株,其中5株河北省淡水产品分离株聚成一小簇,2株湖南省和广东省的海产品分离株可聚成一小簇,2株山西省和河北省的淡水产品分离株聚成一小簇,以上三小簇内的分离株同源性均在80%以上。20株产毒分离株的PFGE型别与其耐药谱之间无明显相关,与菌株来源的地域性和食品类别之间也无密切关联。

|
图220株副溶血性弧菌毒力菌株PFGE聚类图 Figure 2PFGE results of 20 Vibrio parahaemolyticus strains with virulence gene |
3讨论
本研究所用的1 137株副溶血性弧菌由国家食品污染和有害因素风险监测网中样品分离得到,样品采集时间为2015—2016年,采样范围覆盖我国26个省、直辖市和自治区,采样地点包括大小超市、农贸市场和餐饮门店,样品种类涵盖市面常见的海产品、淡水产品等各类水产品,样品状态包括鲜活、冰鲜、冷冻水产品和即食水产品等,可较为全面的反映出我国水产品中副溶血性弧菌污染水平。本研究测定的副溶血性弧菌中有77.7%的菌株呈现不同程度的耐药现象,尤其是对青霉素类(AMP)和头孢类(CFZ)等β-内酰胺类抗生素耐药严重,与国内外报道[11-16]基本一致。文献[17-18]报道我国近海养殖海域内可检测到对β-内酰胺类抗生素高度耐药的副溶血性弧菌,而β-内酰胺类抗生素常用于动物养殖中,预防养殖过程中动物感染发病,由于水产养殖环境的特殊性,抗生素更易通过水体而迅速扩散,携带耐药菌株的养殖动物也会通过食物链传递导致耐药性的传播。本研究发现8株对IMP耐药的菌株,IMP等碳青霉烯类抗生素是临床治疗严重细菌感染的最后一道防线,此类耐药菌株一旦通过食物链传播到人类,将会带来严重的疾病负担和医疗困境,因此,食品中抗生素耐药的现象亟需得到重视,动物养殖环节中需加强对抗生素使用的监管,同时注重医疗卫生行业中的抗生素规范使用迫在眉睫。
携带tdh、trh基因的副溶血性弧菌菌株能够产生溶血素,被认为是对人类有致病性的菌株,分子流行病学研究[19-20]表明携带tdh、trh毒力基因的产毒株与人类食源性疾病的暴发密切相关。本研究分析的1 137株副溶血性弧菌中,检出tdh、trh基因的菌株占所有待测菌株的1.9%(22/1 137),与其他研究[21-24]中食品来源的产毒株比例基本一致,远低于我国临床报道[24-28]的产毒株比例。本研究检测的20株副溶血性弧菌产毒菌株中4株为抗生素敏感菌株,16株产毒菌株对青霉素类(AMP)或头孢类(CFZ)抗生素耐药。20株产毒菌株分别来自不同地域的海产品和淡水产品,除河北省的5株淡水产品分离株之间同源性较高,其他菌株之间遗传特征分析并无明显的相似性,显示出我国水产品中副溶血性弧菌产毒菌株遗传特征多样,暂未发现同种遗传特征的产毒菌株在不同水产品之间交叉传播现象。产毒菌株的耐药谱、遗传特征与其菌株地域来源、食品种类之间无明显关联。
综合分析我国水产品中副溶血性弧菌的耐药性、产毒特性和分子遗传特征,可为临床治疗副溶血性弧菌感染导致的食源性疾病提供科学理论依据。下一步研究中应持续关注我国水产品中副溶血性弧菌的高检出率与其引发的食源性疾病是否密切相关,对食源性副溶血性弧菌和临床分离株的致病性和同源性等分子特征进行比对分析,对副溶血性弧菌的耐药性产生及传播规律、产毒菌株携带的毒力基因是否水平转移等予以重点研究,以期提高食源性疾病的防控效果,多角度、全方位保障我国食品安全。
参考文献
[1]刘秀梅,陈艳,樊永祥. 2003年中国食源性疾病暴发的监测资料分析[J].卫生研究,2006,35(2): 201-204.
[2]SU Y C, LIU C. Vibrio parahaemolyticus: a concern of seafood safety[J]. Food Microbiol, 2007, 24(6): 549-558.
[3]THEETHAKAEW C, FEIL E J, CASTILLORAMREZ S, et al. Genetic relationships of Vibrio parahaemolyticus isolates from clinical, human carrier, and environmental sources in Thailand, determined by multilocus sequence analysis[J]. Appl Environ Microbiol, 2013, 79(7): 2358-2370.
[4]HONDA T, IIDA T. The pathogenicity of Vibrio parahaemolyticus and the role of thermostable direct hemolysin and related hemolysins[J]. Rev Med Microbiol, 1993, 4(2): 106-113.
[5]CECCARELLI D, HASAN N A, HUQ A, et al. Distribution and dynamics of epidemic and pandemic Vibrio parahaemolyticus virulence factors [J]. Front Cell Infect Microbiol, 2013, 3(8): 97.
[6]朱雪兰,陈艳,刘秀梅,等.副溶血性弧菌溶血素基因及其检测的研究进展[J].国外医学卫生学分册,2007,34(4):233-236.
[7]OKOH A I, IGBINOSA E O. Antibiotic susceptibility profiles of some Vibrio strains isolated from wastewater final effluents in a rural community of the Eastern Cape Province of South Africa [J].BMC Microbiol, 2010, 10(1): 143.
[8]JUN J W, KIM J H, CHORESCA J R, et al. Isolation, molecular characterization, and antibiotic susceptibility of Vibrio parahaemolyticus in Korean seafood[J]. Foodborne Pathog Dis, 2012, 9(3): 224-231.
[9]BEJ A K, PATTTERSON D P, BRASHER C W, et al. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tlh, tdh and trh [J]. J Microbiol Method, 1999, 36(3): 215-225.
[10]Clinical Laboratory Standards Institute.Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria; approved guideline[S].Wayne Pennsylvania:Clinical Laboratory Standards Institute,2015.
[11]KANG C H, SHIN Y, KIM W, et al. Prevalence and antimicrobial susceptibility of Vibrio parahaemolyticus isolated from oysters in Korea[J]. Environ Sci Pollut Res, 2016, 23(1): 1-9.
[12]HE Y, JIN L L, SUN F J, et al. Antibiotic and heavy-metal resistance of Vibrio parahaemolyticus isolated from fresh shrimps in Shanghai fish markets, China[J]. Environ Sci Pollut Res, 2016, 23(15): 1-8.
[13]韩毅,沙丹. 2012—2014年无锡市不同来源副溶血性弧菌的病原学特征分析[J].中国食品卫生杂志,2016,28(6): 795-799.
[14]ALOTHRUBI S M. Antibiotic resistance of Vibrio parahaemolyticus isolated from cockles and shrimp sea food marketed in Selangor, Malaysia[J]. Clin Microbiol, 2014, 3(3): 148.
[15]KANG C H, SHIN Y, JANG S, et al. Characterization of Vibrio parahaemolyticus isolated from oysters in Korea: resistance to various antibiotics and prevalence of virulence genes [J]. Mar Pollut Bull, 2017, 118(1/2): 261-266.
[16]XU X K, Cheng J H, WU Q P, et al. Prevalence, characterization, and antibiotic susceptibility of Vibrio parahaemolyticus isolated from retail aquatic products in North China[J]. BMC Microbiol, 2016, 16(1): 32.
[17]江艳华,姚琳,李风铃,等. 青岛市售养殖海水虾中副溶血性弧菌的分离及耐药性分析[J].中国人兽共患病学报,2013,29(5): 516-519.
[18]陈盛峰,陈佳,禤金彩,等. 北海近岸养殖海域3种弧菌的分离鉴定及耐药性分析[J].动物医学进展,2016,37(6): 29-34.
[19]NISHIBUCHI M, KAPER J B. Thermostable direct hemolysin gene of Vibrio parahaemolyticus: a virulence gene acquired by a marine bacterium[J]. Infect Immun, 1995, 63(6): 2093-2099.
[20]GUTIERREZ W C K, KLEIN S L, LOVELL C R. High frequency of virulence factor genes tdh, trh, and tlh in Vibrio parahaemolyticus strains isolated from a pristine estuary[J].Appl Environ Microbiol, 2013, 79(7): 2247-2252.
[21]李薇薇, 王晓英, 郭云昌. 中国部分水产品副溶血性弧菌毒力基因的分布特征[J]. 中国食品卫生杂志,2010,22(3): 239-243.
[22]VUDDHAKUL V, SOBOON S, SUNGHIRAN W, et al. Distribution of virulent and pandemic strains of Vibrio parahaemolyticus in three molluscan shellfish species(Meretrix meretrix, Perna viridis, and Anadara granosa)and their association with foodborne disease in southern Thailand[J]. J Food Prot, 2006, 69(11): 2615-2620.
[23]BHOOPONG P, PALITTAPONGARNPIM P R, KIATKITTIPONG A, et al. Variability of properties of Vibrio parahaemolyticus strains isolated from individual patients [J]. J Clin Microbiol, 2007, 45(5): 1544-1550.
[24]马聪,朱海明,严纪文,等. 不同来源的副溶血性弧菌定性定量分析及毒素基因检测 [J].中国食品卫生杂志,2009,21(5): 402-405.
[25]吴青,韩海红,余东敏,等. 北京市水产品污染与感染病例中副溶血性弧菌血清型和毒力基因型的比较研究[J].中国食品卫生杂志,2015,27(4): 363-367.
[26]CHEN Y, CHEN X, YU F, et al. Serology, virulence, antimicrobial susceptibility and molecular characteristics of clinical Vibrio parahaemolyticus strains circulating in southeastern China from 2009 to 2013[J].Clin Microbiol Infect, 2016, 22(3): 258-259.
[27]刘丽萍,陈盛霞,徐岚,等. 江苏及周边地区副溶血性弧菌分子流行病学特征研究[J].中国食品卫生杂志,2012,24(2): 106-109.
[28]陈洪友,陈敏,盛跃颖,等. 副溶血性弧菌食源性疾病暴发分离株的血清型、核糖型及毒力基因研究[J].中国食品卫生杂志, 2011,23(2): 114-118.
[2]SU Y C, LIU C. Vibrio parahaemolyticus: a concern of seafood safety[J]. Food Microbiol, 2007, 24(6): 549-558.
[3]THEETHAKAEW C, FEIL E J, CASTILLORAMREZ S, et al. Genetic relationships of Vibrio parahaemolyticus isolates from clinical, human carrier, and environmental sources in Thailand, determined by multilocus sequence analysis[J]. Appl Environ Microbiol, 2013, 79(7): 2358-2370.
[4]HONDA T, IIDA T. The pathogenicity of Vibrio parahaemolyticus and the role of thermostable direct hemolysin and related hemolysins[J]. Rev Med Microbiol, 1993, 4(2): 106-113.
[5]CECCARELLI D, HASAN N A, HUQ A, et al. Distribution and dynamics of epidemic and pandemic Vibrio parahaemolyticus virulence factors [J]. Front Cell Infect Microbiol, 2013, 3(8): 97.
[6]朱雪兰,陈艳,刘秀梅,等.副溶血性弧菌溶血素基因及其检测的研究进展[J].国外医学卫生学分册,2007,34(4):233-236.
[7]OKOH A I, IGBINOSA E O. Antibiotic susceptibility profiles of some Vibrio strains isolated from wastewater final effluents in a rural community of the Eastern Cape Province of South Africa [J].BMC Microbiol, 2010, 10(1): 143.
[8]JUN J W, KIM J H, CHORESCA J R, et al. Isolation, molecular characterization, and antibiotic susceptibility of Vibrio parahaemolyticus in Korean seafood[J]. Foodborne Pathog Dis, 2012, 9(3): 224-231.
[9]BEJ A K, PATTTERSON D P, BRASHER C W, et al. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tlh, tdh and trh [J]. J Microbiol Method, 1999, 36(3): 215-225.
[10]Clinical Laboratory Standards Institute.Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria; approved guideline[S].Wayne Pennsylvania:Clinical Laboratory Standards Institute,2015.
[11]KANG C H, SHIN Y, KIM W, et al. Prevalence and antimicrobial susceptibility of Vibrio parahaemolyticus isolated from oysters in Korea[J]. Environ Sci Pollut Res, 2016, 23(1): 1-9.
[12]HE Y, JIN L L, SUN F J, et al. Antibiotic and heavy-metal resistance of Vibrio parahaemolyticus isolated from fresh shrimps in Shanghai fish markets, China[J]. Environ Sci Pollut Res, 2016, 23(15): 1-8.
[13]韩毅,沙丹. 2012—2014年无锡市不同来源副溶血性弧菌的病原学特征分析[J].中国食品卫生杂志,2016,28(6): 795-799.
[14]ALOTHRUBI S M. Antibiotic resistance of Vibrio parahaemolyticus isolated from cockles and shrimp sea food marketed in Selangor, Malaysia[J]. Clin Microbiol, 2014, 3(3): 148.
[15]KANG C H, SHIN Y, JANG S, et al. Characterization of Vibrio parahaemolyticus isolated from oysters in Korea: resistance to various antibiotics and prevalence of virulence genes [J]. Mar Pollut Bull, 2017, 118(1/2): 261-266.
[16]XU X K, Cheng J H, WU Q P, et al. Prevalence, characterization, and antibiotic susceptibility of Vibrio parahaemolyticus isolated from retail aquatic products in North China[J]. BMC Microbiol, 2016, 16(1): 32.
[17]江艳华,姚琳,李风铃,等. 青岛市售养殖海水虾中副溶血性弧菌的分离及耐药性分析[J].中国人兽共患病学报,2013,29(5): 516-519.
[18]陈盛峰,陈佳,禤金彩,等. 北海近岸养殖海域3种弧菌的分离鉴定及耐药性分析[J].动物医学进展,2016,37(6): 29-34.
[19]NISHIBUCHI M, KAPER J B. Thermostable direct hemolysin gene of Vibrio parahaemolyticus: a virulence gene acquired by a marine bacterium[J]. Infect Immun, 1995, 63(6): 2093-2099.
[20]GUTIERREZ W C K, KLEIN S L, LOVELL C R. High frequency of virulence factor genes tdh, trh, and tlh in Vibrio parahaemolyticus strains isolated from a pristine estuary[J].Appl Environ Microbiol, 2013, 79(7): 2247-2252.
[21]李薇薇, 王晓英, 郭云昌. 中国部分水产品副溶血性弧菌毒力基因的分布特征[J]. 中国食品卫生杂志,2010,22(3): 239-243.
[22]VUDDHAKUL V, SOBOON S, SUNGHIRAN W, et al. Distribution of virulent and pandemic strains of Vibrio parahaemolyticus in three molluscan shellfish species(Meretrix meretrix, Perna viridis, and Anadara granosa)and their association with foodborne disease in southern Thailand[J]. J Food Prot, 2006, 69(11): 2615-2620.
[23]BHOOPONG P, PALITTAPONGARNPIM P R, KIATKITTIPONG A, et al. Variability of properties of Vibrio parahaemolyticus strains isolated from individual patients [J]. J Clin Microbiol, 2007, 45(5): 1544-1550.
[24]马聪,朱海明,严纪文,等. 不同来源的副溶血性弧菌定性定量分析及毒素基因检测 [J].中国食品卫生杂志,2009,21(5): 402-405.
[25]吴青,韩海红,余东敏,等. 北京市水产品污染与感染病例中副溶血性弧菌血清型和毒力基因型的比较研究[J].中国食品卫生杂志,2015,27(4): 363-367.
[26]CHEN Y, CHEN X, YU F, et al. Serology, virulence, antimicrobial susceptibility and molecular characteristics of clinical Vibrio parahaemolyticus strains circulating in southeastern China from 2009 to 2013[J].Clin Microbiol Infect, 2016, 22(3): 258-259.
[27]刘丽萍,陈盛霞,徐岚,等. 江苏及周边地区副溶血性弧菌分子流行病学特征研究[J].中国食品卫生杂志,2012,24(2): 106-109.
[28]陈洪友,陈敏,盛跃颖,等. 副溶血性弧菌食源性疾病暴发分离株的血清型、核糖型及毒力基因研究[J].中国食品卫生杂志, 2011,23(2): 114-118.
 白瑶,赵洋洋,叶淑瑶,江涛,王伟,裴晓燕,杨大进,徐进,李凤琴.中国水产品中副溶血性弧菌耐药性及遗传特征分析[J].中国食品卫生杂志,2018,30(3):229-234.
白瑶,赵洋洋,叶淑瑶,江涛,王伟,裴晓燕,杨大进,徐进,李凤琴.中国水产品中副溶血性弧菌耐药性及遗传特征分析[J].中国食品卫生杂志,2018,30(3):229-234.