DOi:10.13590/j.cjfh.2017.03.006
北京市集贸市场生鲜猪肉肠球菌种水平鉴定及耐药特征
(1.国家食品安全风险评估中心 卫生部食品安全风险评估重点实验室,北京100021; 2.北京农学院食品科学与工程学院,北京102206; 3.中国疾病预防控制中心传染病 预防控制所,北京102206)
作者简介: 彭子欣女副研究员研究方向为食品微生物学E-mail:pengzixin@cfsa.net.cn
通信作者: 李凤琴女研究员研究方向为食品微生物学E-mail:lifengqin@cfsa.net.cn
收稿日期: 2017-03-06
基金项目: 国家自然科学基金(31601574);中国博士后基金(2016M590072);北京青年拔尖人才(2014000021223ZK46);北京市科技新星交叉学科合作项目(Z161100004916029)
摘要:目的 评价和比较不同肠球菌种水平鉴定方法的准确性,了解北京市集贸市场生鲜猪肉肠球菌的种水平分布及耐药特征。方法利用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)和VITEK 2 COMPACT两种方法对北京市集贸市场生鲜猪肉肠球菌开展种水平鉴定,两种方法鉴定结果不一致的菌株使用API 20 Strep、16S rRNA和23S rRNA序列分析再次鉴定。比较不同种肠球菌对10种临床常用抗生素的药物敏感性。结果在5种肠球菌种水平鉴定方法中,16S rRNA序列分析和最终结果的符合率最高,为100.0%;VITEK 2 COMPACT符合率最低,仅为4.0%(1/25)。在86株肠球菌中,粪肠球菌占82.6%(71/86),其次为希拉肠球菌占14.0%(12/86)。粪肠球菌对环丙沙星(CIP)的耐药率高于希拉肠球菌,差异有统计学意义(χ2=10.751,P<0.01);对四环素(TET)、高浓度链霉素(HLSR)和高浓度庆大霉素(HLGR)的耐药率均高于希拉肠球菌,但差异无统计学意义(TET:χ2=3.865,P>0.05;HLSR:χ2=1.608,P>0.05;HLGR:χ2=0.553,P>0.05),但对红霉素(ERY)和氯霉素(CHL)的耐药率明显低于希拉肠球菌,差异有统计学意义(ERY:χ2=20.244,P<0.01;CHL:χ2=14.139,P<0.01)。结论16S rRNA和MALDI-TOF-MS序列分析技术在肠球菌种水平快速鉴定上有较高准确性,不同种属肠球菌呈现不同耐药特征,本研究为有效监测食源性耐药肠球菌的传播和流行提供了科学数据。
关键词:
肠球菌; 种水平鉴定; 药物敏感性; 耐药; 粪肠球菌; 希拉肠球菌; 生鲜猪肉; 食源性致病菌
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)03-0283-06
The species-level identification and antimicrobial susceptibility analysis of
Enterococcus spp. of raw pork collected from a free trade market in Beijing
Enterococcus spp. of raw pork collected from a free trade market in Beijing
(1.Key Laboratory of Food Safety Risk Assessment of Ministry of Health, China National Center for Food Safety Risk Assessment, Beijing 100021, China; 2.Food Science and Engineering College, Beijing University of Agriculture, Beijing 102206, China; 3.National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease and Prevention, Beijing 102206, China)
Abstract: Objective This study was to compare and assess the accuracy of species-level identification methods for Enterococcus spp., and to understand the species distribution and antimicrobial susceptibility characteristics of Enterococcus spp. collected of raw pork from a free trade market in Beijing. MethodsBy using matrix-assisted laser desorption/ionization time of flight mass spectrometry(MALDI-TOF-MS)and 16S rRNA gene analysis, the species of Enterococcus spp. were identified, and the inconsistent results were further identified by API 20 Strep, 16S rRNA and 23S rRNA gene analysis. Moreover, the susceptibility of isolated Enterococcus spp. to 10 antibiotics was analyzed at species level. ResultsAmong the five identification methods, 16S rRNA gene analysis showed 100.0% consistence with the final species identification results, but the VITEK 2 COMPACT showed the lowest consistence of only 4.0%(1/25). The most prevalent species in Enterococcus spp. was Enterococcus faecalis, accounting for 82.6% (71/86) followed by Enterococcus hirae 14.0% (12/86). Enterococcus faecalis strains showed higher antimicrobial susceptibility than Enterococcus hirae to ciprofloxacin, tetracycline, high-level streptomycin and high-level gentamicin (ciprofloxacin: χ2=10.751, P<0.01; tetracycline: χ2=3.865, P>0.05; high-level streptomycin: χ2=1.608, P>0.05; high-level gentamicin: χ2=0.553, P>0.05), but showed apparently lower antimicrobial susceptibility on erythromycin and chloramphenicol than Enterococcus hirae (erythromycin: χ2=20.244, P<0.01; chloramphenicol: χ2=14.139, P<0.01). ConclusionThe 16S rRNA gene analysis and MALDI-TOF-MS have higher accuracy at species level identification for Enterococcus spp.. Different species of Enterococcus spp. showed various antimicrobial susceptibility characteristics. This study was important for the effective monitoring of drug-resistant enterococci spread and prevalence.
Key words:
Enterococcus spp.; species-level identification; antibiotic susceptibility; resistant to antibiotics; Enterococcus faecalis; Enterococcus hirae; raw pork; foodborne pathogens
肠球菌中某些菌种可作为发酵剂和益生菌用于食品和药品生产中[1],但是近几十年来发现,肠球菌中的一些菌株是条件致病菌,其引起的食品安全问题已引起相关专家的关注。食品中污染的肠球菌由于其环境耐受力强,难以通过加工手段杀灭,会在食品中快速繁殖,引起食物中毒[2]。更应注意的是,肠球菌是重要的耐药基因储存库,其携带的耐药基因可通过食物链传递给其他食源性致病菌[3]。肠球菌属目前有50多个种,大部分肠球菌来源于人和动物的粪便,而少数菌种来源于非粪便基质,不同种肠球菌的生理、生化特性,乃至致病宿主和耐药特征均不同,因此准确了解肠球菌的种属分布,对于认知其流行趋势和遗传变异具有重要意义[1,4]。然而,由于没有肠球菌种水平鉴定显色培养基,一些肠球菌种水平特征基因序列又极为相似,肠球菌种水平的快速鉴定一直是微生物检验的一个难点,阻碍了相关实验室对肠球菌种属分布和流行特征的深入认识[4-5]。本研究对前期从北京市集贸市场环境和生鲜猪肉中分离的肠球菌开展种水平鉴定,评价不同鉴定方法的区分效果和准确性,分析不同种肠球菌的耐药分布,描述食品中不同种属肠球菌的耐药特征。
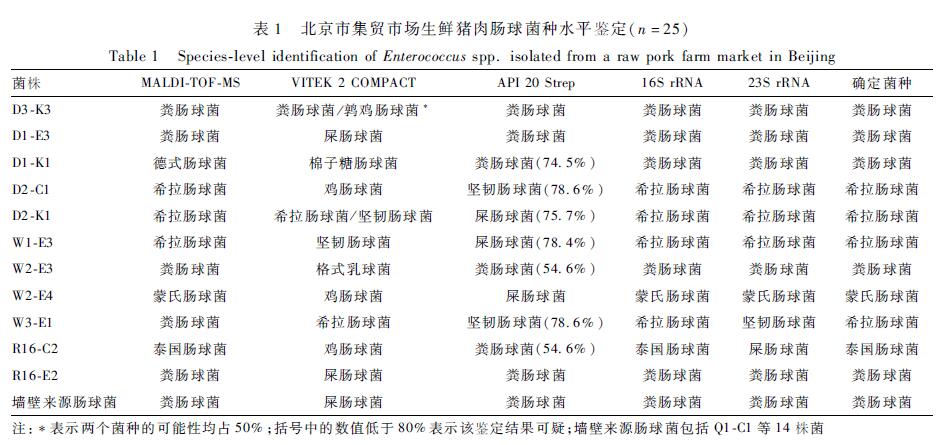
MALDI-TOF-MS和VITEK 2 COMPACT鉴定D1-K1的结果分别为德氏肠球菌和棉子糖肠球菌,16S rRNA和23S rRNA分子鉴定结果为粪肠球菌,API 20 Strep鉴定结果疑似粪肠球菌,最终取粪肠球菌鉴定结果。
1材料与方法
1.1材料
1.1.1菌株来源
2015年5月从北京市某集贸市场分离肠球菌86株,其中来源于地面涂抹样品、墙壁涂抹样品、污水样品和生鲜猪肉样品的肠球菌数量分别为29、14、21和22株[2],其药物敏感性检验方法和药敏特征参见文献[6]。质控菌株粪肠球菌(ATCC 29212)为本实验室保藏。
1.1.2主要仪器与试剂
PCR仪、电泳仪、凝胶成像系统均购自美国Bio-Rad,VITEK 2 COMPACT 全自动细菌鉴定仪、VITEK革兰阳性细菌鉴定卡、API 20 Strep试剂条和VITEK 2 Densi CHEKTM Plus浊度仪均购自法国梅里埃,MALDI Biotyper(德国布鲁克)。脑心浸液琼脂(BHA)和血琼脂平板均购自北京陆桥技术有限责任公司,2×Taq PCR MaterMix(KT201-02,北京天根生化有限公司)。
1.2方法
1.2.1质谱和生化鉴定
对86株肠球菌开展基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)质谱鉴定和VITEK 2 COMPACT生化鉴定,鉴定结果不一致的菌株,再分别开展API 20 Strep试剂条手工鉴定、16S rRNA和23S rRNA分子鉴定。MALDI-TOF-MS、VITEK 2 COMPACT革兰阳性细菌鉴定和API 20 Strep试剂条的使用方法按说明书进行。
1.2.2分子鉴定
模板制备:用无菌接种环挑取BHA平板上培养的肠球菌菌苔,在200 μl无菌超纯水中混匀,加入5 μl玻璃珠涡旋振荡5 min后,于100 ℃水浴中加热10 min,13 000 r/min离心2 min,上清液即为制备好的DNA模板,将DNA模板转于另一无菌离心管中备用。引物合成:根据细菌高度保守的16S rRNA和23S rRNA[7]序列分别设计引物27F/1492R和简并引物23F/23R,扩增片段长度分别为1.5 kb和400 bp。16S rRNA序列的引物信息为:27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTAC CTTGTTACGACTT-3′;23S rRNA序列的引物信息为:23F:5′-GCGATTTCYGAAYGGGGRAACCC-3′(Y代表C或T,R代表A或G),23R:5′-TTCGCCT TTCCCTCACGGTACT-3′[8]。PCR反应体系(50μl):PCR Mix 25 μl,上下游引物各1 μl,ddH2O 22 μl,DNA模板1 μl。PCR反应条件为:95 ℃预变性6 min;95 ℃变性0.5 min,55 ℃退火0.5 min,72 ℃延伸1 min,30个循环;72 ℃延伸7 min。16S rRNA和23S rRNA基因的测序结果使用美国国家生物技术信息中心(NCBI)网站的BLAST工具在数据库中进行序列比对,得分最高的比对结果认为是被检肠球菌所属菌种。
1.2.3药敏检验
按照美国临床和实验室标准委员会(Clinical and Laboratory Standards Institute,CLSI)推荐的微量肉汤稀释法[9],测定受试菌株对氨苄西林(AMP)、青霉素(PEN)、红霉素(ERY)、环丙沙星(CIP)、达托霉素(DAP)、万古霉素(VAN)、四环素(TET)、氯霉素(CHL)、高浓度庆大霉素(HLGR,250和500 μg/ml)和高浓度链霉素(HLSR, 500和1 000 μg/ml)等抗生素的最小抑菌浓度(minimum inhibitory concentration,MIC)。并参照CLSI M100-S25[9]文件表2D推荐的标准进行结果判定和解释。药敏质控菌株为粪肠球菌(ATCC 29212)。
2 结果与分析
2.1肠球菌种水平鉴定方法比较
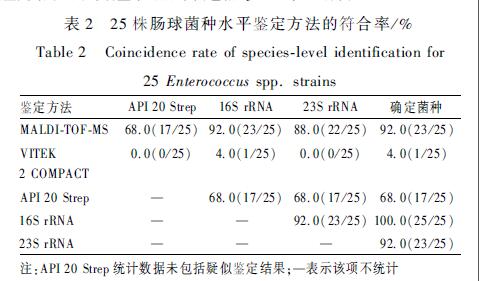
使用MALDI-TOF-MS和VITEK 2 COMPACT开展菌种鉴定的结果中,有70.9%(61/86)肠球菌的鉴定结果一致,25株鉴定结果不一致。对这25株菌分别使用API 20 Strep、16S rRNA和23S rRNA基因测序再次开展鉴定,鉴定结果如表1所示。在使用5种方法鉴定的25株菌中,1株菌(R16-C2)出现了4种不同鉴定结果,6株菌出现了3种不同鉴定结果,对这7株菌取鉴定一致结果,作为最终鉴定菌种。如表1所示,使用API 20 Strep开展种水平鉴定的结果中,28.0%(7/25)的鉴定结果分值低于80%,即结果可疑,需要附加试验进一步确认。16S rRNA和23S rRNA基因鉴定结果的符合率为92.0%(23/25),16S rRNA 鉴定W3-E1和R16-C2的结果分别为希拉肠球菌和泰国肠球菌,但23S rRNA鉴定结果是坚韧肠球菌和屎肠球菌。MALDI-TOF-MS和VITEK 2 COMPACT鉴定D1-K1的结果分别为德氏肠球菌和棉子糖肠球菌,16S rRNA和23S rRNA分子鉴定结果为粪肠球菌,API 20 Strep鉴定结果疑似粪肠球菌,最终取粪肠球菌鉴定结果。
|
表1北京市集贸市场生鲜猪肉肠球菌种水平鉴定(n=25) Table 1Species-level identification of Enterococcus spp. isolated from a raw pork farm market in Beijing |
|
表225株肠球菌种水平鉴定方法的符合率/% Table 2Coincidence rate of species-level identification for 25 Enterococcus spp. strains |
2.2北京市集贸市场生鲜猪肉肠球菌的种水平分布特征
根据鉴定结果,86株分离自北京市集贸市场环境和生鲜猪肉的肠球菌中,粪肠球菌占82.6%(71/86),希拉肠球菌占14.0%(12/86),屎肠球菌占1.2%(1/86),蒙氏肠球菌占1.2%(1/86),泰国肠球菌占1.2%(1/86)。北京市集贸市场地面涂抹样品来源的29株肠球菌中,粪肠球菌占89.7%(26/29),希拉肠球菌占10.3%(3/29);墙壁涂抹样品来源的14株菌全部是粪肠球菌;污水样品来源的21株菌中,粪肠球菌占61.9%(13/21),希拉肠球菌占28.6%(6/21),屎肠球菌和蒙氏肠球菌各占4.8%(1/21);生鲜猪肉样品来源的22株菌中,粪肠球菌占81.8%(18/22),希拉肠球菌占13.6%(3/22),泰国肠球菌占4.5%(1/22)。污水和生鲜猪肉中肠球菌种水平多样性高于墙壁和地面涂抹样品。
2.3北京市集贸市场生鲜猪肉肠球菌种水平耐药特征
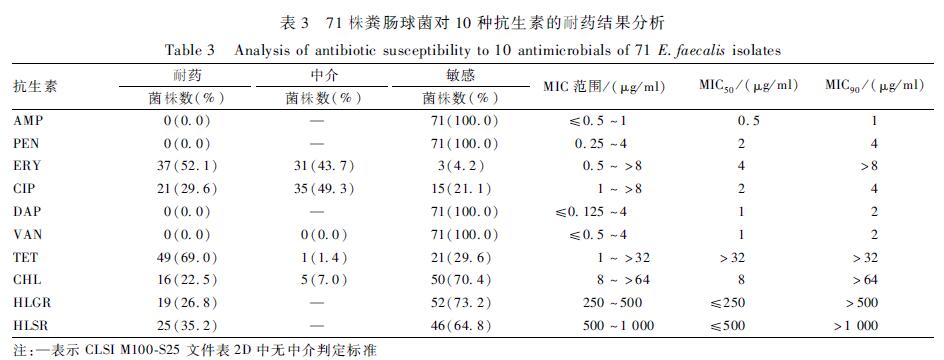
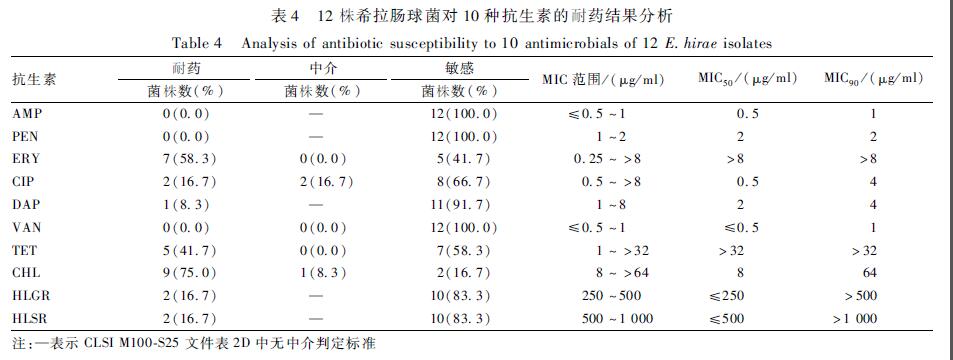
在受试的10种抗生素中,71株粪肠球菌对TET、ERY、HLSR、CIP、HLGR和CHL的耐药率分别为69.0%(49/71)、52.1%(37/71)、35.2%(25/71)、29.6%(21/71)、26.8%(19/71)和22.5%(16/71)。所有受试粪肠球菌菌株对AMP、PEN、DAP和VAN均敏感,见表3。可以看出,TET抑制50%受试菌株生长所需抗生素浓度(MIC50)>32 μg/ml,已高于耐药折点,说明在10种受试抗生素中粪肠球菌对TET耐药最为严重。CIP、ERY、CHL、HLGR和HLSR抑制90%受试菌株生长所需抗生素浓度(MIC90)均高于耐药折点,说明粪肠球菌对以上5种抗生素也已显示高耐药性。耐受3种及以上抗生素的菌株有26株,占所有受试粪肠球菌的36.6%(26/71),有8株粪肠球菌耐受6种抗生素,耐药谱为ERY-CIP-TET-CHL-HLGR-HLSR。12株希拉肠球菌对CHL、ERY、TET的耐药率分别为75.0%(9/12)、58.3%(7/12)和41.7%(5/12),对CIP、HLSR和HLGR的耐药率均为16.7%(2/12),见表4。另外,有1株分离自生鲜猪肉的希拉肠球菌对DAP耐药。12株希拉肠球菌中,33.3%(4/12)的菌株对3种及以上抗生素耐药,其中1株分离自地面涂抹样品的D2-C2对5种抗生素耐受,耐药谱为ERY-TET-CHL-HLGR-HLSR。
|
表371株粪肠球菌对10种抗生素的耐药结果分析 Table 3Analysis of antibiotic susceptibility to 10 antimicrobials of 71 E.faecalis isolates |
|
表412株希拉肠球菌对10种抗生素的耐药结果分析 Table 4Analysis of antibiotic susceptibility to 10 antimicrobials of 12 E.hirae isolates |
3讨论
不同种属肠球菌的分布特点、致病宿主以及耐药特征有较大差异,因此了解不同基质中肠球菌的种属分布,对于研究耐药肠球菌的流行规律和传播途径具有重要意义。然而,传统肠球菌的种水平鉴定方法需要做一系列复杂的生理生化试验,难以满足高通量菌种鉴定的要求[10]。国外常使用种特异PCR扩增和16S rRNA测序相结合对肠球菌开展种水平鉴定,但种特异PCR目前仅局限于几种常见肠球菌,且存在一定错误率[4],因此急需发展快速、准确、批量处理的种水平鉴定策略。本研究使用的5种肠球菌种水平鉴定方法各有优缺点。MALDI-TOF-MS适合于高通量菌种鉴定,速度快、耗材少、准确性较高[5],但缺点是仪器昂贵、维护费用高,不适合在基层单位推广。VITEK 2 COMPACT鉴定自动化程度高,但用于肠球菌种水平鉴定准确性较低。本研究中,使用VITEK 2 COMPACT鉴定肠球菌的准确率仅为4.0%(1/25),与文献报道[8,11]相似,这可能是由于VITEK 2 COMPACT是根据一套生化反应结果鉴定菌种,如果菌株在培养过程中生化特性发生改变,必然导致鉴定结果不同。API 20 Strep试剂条虽然鉴定结果准确,但菌种鉴定范围有限,只能用于粪肠球菌、屎肠球菌、铅黄肠球菌、坚韧肠球菌、鹑鸡肠球菌、鸟肠球菌等6种肠球菌的种鉴定,且手工操作复杂,有时还需做补充生化试验,在本研究中就出现了较多(28.0%,7/25)可疑鉴定结果。有文献[8,12]报道,16S rRNA序列难以把粪肠球菌和屎肠球菌区分,应使用23S rRNA进行肠球菌种水平鉴定。但从本研究结果看,16S rRNA序列分析对肠球菌有准确的区分度;因此,优化的肠球菌种水平鉴定策略是,先用MALDI-TOF-MS和16S rRNA序列分析技术对肠球菌进行种鉴定,二者不一致的结果再使用其他方法进一步确认。北京市集贸市场生鲜猪肉源肠球菌中,粪肠球菌占绝对优势,其次是希拉肠球菌,只发现了1株屎肠球菌,这一结果和人与动物消化道、粪便、医院、食品分离肠球菌中,粪肠球菌和屎肠球菌是主要优势菌种的报道[13-14]不符。2014年中国细菌耐药性监测网收集的6 891株肠球菌中,粪肠球菌和屎肠球菌分别占45.4%和48.1%,其他肠球菌占6.5%[15]。但在美国环境水样品中,铅黄肠球菌占34%,粪肠球菌占25%,蒙氏肠球菌占15%,屎肠球菌仅占5%[4]。这说明不同来源样品中肠球菌的种属分布特征不同。而且,本研究中来自污水和生鲜猪肉的肠球菌显示了种水平的多样性,这可能与市场环境开放,污水和生鲜猪肉污染途径多渠道有关。粪肠球菌对CIP、TET、HLSR和HLGR的耐药率均高于希拉肠球菌,但对ERY和CHL的耐药率均低于希拉肠球菌,尤其是对CHL的耐药率远低于希拉肠球菌。另外,在希拉肠球菌中还发现了1株对DAP耐药的肠球菌,是较为罕见的耐药表型,提示今后应加强关注希拉肠球菌耐药性。2014年中国细菌耐药性监测网统计数据显示,粪肠球菌对抗生素的耐药率明显低于屎肠球菌,但对CHL的耐药率高于屎肠球菌,粪肠球菌和屎肠球菌均对HLGR表现出较高耐药率[15]。目前国内外对除粪肠球菌和屎肠球菌以外的肠球菌的耐药性研究较少,本研究中分离的蒙氏肠球菌和泰国肠球菌均未呈现较强耐药性。本研究评价和比较了肠球菌种水平快速鉴定方法,初步阐述了北京市集贸市场肠球菌种属分布特征,分析了不同种肠球菌的耐药特征,为控制食源性耐药肠球菌的产生和传播积累了基础数据和信息支持。
参考文献
[1]BONACINA J, SUAREZ N, HORMIGO R, et al. A genomic view of food-related and probiotic Enterococcus strains[J]. DNA Res, 2016, 24(1):1-14.
[2]彭子欣, 王伟, 胡豫杰, 等. 食品及环境样品中肠球菌快速检验方法的建立及优化[J]. 食品安全质量检测学报, 2016, 7(6): 2240-2246.
[3]GIRAFFA G. Enterococci from foods[J]. FEMS Microbiol Rev, 2002, 26 (2): 163-171.
[4]RYU H, HENSON M, ELK M, et al. Development of quantitative PCR assays targeting the 16S rRNA genes of Enterococcus spp. and their application to the identification of Enterococcus species in environmental samples[J]. Appl Environ Microbiol, 2013, 79(1):196-204.
[5]周春妹. Vitek MS在临床常见细菌鉴定中的应用评价[D].上海:复旦大学,2014.
[6]彭子欣,张爽,王伟,等.北京市集贸市场生鲜猪肉肠球菌的耐药特征分析[J].中国食品卫生杂志, 2016, 28(6):736-741.
[7]李爽, 张正. 肠球菌API、VITEK 2、23S rRNA鉴定结果的比较与分析[J]. 北京医学, 2006, 28(5):288, 294.
[8]ANTHONY M , BROWN J, FRENCH L. Rapid diagnosis of bacteremia by universal amplification of 23S ribosomal DNA followed by hybridization to an oligonucleotide array[J]. J Clin Microbiol, 2000, 38(2):781-788.
[9]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing:twenty-fourth informational supplement:M100-S24 [S]. Wayne: CLSI, 2016.
[10]江希武, 郭素琴, 胡克雨, 等. 130株肠球菌属(种)的分离鉴定[J]. 中华预防医学杂志, 1994, 28(1):55-56.
[11]王亚宾, 张红英, 陈丽颖, 等. 16S rRNA与Vitek-32对临床感染猪肠球菌鉴定结果比较[J]. 中国农学通报, 2009, 25(6): 9-12.
[12]李梅花, 王芳, 孙婷, 等. 自然发酵乳中粪肠球菌和屎肠球菌的4种鉴定方法的比较[J]. 食品与发酵工业, 2011, 37(9):98-103.
[13]刘佳, 陈霞, 雷红, 等. 肠球菌种属鉴定及万古霉素耐药基因型检测的多重聚合酶链反应方法的建立及应用[J]. 疾病监测, 2015, 30(4):332-336.
[14]李东冬, 陈荣, 沈定霞, 等. 致血流感染的肠球菌耐药现状及分子流行特征的研究[J]. 中国抗生素杂志, 2014, 39(5):370-374.
[15]胡付品, 朱德妹, 汪复, 等. 2014年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2015, 15(5):401-410.
[2]彭子欣, 王伟, 胡豫杰, 等. 食品及环境样品中肠球菌快速检验方法的建立及优化[J]. 食品安全质量检测学报, 2016, 7(6): 2240-2246.
[3]GIRAFFA G. Enterococci from foods[J]. FEMS Microbiol Rev, 2002, 26 (2): 163-171.
[4]RYU H, HENSON M, ELK M, et al. Development of quantitative PCR assays targeting the 16S rRNA genes of Enterococcus spp. and their application to the identification of Enterococcus species in environmental samples[J]. Appl Environ Microbiol, 2013, 79(1):196-204.
[5]周春妹. Vitek MS在临床常见细菌鉴定中的应用评价[D].上海:复旦大学,2014.
[6]彭子欣,张爽,王伟,等.北京市集贸市场生鲜猪肉肠球菌的耐药特征分析[J].中国食品卫生杂志, 2016, 28(6):736-741.
[7]李爽, 张正. 肠球菌API、VITEK 2、23S rRNA鉴定结果的比较与分析[J]. 北京医学, 2006, 28(5):288, 294.
[8]ANTHONY M , BROWN J, FRENCH L. Rapid diagnosis of bacteremia by universal amplification of 23S ribosomal DNA followed by hybridization to an oligonucleotide array[J]. J Clin Microbiol, 2000, 38(2):781-788.
[9]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing:twenty-fourth informational supplement:M100-S24 [S]. Wayne: CLSI, 2016.
[10]江希武, 郭素琴, 胡克雨, 等. 130株肠球菌属(种)的分离鉴定[J]. 中华预防医学杂志, 1994, 28(1):55-56.
[11]王亚宾, 张红英, 陈丽颖, 等. 16S rRNA与Vitek-32对临床感染猪肠球菌鉴定结果比较[J]. 中国农学通报, 2009, 25(6): 9-12.
[12]李梅花, 王芳, 孙婷, 等. 自然发酵乳中粪肠球菌和屎肠球菌的4种鉴定方法的比较[J]. 食品与发酵工业, 2011, 37(9):98-103.
[13]刘佳, 陈霞, 雷红, 等. 肠球菌种属鉴定及万古霉素耐药基因型检测的多重聚合酶链反应方法的建立及应用[J]. 疾病监测, 2015, 30(4):332-336.
[14]李东冬, 陈荣, 沈定霞, 等. 致血流感染的肠球菌耐药现状及分子流行特征的研究[J]. 中国抗生素杂志, 2014, 39(5):370-374.
[15]胡付品, 朱德妹, 汪复, 等. 2014年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2015, 15(5):401-410.
 彭子欣,张思雨,闫韶飞,王帅,王伟,张建中,李凤琴.北京市集贸市场生鲜猪肉肠球菌种水平鉴定及耐药特征[J].中国食品卫生杂志,2017,29(3):283-288.
彭子欣,张思雨,闫韶飞,王帅,王伟,张建中,李凤琴.北京市集贸市场生鲜猪肉肠球菌种水平鉴定及耐药特征[J].中国食品卫生杂志,2017,29(3):283-288.