DOi:10.13590/j.cjfh.2017.03.003
己烯雌酚、邻苯二甲酸二丁酯和丙基硫脲嘧啶对小鼠垂体瘤神经细胞增殖的联合作用研究
(1.山西医科大学公共卫生学院,山西 太原030001; 2.国家食品安全风险评估中心 卫生部食品安全风险评估重点实验室,北京100021)
作者简介: 康静女硕士生研究方向为内分泌干扰物E-mail:1099715460@qq.com
通信作者: 裴秋玲女教授研究方向为分子毒理学E-mail:924969007@qq.com 刘兆平男研究员研究方向为食品毒理学和化学物风险评估E-mail:liuzhaoping@cfsa.net.cn
收稿日期: 2017-02-17
基金项目: 国家自然科学基金项目(81273081)
摘要:目的 探讨己烯雌酚(DES)、邻苯二甲酸二丁酯(DBP)、丙基硫脲嘧啶(PTU)对小鼠垂体瘤神经细胞(GT1-7神经细胞)的增殖效应及其联合作用。方法DES的剂量为0.1、1、10、100、1 000 μmol/L,DBP的剂量为0.01、1、10、100、1 000 μmol/L,PTU的剂量为0.000 1、0.01、1、100、1 000 μmol/L。联合作用的剂量设计为DES 0.1~1 000 μmol/L,DBP 0.01 μmol/L,PTU 0.000 1 μmol/L。采用CCK-8法检测3种物质单独作用和联合作用24 h后GT1-7神经细胞存活率。结果DES、DBP单独作用于细胞,随DES或DBP浓度的增大细胞存活率呈现先增加后降低的趋势。PTU单独作用于细胞,各组的细胞存活率与对照组比较有所增加,但基本维持在一定水平。DES、DBP、PTU单独作用时,其浓度分别低于10、100、1 000 μmol/L时,GT1-7神经细胞存活率在90%以上。DES与DBP联合暴露时,细胞存活率随DES浓度的增加而降低。DES与PTU联合暴露时,细胞存活率随DES浓度增加表现为先增加后降低,DBP与PTU联合暴露时,细胞存活率随DBP浓度增加表现为先增加后降低。与DES单独作用体系比较,0.01 μmol/L DBP和0.000 1 μmol/L PTU同时加入到0~10 μmol/L DES后细胞存活率明显增加,差异有统计学意义(P<0.05),而DES浓度为100 μmol/L时细胞存活率由80%左右降至4%左右,差异有统计学意义(P<0.05)。结论DES、DBP、PTU对GT1-7神经细胞的增殖效应呈先促进后抑制的趋势,3种物质在一定剂量下共同作用对GT1-7神经细胞增殖呈现联合作用。
关键词:
己烯雌酚; 邻苯二甲酸二丁酯; 丙基硫脲嘧啶; GT1-7神经细胞; 联合作用; 细胞毒性; 神经细胞
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)03-0264-05
Study of the joint effect of disthylstilbestrol, dibutyl phthalate and propyl thiouracil
exposure on GT1-7 cells proliferation
exposure on GT1-7 cells proliferation
(1.School of Public Health,Shanxi Medical University,Shanxi Taiyuan 030001,China; 2.Key Laboratory of Food Safety Risk Assessment of Ministry of Health,China National Center for Food Safety Risk Assessment,Beijing 100021,China)
Abstract: Objective The single toxicity and joint toxicity of disthylstilbestrol(DES), dibutyl phthalate(DBP)and propyl thiouracil(PTU)to the proliferation of GT1-7 cells were investigated. MethodsThe dose of DES was 0.1, 1, 10, 100 and 1 000 μmol/L, the dose of DBP was 0.01, 1, 10, 100 and 1 000 μmol/L, and the dose of PTU was 0.000 1, 0.01, 1,100 and 1 000 μmol/L. The dose of joint toxicity were DES(0.1-1 000 μmol/L), DBP(0.01 μmol/L) and PTU(0.000 1 μmol/L). The cell counting Kit-8 was used to evaluate the viability of GT1-7 cells under DES, DBP and PTU alone or combined exposure. ResultsWhen DES and DBP exposed alone, the viability of GT1-7 cells increased at first and then decreased with the higher dose. Compared with the control group ,the viability of GT1-7 cells exposed to PTU increased and maintained at a certain level. When the concentration of DES, DBP and PTU was below 10, 100 and 1 000 μmol/L, the viability of GT1-7 cells was above 90%. When DES and DBP, DES and PTU combined exposed to GT1-7 cells, the viability was increased first and then decreased with the increase of DES concentration. When DBP and PTU combined exposed, then cell viability had the same change. When 0.01 μmol/L DBP and 0.000 1 μmol/L PTU added to 0-10 μmol/L DES, the cell viability increased obviously, and the difference was significant(P<0.05).But when concentration increased to 100 μmol/L DES, the cell viability was decreased from 80% to 4%, and the difference was significant(P<0.05). ConclusionWhen DES, DBP and PTU was exposed to GT1-7 cells, the cell proliferation increased at first and then decreased. When they were combined at a certain concentration, it showed a joint effect of cell proliferation on GT1-7 cells.
Key words:
Disthylstilbestrol; dibutyl phthalate; propyl thiouracil; GT1-7 cells; joint toxicity effect; cytotoxicity; nerve cell
根据生物学效应或作用靶点不同,内分泌干扰物(EEDs)可分为类雌激素物质、抗雄激素物质和甲状腺干扰物质[1],己烯雌酚(DES)、邻苯二甲酸二丁酯(DBP)和丙基硫脲嘧啶(PTU)是3种常见的内分泌干扰物。课题组前期研究发现,3种内分泌干扰物作用类型存在差异,DES主要作用于子宫,DBP作用于提肛肌-海面体肌和尿道球腺,PTU作用于甲状腺。DES能扰乱机体内分泌系统的正常功能[2],DBP可降低颗粒细胞分泌的雌二醇和孕酮水平[3],动物试验[4]发现DBP还会降低机体雄激素,提高雌二醇水平。研究[5]表明PTU有升高血清促甲状腺素、降低血清三碘甲腺原氨酸和甲状腺素的作用。已有国内外研究[6-7]发现,不同类型内分泌干扰物(DES、DBP和PTU)单独暴露会影响下丘脑-垂体系统,改变动物的神经行为[8],体外试验[9]发现其对神经细胞的增殖也会产生明显的抑制作用,提示神经系统可能是3类不同内分泌干扰物的共同作用靶点。有些研究提示,不同类型内分泌干扰物共存时,可能对神经系统具有联合毒性。刘红阳等[10]研究发现铅和DBP联合暴露于斑马鱼胚胎对神经相关基因表达产生影响。殷金珠[11]研究发现铝、苯并芘(BaP)联合作用于大鼠神经细胞,会使其凋亡并具有联合作用,联合作用类型为协同作用。本试验旨在利用神经细胞模型研究DES、DBP和PTU的联合作用模式,为下一步研究这3种物质对神经系统的联合作用及其机制提供依据。
己烯雌酚(DES)、邻苯二甲酸二丁酯(DBP)、丙基硫脲嘧啶(PTU)、二甲基亚砜(DMSO)均购自美国Sigma,胎牛血清(fetal bovine serum,FBS)、DMEM细胞培养液均购自德国Invitrogen Gibco,细胞计数试剂盒8(CCK-8,日本同仁化学研究所)。
0.000 1~1 000 μmol/L PTU能促进GT1-7神经细胞的增殖。有研究[12]发现DES有神经毒性作用,能够促进海马神经干细胞的增殖分化。也有研究[13]发现大鼠孕期染DBP会影响子代神经干细胞的增殖与分化,从而影响神经系统的发育,随着DBP浓度的增大,正常新生大鼠神经干细胞的细胞活性降低。DICKERSON等[14]研究发现同属拟甲状腺激素类的多氯联苯(PCBs)类物质,对GT1-7神经细胞具有神经毒性作用。内分泌干扰物的联合作用模式除了与受试物有关外,剂量选择也是影响联合作用结果的重要因素。本试验根据前期试验结果,选择DES(0.1~1 000 μmol/L)作为主要物质,将DBP和PTU与之联合,后者剂量选择的原则包括:细胞存活率达90%或以上、具有明显效应且是最低的效应剂量(基于内分泌干扰物的低剂量效应特性)。根据单独试验结果,DBP和PTU的联合暴露剂量分别为0.01和0.000 1 μmol/L。以往研究[15]表明,不同类型的内分泌干扰物在神经毒性方面存在联合作用。邻苯二甲酸二辛酯(DOP)和砷(As)联合暴露对小鼠神经毒性的联合作用类型表现为协同作用、拮抗作用。铝和BaP对大鼠神经细胞凋亡具有联合作用,联合作用类型为协同作用[11]。砷和DBP联合暴露对斑马鱼胚胎具有一定的神经毒性,但对神经发育的相关基因无交互作用[10]。经本试验研究发现DES、DBP和PTU这3种不同类型的内分泌干扰物对GT1-7神经细胞毒性有联合作用。试验结果表明,当DBP与DES、PTU与DES、以及DBP、PTU与DES联合暴露,细胞存活率随DES浓度的增加表现为先增加后降低的趋势,提示一定浓度的DBP、PTU与DES联合能促进GT1-7神经细胞增殖。与DES单独作用比较,在DBP和PTU中同时加入0.1~10 μmol/L DES后细胞存活率明显增加,提示DES、DBP、PTU以一定浓度联合作用时能促进GT1-7神经细胞增殖。DBP和PTU同时加入100 μmol/L DES,细胞存活率由80%快速降至4%左右,该过程机制尚不清楚,初步提示在该浓度下3种物质联合作用时对GT1-7神经细胞毒性可能产生协同或相加作用,具体联合作用模式和机制需要进一步研究。本试验结果可作为后期试验剂量设计依据,应用于探讨不同内分泌干扰物对神经内分泌方面的联合作用及其作用模式和机制的剂量设计中,从而为该类物质的风险评估和风险管理提供科学依据。
1材料与方法
1.1材料
1.1.1细胞来源
小鼠垂体瘤神经细胞(GT1-7神经细胞)由军事医学科学院彭双清教授馈赠。
1.1.2主要仪器与试剂
细胞培养箱(上海恒科技仪器有限公司),Nanodrop 2000微量分光光度计(美国Thermo Scientific)。己烯雌酚(DES)、邻苯二甲酸二丁酯(DBP)、丙基硫脲嘧啶(PTU)、二甲基亚砜(DMSO)均购自美国Sigma,胎牛血清(fetal bovine serum,FBS)、DMEM细胞培养液均购自德国Invitrogen Gibco,细胞计数试剂盒8(CCK-8,日本同仁化学研究所)。
1.2方法
1.2.1细胞培养
用含10%胎牛血清的DMEM培养液培养GT1-7神经细胞,条件为5%CO2、37 ℃,待细胞生长至70%~80%融合时进行相关试验。
1.2.2DES、DBP和PTU剂量设计
DES剂量为0.1、1、10、100、1 000 μmol/L,DBP剂量为0.01、1、10、100、1 000 μmol/L,PTU剂量为0.000 1、0.01、1、100、1 000 μmol/L。联合作用的剂量设计为DES 0.1~1 000 μmol/L,DBP 0.01 μmol/L,PTU 0.000 1 μmol/L。
1.2.3不同浓度DES、DBP和PTU单独暴露以及联合暴露对GT1-7细胞增殖的影响
将GT1-7神经细胞以8 000个/孔接种于96孔板中,用含有10%胎牛血清的培养液培养24 h,待细胞完全贴壁并开始增殖后,换为无血清DMEM培养液,继续培养12 h,使细胞饥饿达到同步化。继而加入各浓度的受试物培养,染毒24 h后,弃上清,加入CCK-8继续温育1 h,于酶标仪上检测吸光度(OD),计算细胞相对存活率。每个剂量6个平行,试验重复3次。细胞相对存活率的计算方法:细胞存活率=(OD染毒组-OD背景对照)/(OD对照组-OD背景对照)×100%。
1.3统计学分析
试验结果以均数±标准差(±s)表示,采用SPSS 19.0软件进行单因素方差分析,方差齐时组间均数比较采用LSD法,方差不齐时组间均数比较采用Dunnetts法,设定检验水准α=0.05,P<0.05为差异有统计学意义。
2结果
2.1DES、DBP和PTU单独暴露对GT1-7神经细胞增殖的影响
如图1A、1B所示,随着DES、DBP浓度的增加,细胞存活率表现为先增加后降低,不同的是DES在浓度为1 000 μmol/L时细胞存活率明显降低(5%),而DBP没有。在DES和DBP单独暴露时,浓度分别为0.1~10和0.01~100 μmol/L,细胞存活率大于90%。图1C所示,随着PTU浓度的增加,细胞存活率也增加,并在PTU浓度为0.000 1 μmol/L时达到峰值,在0.01~1 000 μmol/L时细胞存活率维持在一定水平,且各浓度作用下的细胞存活率都在90%以上。

|
注:图1A为不同浓度DES对GT1-7神经细胞增殖的影响;图1B为不同浓度DBP对GT1-7神经细胞增殖的影响; 图1C为不同浓度PTU对GT1-7神经细胞增殖的影响;*表示与对照组比较,P<0.001 图1不同浓度受试物对GT1-7神经细胞增殖的影响 Figure 1Effects of different concentrations of DES、DBP、PTU on proliferation of GT1-7 cells |
2.2DES、DBP、PTU两两联合暴露对GT1-7神经细胞增殖的影响
试验结果如图2。图2A所示,0.01 μmol/L DBP加入DES中,细胞存活率随DES浓度的增加呈降低趋势。图2B所示,0.000 1 μmol/L PTU加入DES中,细胞存活率随DES浓度的增加呈先增后降趋势。如图2A和2B所示,与DES单独作用比较,DBP或PTU加入到100 μmol/L DES中,细胞存活率均表现为大幅度降低。图2C所示,0.000 1 μmol/L PTU加入DBP中,细胞存活率随DBP浓度的增加呈先增后降趋势。与0.01 μmol/L DBP单独暴露时的细胞存活率比较,在其中加入0.000 1 μmol/L PTU后细胞存活率有所增加,差异有统计学意义(P<0.05)。注:图2A中 表示与DES单独暴露组比较,P<0.05;﹟表示与0.01 μmol/L DBP组比较,P<0.05;图2B中 表示与DES单独暴露组比较,P<0.05;﹟表示与0.000 1 μmol/L PTU组比较,P<0.05;图2C中 表示与DBP单独暴露组比较,P<0.05;﹟#表示与0.000 1 μmol/L PTU组比较,P<0.001
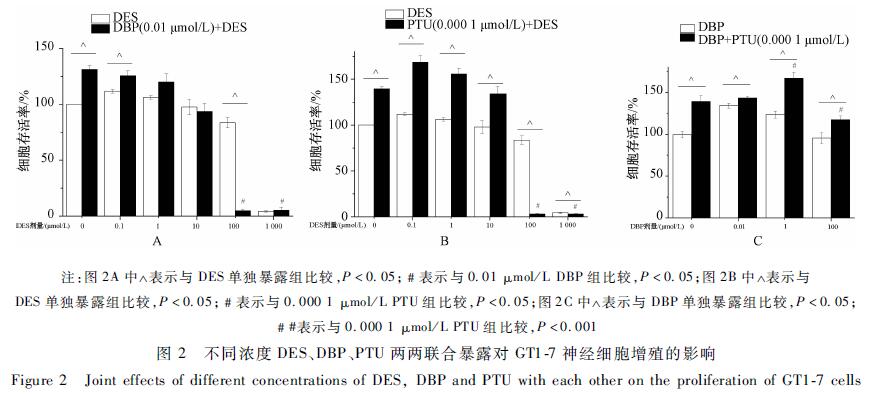
|
图 2不同浓度DES、DBP、PTU两两联合暴露对GT1-7神经细胞增殖的影响 Figure 2Joint effects of different concentrations of DES, DBP and PTU with each other on the proliferation of GT1-7 cells |
2.3DES、DBP、PTU三者联合暴露对GT1-7神经细胞增殖的影响
由图3可知,当0.01 μmol/L DBP、0.000 1 μmol/L PTU加入DES中,细胞存活率随DES浓度的增加呈现先增加后降低的趋势。三者联合作用,DES浓度为0.1 μmol/L时的细胞存活率达峰值。与同剂量DES单独暴露比较,在加入DBP和PTU后,0.1、1、10 μmol/L DES剂量组的细胞存活率增加,差异有统计学意义(P<0.05);100、1 000 μmol/L DES剂量组的细胞存活率降低,差异有统计学意义(P<0.05),且DES为100 μmol/L时,细胞存活率由80%左右迅速降至4%左右。

|
注: 表示与DES单独暴露组比较,P<0.05;﹟表示 与0.01 μmol/L DBP+0.000 1 μmol/L PTU组比较,P<0.001 图3不同浓度DES、DBP、PTU三者联合暴露对 GT1-7神经细胞增殖的影响 Figure 3Joint effects of different concentrations of DES, DBP and PTU on proliferation of GT1-7 cells |
3讨论
本试验采用永生化的下丘脑GnRH神经元细胞模型GT1-7细胞系,研究3种不同类型内分泌干扰物单独和联合暴露时的神经毒性。试验结果初步提示DES和DBP对GT1-7神经细胞的增殖作用可能存在低剂量促进、高剂量抑制的倒U型剂量-反应关系。0.000 1~1 000 μmol/L PTU能促进GT1-7神经细胞的增殖。有研究[12]发现DES有神经毒性作用,能够促进海马神经干细胞的增殖分化。也有研究[13]发现大鼠孕期染DBP会影响子代神经干细胞的增殖与分化,从而影响神经系统的发育,随着DBP浓度的增大,正常新生大鼠神经干细胞的细胞活性降低。DICKERSON等[14]研究发现同属拟甲状腺激素类的多氯联苯(PCBs)类物质,对GT1-7神经细胞具有神经毒性作用。内分泌干扰物的联合作用模式除了与受试物有关外,剂量选择也是影响联合作用结果的重要因素。本试验根据前期试验结果,选择DES(0.1~1 000 μmol/L)作为主要物质,将DBP和PTU与之联合,后者剂量选择的原则包括:细胞存活率达90%或以上、具有明显效应且是最低的效应剂量(基于内分泌干扰物的低剂量效应特性)。根据单独试验结果,DBP和PTU的联合暴露剂量分别为0.01和0.000 1 μmol/L。以往研究[15]表明,不同类型的内分泌干扰物在神经毒性方面存在联合作用。邻苯二甲酸二辛酯(DOP)和砷(As)联合暴露对小鼠神经毒性的联合作用类型表现为协同作用、拮抗作用。铝和BaP对大鼠神经细胞凋亡具有联合作用,联合作用类型为协同作用[11]。砷和DBP联合暴露对斑马鱼胚胎具有一定的神经毒性,但对神经发育的相关基因无交互作用[10]。经本试验研究发现DES、DBP和PTU这3种不同类型的内分泌干扰物对GT1-7神经细胞毒性有联合作用。试验结果表明,当DBP与DES、PTU与DES、以及DBP、PTU与DES联合暴露,细胞存活率随DES浓度的增加表现为先增加后降低的趋势,提示一定浓度的DBP、PTU与DES联合能促进GT1-7神经细胞增殖。与DES单独作用比较,在DBP和PTU中同时加入0.1~10 μmol/L DES后细胞存活率明显增加,提示DES、DBP、PTU以一定浓度联合作用时能促进GT1-7神经细胞增殖。DBP和PTU同时加入100 μmol/L DES,细胞存活率由80%快速降至4%左右,该过程机制尚不清楚,初步提示在该浓度下3种物质联合作用时对GT1-7神经细胞毒性可能产生协同或相加作用,具体联合作用模式和机制需要进一步研究。本试验结果可作为后期试验剂量设计依据,应用于探讨不同内分泌干扰物对神经内分泌方面的联合作用及其作用模式和机制的剂量设计中,从而为该类物质的风险评估和风险管理提供科学依据。
参考文献
[1]万一聪,张林,姜旖,等.己烯雌酚对HOSE细胞中HOXA10基因表达及DNA甲基化的影响[J].江苏医药,2012,38(18):2113-2115.
[2]PIROLI G,TORRES A,GRILLO C,et al.Mechanisms in progestin antagonism of pituitary tumorigenesis[J].Journal of Steroid Biochemistry and Molecular Biology,1998,64(1/2):59-67.
[3]王雪金,周云清,罗湘闽,等.邻苯二甲酸二丁酯对雌性大鼠卵巢颗粒细胞分泌功能的影响[J].中国组织工程研究,2014,18(42):6779-6783.
[4]李荔群.邻苯二甲酸二丁酯对子代生殖发育毒性的影响及相关人群暴露途径的研究[D].上海:复旦大学,2012.
[5]YAMADA T,KUNIMATSU T,MIYATA K,et al.Enhanced rat hershberger assay appears reliable for detection of not only (anti-)androgenic chemicals but also thyroid hormone modulators[J].Toxicological Sciences,2004,79(1):64-74.
[6]时国庆,李栋,卢晓坤,等.环境内分泌干扰物质的健康影响与作用机制[J].环境化学,2011,30(1):211-223.
[7]杜娟,潘红艳,宫智勇.己烯雌酚对生殖系统的影响及机制的研究进展[J].中国药理学与毒理学杂志,2012,26(4):588-590.
[8]田雨.DBP和DEHP在雄性大鼠体内的毒代动力学研究[D].银川:宁夏医科大学,2014.
[9]朱才众,熊鸿燕,李亚斐,等.增塑剂邻苯二甲酸二丁酯低剂量与神经系统毒性效应的评估[J].中国组织工程研究,2006,10(8):76-78.
[10]刘红阳,茆广华,许海,等.铅和邻苯二甲酸二丁酯联合暴露对斑马鱼胚胎的影响[J].生物技术进展,2016,6(4):249-254.
[11]殷金珠.低剂量BaP、铝联合染毒对原代大鼠神经细胞凋亡的协同作用[D].太原:山西医科大学,2014.
[12]汪洪杰,赵正梅,刘东梅.己烯雌酚对胎鼠海马神经干细胞增殖与分化的影响[J].蚌埠医学院学报,2009,34(8):662-665.
[13]罗芬兰,蔡文琴,张吉强.大鼠孕期染邻苯二甲酸二丁酯对子代神经干细胞增殖分化的影响[J].第三军医大学学报,2010,32(11):1188-1191.
[14]DICKERSON S M,GUEVARA E,WOLLER M J,et al.Cell death mechanisms in GT1-7 GnRH cells exposed to polychlorinated biphenyls PCB74, PCB118, and PCB153[J].Toxicology and Applied Pharmacology,2009,237(2):237-245.
[15]吴雪山,赵婷,茆广华,等.邻苯二甲酸二辛酯和砷联合暴露对小鼠的神经毒性及其机制[J].江苏大学学报(医学版),2015(4):294-298.
[2]PIROLI G,TORRES A,GRILLO C,et al.Mechanisms in progestin antagonism of pituitary tumorigenesis[J].Journal of Steroid Biochemistry and Molecular Biology,1998,64(1/2):59-67.
[3]王雪金,周云清,罗湘闽,等.邻苯二甲酸二丁酯对雌性大鼠卵巢颗粒细胞分泌功能的影响[J].中国组织工程研究,2014,18(42):6779-6783.
[4]李荔群.邻苯二甲酸二丁酯对子代生殖发育毒性的影响及相关人群暴露途径的研究[D].上海:复旦大学,2012.
[5]YAMADA T,KUNIMATSU T,MIYATA K,et al.Enhanced rat hershberger assay appears reliable for detection of not only (anti-)androgenic chemicals but also thyroid hormone modulators[J].Toxicological Sciences,2004,79(1):64-74.
[6]时国庆,李栋,卢晓坤,等.环境内分泌干扰物质的健康影响与作用机制[J].环境化学,2011,30(1):211-223.
[7]杜娟,潘红艳,宫智勇.己烯雌酚对生殖系统的影响及机制的研究进展[J].中国药理学与毒理学杂志,2012,26(4):588-590.
[8]田雨.DBP和DEHP在雄性大鼠体内的毒代动力学研究[D].银川:宁夏医科大学,2014.
[9]朱才众,熊鸿燕,李亚斐,等.增塑剂邻苯二甲酸二丁酯低剂量与神经系统毒性效应的评估[J].中国组织工程研究,2006,10(8):76-78.
[10]刘红阳,茆广华,许海,等.铅和邻苯二甲酸二丁酯联合暴露对斑马鱼胚胎的影响[J].生物技术进展,2016,6(4):249-254.
[11]殷金珠.低剂量BaP、铝联合染毒对原代大鼠神经细胞凋亡的协同作用[D].太原:山西医科大学,2014.
[12]汪洪杰,赵正梅,刘东梅.己烯雌酚对胎鼠海马神经干细胞增殖与分化的影响[J].蚌埠医学院学报,2009,34(8):662-665.
[13]罗芬兰,蔡文琴,张吉强.大鼠孕期染邻苯二甲酸二丁酯对子代神经干细胞增殖分化的影响[J].第三军医大学学报,2010,32(11):1188-1191.
[14]DICKERSON S M,GUEVARA E,WOLLER M J,et al.Cell death mechanisms in GT1-7 GnRH cells exposed to polychlorinated biphenyls PCB74, PCB118, and PCB153[J].Toxicology and Applied Pharmacology,2009,237(2):237-245.
[15]吴雪山,赵婷,茆广华,等.邻苯二甲酸二辛酯和砷联合暴露对小鼠的神经毒性及其机制[J].江苏大学学报(医学版),2015(4):294-298.
 康静,方海琴,贾旭东,宋雁,刘兆平,裴秋玲.己烯雌酚、邻苯二甲酸二丁酯和丙基硫脲嘧啶对小鼠垂体瘤神经细胞增殖的联合作用研究[J].中国食品卫生杂志,2017,29(3):264-268.
康静,方海琴,贾旭东,宋雁,刘兆平,裴秋玲.己烯雌酚、邻苯二甲酸二丁酯和丙基硫脲嘧啶对小鼠垂体瘤神经细胞增殖的联合作用研究[J].中国食品卫生杂志,2017,29(3):264-268.