DOi:10.13590/j.cjfh.2017.03.004
小龙虾相关横纹肌溶解综合征的人群流行病学调查和小鼠体内触发试验研究
(广东省疾病预防控制中心,广东 广州511430)
作者简介: 黄琼女主任医师研究方向为食源性疾病监测与暴发应对E-mail: huangqiong@cdcp.org.cn;赵敏女主任医师研究方向为安全性评价和风险评估E-mail:1181796446@qq.com
通信作者: 张永慧男主任医师研究方向为食品安全及公共卫生管理E-mail: zyh@cdcp.org.cn 黄琼、赵敏同为第一作者。
收稿日期: 2017-04-20
基金项目: 广东省科技计划项目(2014A020212407)
摘要:目的 用动物试验研究小龙虾相关人群横纹肌溶解综合征的相关危险因素,为确证小龙虾相关横纹肌溶解综合征的致病因子提供动物试验筛查的问题样品。方法基于2016年广东省48例食用小龙虾相关横纹肌溶解综合征病例的流行病学和溯源调查结果,找到可能的问题小龙虾样品,分离虾肝胰腺、虾肉,分别经口灌胃小鼠,在小鼠体内触发小龙虾相关横纹肌溶解综合征,观察血清学和骨骼肌组织病理学等指标的改变。结果2016年7~9月广东报告的48例食用小龙虾相关横纹肌溶解综合征病例的临床表现主要为肌肉酸痛、乏力、呼吸困难和胸闷等,血液生化检测显示肌酸激酶、肌酸激酶同工酶和肌红蛋白异常的比例超过85%,符合哈夫病的诊断。人群中发生的小龙虾相关横纹肌溶解综合征与小龙虾的批次、个体进食量和个体体质差异均有关。36起事件中涉及同一场所的有A、B两家餐馆,分别报告了2起。30 g/kg BW剂量的A餐馆的雌虾肝胰腺可引起小鼠血清肌酸激酶、肌酸激酶同工酶的升高,高于其他剂量组(10、3.3和1.1 g/kg BW),差异有统计学意义(P<0.05),30 g/kg BW剂量的A餐馆和B餐馆的虾肉可引起小鼠血清肌酸激酶同工酶、肌红蛋白、谷草转氨酶、乳酸脱氢酶、肌酐升高;同一动物横纹肌溶解综合征相关的指标肌酸激酶、肌酸激酶同工酶、肌红蛋白、乳酸脱氢酶、谷丙转氨酶、谷草转氨酶呈现正相关性;横纹肌溶解综合征病理改变主要在血清肌酸激酶和肌酸激酶同工酶异常升高的动物中观察到,主要表现为小鼠股二头肌内炎症细胞浸润,肌纤维嗜伊红染增强,横纹模糊消失。结论小龙虾在部分小鼠体内可触发横纹肌溶解综合征,发病率与小龙虾批次有关,与给样量多少有关。动物试验与人群流行病学的调查结果基本一致。
关键词:
小龙虾; 横纹肌溶解综合征; 哈夫病; 小鼠; 毒理试验; 人群流行病学调查
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)03-0269-08
Epidemiology investigation of rhabdomyolysis and in vivo trigger in mice associated with crayfish
(Guangdong Provincial Center for Disease Control and Prevention,Guangdong Guangzhou 511430,China)
Abstract:Objective To verify the related risk factors of crayfish-related rhabdomyolysis outbreak using animal experiment, and to provide positive samples by animal experiment screening for the confirmation of the pathogenic factors of crayfish-related rhabdomyolysis. MethodsBased on the result of epidemiological investigations and the traceability information of 48 crayfish-related rhabdomyolysis cases in Guangdong Province in 2016, suspected crayfish samples were screened and separated as meat and hepatopancreas, which were given to mice by gavage to trigger crayfish-related rhabdomyolysis through observing the indicators of serology and skeleton histopathology. ResultsThe main clinical symptoms of the cases were muscle soreness, fatigue, dyspnea and chest distress, and the blood biochemistry test showed that the abnormal percentage of creatine kinase(CK), creatine kinase isoenzyme(CKMB)and myoglobin(MB)were above 85%, accordance with the diagnosis of haff disease. The crayfish-related rhabdomyolysis was related with the batch and intake of crayfish, as well as the individual physical difference. In 36 incidents, there were two restaurants (restaurant A and restaurant B) reported 2 incidents respectively, others only reported one. 30 g/kg BW of female hepatopancreas from restaurant A could induce increase of serum CK and CKMB in mice. After giving the highest dose (30 g/kg BW) of hepatopancreas from restaurant A, serum CK and CKMB were all higher than other dose groups (10, 3.3, 1.1 g/kg BW). 30 g/kg BW crayfish meat from restaurant A and B could both induce increase of serum CKMB, MB, aspartate aminotransferase(AST), lactate dehydrogenase(LDH)and creatinine(CR). The abnormal increase of rhabdomyolysis related indicators CK, CKMB, MB, LDH, glutamic pyruvic transaminase(ALT)and AST were positively correlated in the same animal. The rhabdomyolysis pathological manifestations, such as inflammatory cell infiltration, eosinophilic in bicepsfemoris muscle, and cross striations unclear and disappear were mainly observed in animals with serum CK, CKMB abnormal increase. ConclusionCrayfish-related rhabdomyolysis could be triggered in mice, and was associated with the batch and dose of the crayfish, which was consistent with the result of human epidemiological investigation.
Key words:
Crayfish; rhabdomyolysis; haff disease; mice; toxicological test; epidemiological investigation
哈夫病是指发病前24 h进食过鱼类等水产品引起的不能用其他原因解释的横纹肌溶解综合征(rhabdomyolysis,RM)病例,实验室检查肌酸激酶(creatine kinase,CK)通常高于正常参考值5倍以上[1]。从1924年的首例哈夫病报道到2016年夏季中国长江中下游地区流行的小龙虾相关RM,偶发是哈夫病最明显的特点,病例发生地区从欧洲、美洲到本世纪初扩散至亚洲,涉及的水产品多为有杂食习性的品种[1-14]。2000年8月我国北京地区首次报告出现进食蝲蛄后引起类似哈夫病症状的病例,追踪到的6例病例主要临床表现为肌肉疼痛和肌无力,检测发现CK异常升高或尿中出现肌红蛋白(myoglobin,MB)[6]。2010年7~8月,南京地区报告因食用小龙虾引起的RM,临床诊断23例,病例散在分布,潜伏期为2.5~13 h,中位数为6 h,临床表现与哈夫病基本一致,但致病物质不明。2012—2014年该地区又有9例病例报告[14]。近年来我国安徽省芜湖市、江苏省苏州市和扬州市等地区也有怀疑食用小龙虾相关RM病例个案报道[14]。2009年10月广东省报道一起由于食用淡水鲳鱼导致的哈夫病暴发,同其他报道一样,致病物质未明[11]。2016年7~9月广东省内报告了48例食用小龙虾相关RM。相对于全国每年消费小龙虾的庞大人群(仅南京地区每月估计约300万人食用小龙虾[10]),食用小龙虾相关RM罹患率很低,不及中国人群5.2%食物过敏发生率[15],表明这是一种发生于少数个体的与食用小龙虾相关的疾病。前期有关进食小龙虾与RM关系的致病因子筛查结果均为阴性[1,16-18],唯一的动物试验研究也没有非常明确的病因学结论[19]。考虑到哈夫病偶发和极低的罹患率的特点,前期众多有关进食小龙虾与RM关系的致病因子研究结果存在“假阴性”的可能。利用问题小龙虾触发出动物的RM,以其血、尿、组织或器官标本来筛查致病因子应更为可行。本研究基于人群流行病学调查和溯源调查,找到可能的问题小龙虾样品,在小鼠体内触发小龙虾相关RM,一方面可解释小龙虾相关RM暴发的相关危险因素,用动物试验验证人群流行病学调查的假设,为制定人群消费建议提供科学依据;另一方面可为小龙虾相关RM的致病因子筛查提供动物试验支持。
本研究同时也发现,即便是同一份筛选出来的问题样品,并不能百分百地触发同一组所有动物发生RM,不同批次的动物能被触发出RM的比例也有差别,这说明小龙虾相关RM的发生有个体差异,流行病学调查和动物试验研究结果均表明这种个体差异和过敏无关,但体质量小的雄性动物比体质量大的雌性动物对小龙虾触发的RM更为敏感,可能与某些致病机制或受体通路有关,待致病因子明确后也许可以解释这种差异的原因所在。然而,小龙虾的进食量和发病的关系无论是人群流行病学还是动物试验都是明确的,虽然发病存在个体间的差异,但发病与进食量的普遍性关联是存在的[10,12]。本研究发现,同一批问题样品的虾肝胰腺和虾肉均能在小鼠体内触发RM,虾肉触发的RM甚至比虾肝胰腺更为明显。人群流行病学调查发现,发病的人多因贪图美味而一次进食较大量的虾肝胰腺(俗称“虾黄”),进食虾肝胰腺是危险因素之一,虽然也有仅进食虾肉发病的个案,但进食大量虾肝胰腺后发病比较常见(数据未发表)。本研究中动物试验灌胃用的样品是经过多只小龙虾混合的,单只小龙虾的出肉率远高于出黄率,如果是极少数的问题小龙虾携带某些致病因子,那么混合后的虾肉样品中这些致病因子被稀释的程度远低于虾肝胰腺样品,这可能是本研究中动物试验出现虾肉触发的RM个体比例和程度高于虾肝胰腺的原因。本研究还发现问题小龙虾无论是雌性还是雄性,都有触发小鼠RM的可能性。本研究发现问题小龙虾虾肉可引起血磷降低,与有关研究结果[19]一致。问题小龙虾虾肝胰腺可引起血清总IgG抗体水平降低,提示可能与过敏反应关系不大。本研究存在一定的局限性:①由于单只小鼠尿液收集较为困难,未能开展单个动物尿液指标的观察和检测;②预试验发现雄性小鼠较雌性小鼠对小龙虾触发的RM更为敏感,由于问题样品数量有限,主要采用了雄性动物开展试验。总之,本研究利用与人群发病相关的小龙虾样品在小鼠体内触发出RM,一方面解释了小龙虾相关人群RM发生可能有两方面的危险因素,一是小龙虾本身,某些年份某些养殖因素改变后极少数的小龙虾携带了尚不明确的致病因子,被人群进食后触发出RM症状,动物试验结果表明无论雌雄,无论虾肝胰腺或是虾肉都可能携带这种致病因子,高温的加工方式无法破坏;二是个体本身,某些个体体内可能存在触发RM的致病机制或受体通路,与年龄和性别可能有一定关系,但是考虑到小鼠与人体的种属差异,结论外推需要谨慎。
另一方面,通过在动物体内筛选出能触发RM的问题样品,可为致病因子确证提供思路和手段,减少试验假阴性,尽快解决哈夫病致病因子的筛查和确认的难题。
(志谢广东省深圳市、广州市、中山市、佛山市、珠海市、清远市、东莞市7个地市的疾病预防控制中心完成的人群现场流调工作;广东食品安全风险监测技术骨干培训项目学员朱婷婷、曾云龙、孙健、李泳光、陈振明、杨雁宏和余超协助现场采样和样品前处理;湖北省疾病预防控制中心张弛医生和湖北省洪湖市疾病预防控制中心王振华医生、安徽省疾病预防控制中心陈志飞医生协助样品采集和溯源调查;中国疾病预防控制中心马会来研究员指导流行病学调查和分析,国家食品安全风险评估中心郭云昌研究员提供监测指导)
1材料与方法
1.1材料
1.1.1实验动物
SPF级KM种小鼠,雄性,体质量15~17 g,由广东省医学实验动物中心提供[生产许可证号:SCXK(粤)2013-0002]。动物饲养于广东省疾病预防控制中心屏障环境实验室[使用许可证号:SYXK(粤)2008-0011],温度(22±2) ℃,湿度60%~80%,灭菌饲料来源于广东省医学实验动物中心。
1.1.2主要仪器与试剂
7600全自动生化仪(日本日立)。血清中肌酸激酶(CK)、肌酸激酶同工酶(CKMB)、肌红蛋白(MB)、乳酸脱氢酶(LDH)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(BUN)、肌酐(CR)、钙(Ca)、镁(Mg)、磷(P)、免疫球蛋白IgM、IgG、IgA检测试剂盒均购自北京九强生物科技有限公司,血清中氯(Cl)、钾(K)、钠(Na)检测试剂盒均购自日本日立。
1.2方法
1.2.1现场流行病学调查
病例定义:疑似病例:出现不明原因的全身性或局部肌肉疼痛等RM症状,症状出现前24 h内有小龙虾食用史,排除其他可能致RM病因(过量运动、创伤、饮酒、遗传性疾病、药物、感染、代谢异常等);确诊病例:疑似病例且CK高于正常参考值上限的5倍及以上。病例调查:通过国家食源性疾病病例监测系统上报,开展个案流行病学电话或面访调查,内容包括临床表现、辅助检查、饮食史、既往病史等。溯源采样:对发病事件数≥2起的餐馆在事件发生后立即开展小龙虾养殖地的溯源调查,并采集餐馆同一供货来源的雌、雄性小龙虾。采集未报告过病例小龙虾餐馆的雌性小龙虾以及广东省本地养殖的雌性罗氏虾。1.2.2动物分组及样品前处理试验组:A、B餐馆采集的雌、雄性小龙虾;对照组:设阴性对照组(纯净水灌胃对照)、内对照组(C、D餐馆采集的雌性小龙虾)和外对照组(雌性罗氏虾)。剂量:30、10、3.3、1.1 g/kg BW。灌胃量为0.2 ml/10 g,24 h内灌胃3次,每次间隔3 h,阴性对照组给予等量纯净水。样品前处理:活小龙虾按雌、雄性分类,剪去虾尾、挑出肠线,分离虾肝胰腺和虾肉,沸水蒸5 min,分别用纯净水制成50%匀浆液备用。
1.2.3标本采集
采血:第一次灌胃后24 h采集眼球全血,1 500×g离心10 min分离血清备用。取肌肉:第一次灌胃后24 h取小鼠平仰位,将右腿上部皮肤去除,小心剥离股内侧肌,暴露股骨和坐骨神经,取下整块股二头肌。
1.2.4一般观察
观察实验动物有无任何不良反应,饮食活动是否正常,一周观察期内有无死亡,称重心脏、肝脏、肾脏、胸腺、脾脏并计算脏器系数。
1.2.5血生化和免疫学试验
血清生化指标:CK、CKMB、MB、LDH、ALT、AST、BUN、CR;血清电解质指标:Ca、Mg、P、Cl、K、Na;免疫学指标:免疫球蛋白IgM、IgG、IgA。
1.2.6骨骼肌组织病理学检查
股二头肌组织病理学检查,苏木精-伊红(HE)染色法,40和100倍物镜放大观察和拍照。
1.3统计学分析
采用SPSS 18.0软件进行两独立样本的t检验、ANOVA分析和spearman相关性分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2结果
2.1现场流行病学调查
2.1.1病例临床表现和三间分布
2016年7~9月广东省共计7个地市报告了36起小龙虾相关RM事件,合计48例病例,其中确诊病例32例,疑似病例16例。出现全身或局部肌肉酸痛45例(93.8%,45/48),出现乏力23例(47.9%,23/48),呼吸困难和胸闷各19例(39.6%,19/48);其中住院治疗27例、门诊治疗21例。所有病例均痊愈,无重症及死亡病例,主要临床特征分布见表1。

|
表12016年广东省48例小龙虾相关RM病例 主要临床症状 Table 1Main clinical symptoms of 48 patients related with crayfish eating in Guangdong Province,2016 |

|
表22016年广东省48例小龙虾相关RM病例血清 生化检测结果 Table 2Serum chemistry changes of 48 patients related with crayfish eating in Guangdong Province, 2016 |
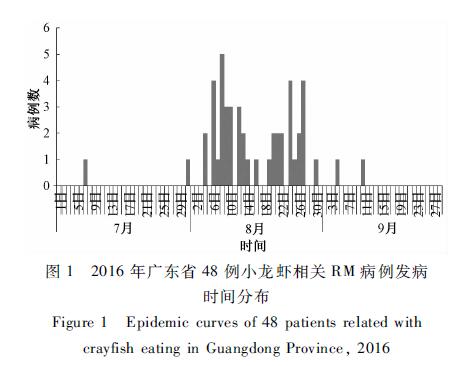
|
图12016年广东省48例小龙虾相关RM病例发病 时间分布 Figure 1Epidemic curves of 48 patients related with crayfish eating in Guangdong Province, 2016 |
2.1.2小龙虾进食情况和溯源调查
报告的48例小龙虾相关RM病例进食小龙虾数量在2~60只之间,平均20只。48例病例中在餐馆进食的占75.0%(36/48)、家庭占18.8%(9/48)。从同餐进食情况来看,36起事件中同餐同桌进食小龙虾者共100人,罹患率为48.0%(48/100),其中14起事件同餐进食罹患率为100.0%,另外22起事件同餐进食罹患率在16.7%~66.7%之间,中位数为33.33%。36起事件中涉及同一餐馆的有A、B两家,各报告了2起。溯源调查发现,广东省销售的小龙虾产地和来源均不在广东省,系长江中下游地区。A、B餐馆的小龙虾主要来自长江中下游某省受2016年夏季洪灾影响的养殖场,未报告过病例的C、D餐馆的小龙虾养殖场未受2016年夏季洪灾的影响。从小龙虾烹制方法看,48例病例中提供有效信息的病例为27例,烹制方法为油炸占44.4%(12/27)、爆炒占40.7%(11/27)、焖煮占29.6%(8/27)。从进食小龙虾部位看,48例病例中提供有效进食信息的共37例,吃虾肉占94.6%(35/37)、吃 虾肝胰腺占73.0%(27/37)、吃虾头占27.0%(10/37)。37例病例进食小龙虾部位具体详见表3。

|
表32016年广东省37例小龙虾相关RM病例进食小龙虾部位分布 Table 3Eating parts distribution of 37 patients related with crayfish in Guangdong Province, 2016 |
2.2动物试验结果
2.2.1一般观察
所有组别试验动物均未见明显的毒性反应,观察期内未见动物死亡,未见脏器重量和脏器系数一致性的变化。
2.2.2小鼠血清生化指标检测结果
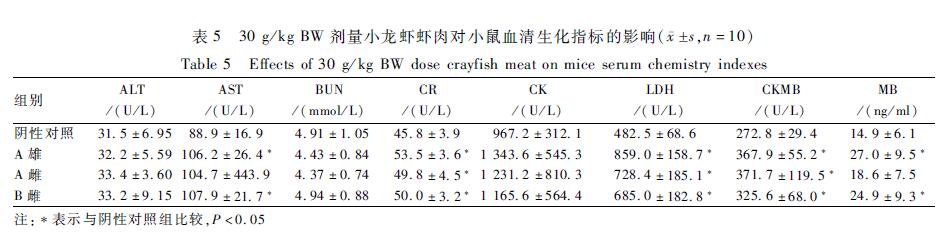
A餐馆30 g/kg BW剂量的雌性虾肝胰腺引起小鼠血清CK、CKMB、MB、AST升高,其中CK、CKMB的升高与对照组比较差异有统计学意义(P<0.05);MB和AST较对照组高,其中MB有一倍的升高,但差异无统计学意义(P>0.05);A餐馆雄性虾肝胰腺和B餐馆雌性虾肝胰腺未见引起小鼠生化指标的明显改变,差异无统计学意义(P>0.05),结果见表4。|
|
表430 g/kg BW剂量小龙虾虾肝胰腺对小鼠血清生化指标的影响( s,n=10) Table 4Effects of 30 g/kg BW dose crayfish hepatopancreas on mice serum chemistry indexes |
|
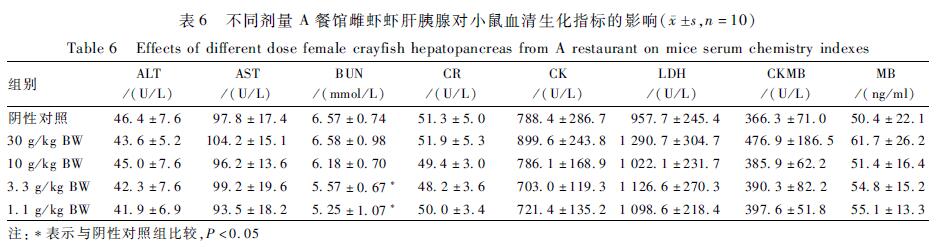
表530 g/kg BW剂量小龙虾虾肉对小鼠血清生化指标的影响( s,n=10) Table 5Effects of 30 g/kg BW dose crayfish meat on mice serum chemistry indexes |
|
表6不同剂量A餐馆雌虾虾肝胰腺对小鼠血清生化指标的影响( s,n=10) Table 6Effects of different dose female crayfish hepatopancreas from A restaurant on mice serum chemistry indexes |
|
|
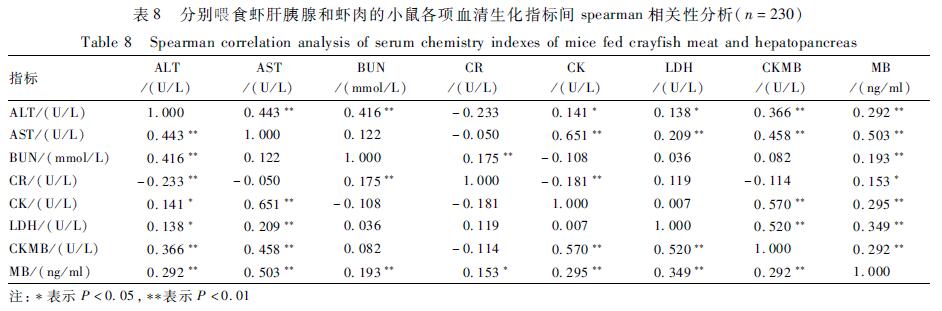
表7不同对照组30 g/kg BW雌虾虾肝胰腺对小鼠血清生化指标的影响( s,n=10) Table 7Effects of 30 g/kg BW dose female crayfish hepatopancreas from different control groups on mice serum chemistry indexes |
|
表8分别喂食虾肝胰腺和虾肉的小鼠各项血清生化指标间spearman相关性分析(n=230) Table 8Spearman correlation analysis of serum chemistry indexes of mice fed crayfish meat and hepatopancreas |
2.2.3小鼠血清电解质和免疫学检测结果
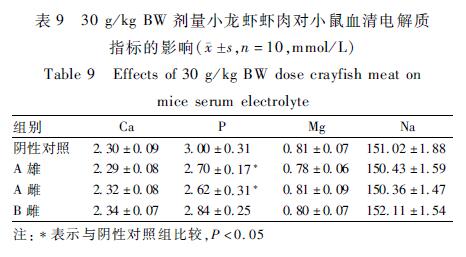
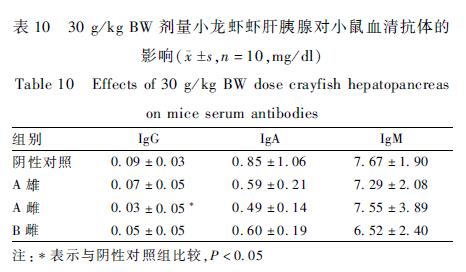
A餐馆30 g/kg BW剂量的雌、雄性虾肉可引起血清中P降低,雌性虾肝胰腺可引起血清中IgG抗体降低,差异有统计学意义(P<0.05)。小鼠血清电解质指标和血清免疫指标的检测结果见表9、10。
|
表930 g/kg BW剂量小龙虾虾肉对小鼠血清电解质 指标的影响( s,n=10,mmol/L) Table 9Effects of 30 g/kg BW dose crayfish meat on mice serum electrolyte |
|
表1030 g/kg BW剂量小龙虾虾肝胰腺对小鼠血清抗体的 影响( s,n=10,mg/dl) Table 10Effects of 30 g/kg BW dose crayfish hepatopancreas on mice serum antibodies |
2.2.4小鼠骨骼肌组织病理学观察结果
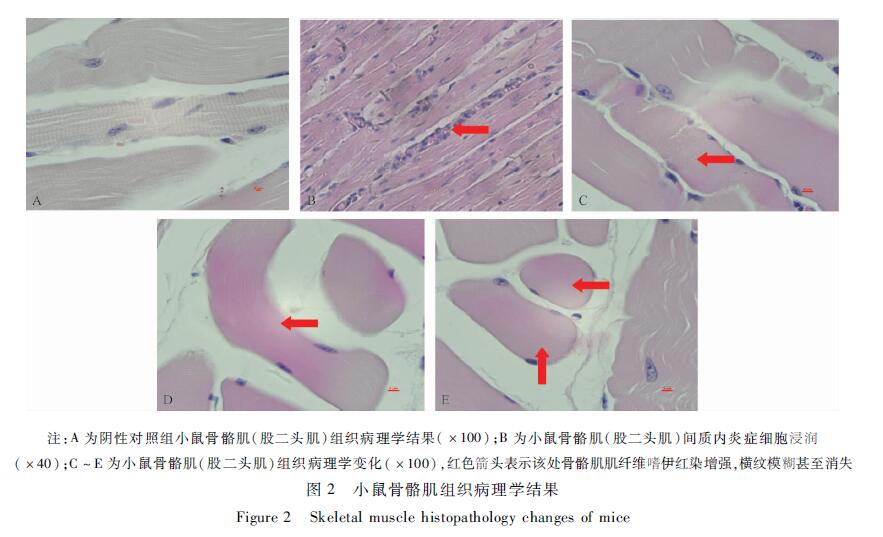
小鼠骨骼肌组织病理学结果见图2。30 g/kg BW剂量A餐馆的雌虾肝胰腺组部分动物股二头肌间质内炎症细胞浸润(B),肌纤维嗜伊红染增强,横纹模糊甚至消失(C~E)。这些异常病理改变主要在注:A为阴性对照组小鼠骨骼肌(股二头肌)组织病理学结果 (×100);B为小鼠骨骼肌(股二头肌)间质内炎症细胞浸润(×40);C~E为小鼠骨骼肌(股二头肌)组织病理学变化(×100), 红色箭头表示该处骨骼肌肌纤维嗜伊红染增强,横纹模糊甚至消失血清中RM相关指标CK和CKMB异常升高的动物中观察到。
|
图2小鼠骨骼肌组织病理学结果 Figure 2Skeletal muscle histopathology changes of mice |
3讨论
RM是由多种原因导致的横纹肌细胞受损,MB、CK等细胞内容物释放进入细胞外液和血循环中而引起的临床综合征,一般起病急,临床表现以肌痛、乏力、四肢肿胀、肌无力、茶色尿为主,可伴有恶心、呕吐、心腹痛或腹泻等全身中毒症状,部分病例可出现急性肾功能衰竭,少数病例有多器官功能障碍综合征或凝血功能障碍,甚至发生死亡。多数RM病例CR、尿素、尿酸出现不同程度升高。MB会升高,但通常与球蛋白结合,很快会被肾脏清除,因此该指标敏感性不高,即使阴性也不能排除RM,但对RM诊断具有借鉴意义。CK在横纹肌溶解时会大量释放入血液,由于其在体内代谢慢,且不被血液透析所清除,该指标敏感性高,可作为诊断RM的指标[20-22]。本研究中48名病例的临床表现主要为肌肉酸痛、乏力、呼吸困难和胸闷等,血液生化检测显示CK、CKMB和MB异常比例超过85%,符合RM和哈夫病的诊断[1,20-21]。RM的病因非常复杂,据国外综述[23]报道,获得性病因有190余种,遗传相关的病因有40余种,如过量运动、外伤、饮酒、急性中毒、遗传、细菌或病毒感染等因素均能引起该病。能引起人RM的食物主要有毒芹、蘑菇和水产品,也有诸多在动物体内的重现研究报道[24-27]。其中,MATSUURA等[26]对亚稀褶黑菇引起的RM开展了小鼠试验,从亚稀褶黑菇中分离到可能的毒物环丙-2-羧酸,这种羧酸能引起严重的RM,可能不是直接作用于肌肉细胞,而是触发了一些其他的生化反应。小龙虾相关RM是否也与这种羧酸有关值得开展进一步研究探讨。本研究结果表明,动物试验能重现人群的小龙虾相关RM,与小龙虾批次、给样量多少有关。这一结论与人群流行病学的调查结果[10,12]基本一致,即人群中发生的小龙虾相关RM与小龙虾的养殖年份、个体进食量、个体体质差异有关。本研究预试验发现,15~17 g体质量的雄性小鼠对小龙虾触发的RM比较敏感,同一份问题样品在18~20 g小鼠或雌性小鼠体内较难成功触发RM,故本研究的正式试验采用15~17 g体质量的雄性小鼠。即便是病人进食过的同一批次的问题小龙虾,也只有极少数小龙虾有可能触发小鼠的RM。这和本研究中人群流行病学的调查结果一致,即同时就餐的人群中只有48%的比例是同时有多人发病,这也造成了致病因子筛查最大的困难和障碍,很多之前的研究报道出现的多种致病因子筛查结果有存在假阴性的可能。找到能在动物体内触发出小龙虾相关RM的食物样品应该是致病因子筛查的第一步。本研究同时也发现,即便是同一份筛选出来的问题样品,并不能百分百地触发同一组所有动物发生RM,不同批次的动物能被触发出RM的比例也有差别,这说明小龙虾相关RM的发生有个体差异,流行病学调查和动物试验研究结果均表明这种个体差异和过敏无关,但体质量小的雄性动物比体质量大的雌性动物对小龙虾触发的RM更为敏感,可能与某些致病机制或受体通路有关,待致病因子明确后也许可以解释这种差异的原因所在。然而,小龙虾的进食量和发病的关系无论是人群流行病学还是动物试验都是明确的,虽然发病存在个体间的差异,但发病与进食量的普遍性关联是存在的[10,12]。本研究发现,同一批问题样品的虾肝胰腺和虾肉均能在小鼠体内触发RM,虾肉触发的RM甚至比虾肝胰腺更为明显。人群流行病学调查发现,发病的人多因贪图美味而一次进食较大量的虾肝胰腺(俗称“虾黄”),进食虾肝胰腺是危险因素之一,虽然也有仅进食虾肉发病的个案,但进食大量虾肝胰腺后发病比较常见(数据未发表)。本研究中动物试验灌胃用的样品是经过多只小龙虾混合的,单只小龙虾的出肉率远高于出黄率,如果是极少数的问题小龙虾携带某些致病因子,那么混合后的虾肉样品中这些致病因子被稀释的程度远低于虾肝胰腺样品,这可能是本研究中动物试验出现虾肉触发的RM个体比例和程度高于虾肝胰腺的原因。本研究还发现问题小龙虾无论是雌性还是雄性,都有触发小鼠RM的可能性。本研究发现问题小龙虾虾肉可引起血磷降低,与有关研究结果[19]一致。问题小龙虾虾肝胰腺可引起血清总IgG抗体水平降低,提示可能与过敏反应关系不大。本研究存在一定的局限性:①由于单只小鼠尿液收集较为困难,未能开展单个动物尿液指标的观察和检测;②预试验发现雄性小鼠较雌性小鼠对小龙虾触发的RM更为敏感,由于问题样品数量有限,主要采用了雄性动物开展试验。总之,本研究利用与人群发病相关的小龙虾样品在小鼠体内触发出RM,一方面解释了小龙虾相关人群RM发生可能有两方面的危险因素,一是小龙虾本身,某些年份某些养殖因素改变后极少数的小龙虾携带了尚不明确的致病因子,被人群进食后触发出RM症状,动物试验结果表明无论雌雄,无论虾肝胰腺或是虾肉都可能携带这种致病因子,高温的加工方式无法破坏;二是个体本身,某些个体体内可能存在触发RM的致病机制或受体通路,与年龄和性别可能有一定关系,但是考虑到小鼠与人体的种属差异,结论外推需要谨慎。
另一方面,通过在动物体内筛选出能触发RM的问题样品,可为致病因子确证提供思路和手段,减少试验假阴性,尽快解决哈夫病致病因子的筛查和确认的难题。
(志谢广东省深圳市、广州市、中山市、佛山市、珠海市、清远市、东莞市7个地市的疾病预防控制中心完成的人群现场流调工作;广东食品安全风险监测技术骨干培训项目学员朱婷婷、曾云龙、孙健、李泳光、陈振明、杨雁宏和余超协助现场采样和样品前处理;湖北省疾病预防控制中心张弛医生和湖北省洪湖市疾病预防控制中心王振华医生、安徽省疾病预防控制中心陈志飞医生协助样品采集和溯源调查;中国疾病预防控制中心马会来研究员指导流行病学调查和分析,国家食品安全风险评估中心郭云昌研究员提供监测指导)
参考文献
[1]BUCHHOLZ U,MOUZIN E,DICKEY R,et al.Haff disease:from the Baltic sea to the U.S. shore[J]. Emerging Infectious Diseases, 2000, 6(2):192-195.
[2]ASSMANN H, BIELENSTEIN H, HABS H, et al. Beobach-tungen und Untersuchungen bei der Haffkrankheit 1932[J]. DMW, 1933, 59(4):122-126.
[3]JEDDELOH B Z. Haffkrankheit[M].Springer Berlin Heidelberg:Ergebnisse der Inneren Medizin und Kinderhei-lkunde, 1939:138-182.
[4]BERLIN R. Haff disease in Sweden [J]. Acta Medica Scandinavica, 1948, 129(6):560-572.
[5]KLOSS K, FELTMANN L, DODSON D, et al. Haff disease associated with eating buffalo fish-United States, 1997[J]. Mmwr Morbidity and Mortality Weekly Report, 1998, 47(50):1091-1093.
[6]袁云, 陈清棠. 蝲蛄致Haff病6例临床分析[J]. 中华医学杂志, 2001, 81(24):1530-1531.
[7]LANGLEY R L. Haff disease after eating salmon[J]. Southern Medical Journal, 2007, 100(11):1147-1150.
[8]DOS SANTOS M C, DE ALBUQUERQUE B C, PINTO R C, et al. Outbreak of Haff disease in the Brazilian Amazon[J]. Rev Panam Salud Publica,2009, 26(5):469-470.
[9]TANIYAMA S, SAGARA T, NISHIO S, et al. Survey of food poisoning incidents in Japan due to ingestion of marine boxfish and their toxicity[J]. Journal of the Food Hygienic Society of Japan, 2009, 50(5):270-277.
[10]谢国祥,郭宝福,陈洋,等.食用小龙虾致横纹肌溶解综合征事件的流行病学调查[J].现代预防医学,2012,39(20):5239-5240.
[11]HUANG X, LI Y P, HUANG Q, et al. A past Haff disease outbreak associated with eating freshwater pomfret in South China[J]. BMC Public Health, 2013, 13(1):447.
[12]CHEN Y, YUAN B J, XIE G X, et al. Outbreak of Haff disease caused by consumption of crayfish (Procambarus clarkii), Nanjing, Jiangsu Province, China[J]. Food Control, 2015, 59:690-694.
[13]DIAZ J H. Global incidence of rhabdomyolysis after cooked seafood consumption (Haff disease)[J]. Clinical Toxicology, 2015, 53(5):421.
[14]CHAN T Y. The emergence and epidemiology of Haff disease in China[J]. Toxins,2016,8(12):359.
[15]何韶衡. 基础过敏反应学[M]. 北京:科学出版社, 2009.
[16]ZHANG B, YANG G, YU X B, et al. Haff disease after eating crayfish in east China[J]. Internal Medicine, 2012, 51(5):487-489.
[17]XIE P, HU J, HUANG J M, et al. Crayfish-related Haff disease rhabdomyolysis; diagnosis supported by bone scintigraphy[J]. Hellenic Journal of Nuclear Medicine, 2013, 16(1):60-61.
[18]马宁, 李凤琴, 李宁,等. 食源性横纹肌溶解综合征概述[J]. 中国食品卫生杂志, 2010, 22(6):564-567.
[19]林江伟. 克氏原螯虾致横纹肌溶解危害物与过敏原的分析[D]. 厦门:集美大学, 2012.
[20]黄颂敏. 横纹肌溶解综合征的诊治[J]. 中国中西医结合肾病杂志, 2004, 5(4):187-188.
[21]张琴, 王杰赞, 黄卫东. 横纹肌溶解综合征的诊治进展[J]. 中华急诊医学杂志, 2011, 20(4):445-446.
[22]LUCK R P, VERBIN S. Rhabdomyolysis: a review of clinical presentation, etiology, diagnosis, and management[J]. Pediatric Emergency Care, 2008, 24(4):262-268.
[23]YUMUL R, STEEN S N, OSIBAMIRO-SEDUN A, et al. Rhabdomyolysis: a historical review with two illustrative cases[J]. Sedun, 2004(14):143-147.
[24]TSIRONI M, ANDRIOPOULOS P, XAMODRAKA E, et al. The patient with rhabdomyolysis: have you considered quail poisoning?[J]. Canadian Medical Association Journal, 2004, 171(4):325-326.
[25]LAMEIRAS J L V, COSTA O T F D, MORONI F T, et al. Systemic rhabdomyolysis induced by venom of freshwater stingrays plesiotrygon iwamae, and potamotrygon motoro, (chondrichthyes-potamotrygonidae) from the Amazon Basin[J]. Toxicon, 2014, 77(1):105-113.
[26]MATSUURA M, SAIKAWA Y, INUI K, et al. Identification of the toxic trigger in mushroom poisoning [J]. Nature Chemical Biology, 2009, 5(7):465.
[27]NIEMINEN P, MUSTONEN A M, KIRSI M. Increased plasma creatine kinase activities triggered by edible wild mushrooms[J]. Food and Chemical Toxicology, 2005, 43(1):133-138.
[2]ASSMANN H, BIELENSTEIN H, HABS H, et al. Beobach-tungen und Untersuchungen bei der Haffkrankheit 1932[J]. DMW, 1933, 59(4):122-126.
[3]JEDDELOH B Z. Haffkrankheit[M].Springer Berlin Heidelberg:Ergebnisse der Inneren Medizin und Kinderhei-lkunde, 1939:138-182.
[4]BERLIN R. Haff disease in Sweden [J]. Acta Medica Scandinavica, 1948, 129(6):560-572.
[5]KLOSS K, FELTMANN L, DODSON D, et al. Haff disease associated with eating buffalo fish-United States, 1997[J]. Mmwr Morbidity and Mortality Weekly Report, 1998, 47(50):1091-1093.
[6]袁云, 陈清棠. 蝲蛄致Haff病6例临床分析[J]. 中华医学杂志, 2001, 81(24):1530-1531.
[7]LANGLEY R L. Haff disease after eating salmon[J]. Southern Medical Journal, 2007, 100(11):1147-1150.
[8]DOS SANTOS M C, DE ALBUQUERQUE B C, PINTO R C, et al. Outbreak of Haff disease in the Brazilian Amazon[J]. Rev Panam Salud Publica,2009, 26(5):469-470.
[9]TANIYAMA S, SAGARA T, NISHIO S, et al. Survey of food poisoning incidents in Japan due to ingestion of marine boxfish and their toxicity[J]. Journal of the Food Hygienic Society of Japan, 2009, 50(5):270-277.
[10]谢国祥,郭宝福,陈洋,等.食用小龙虾致横纹肌溶解综合征事件的流行病学调查[J].现代预防医学,2012,39(20):5239-5240.
[11]HUANG X, LI Y P, HUANG Q, et al. A past Haff disease outbreak associated with eating freshwater pomfret in South China[J]. BMC Public Health, 2013, 13(1):447.
[12]CHEN Y, YUAN B J, XIE G X, et al. Outbreak of Haff disease caused by consumption of crayfish (Procambarus clarkii), Nanjing, Jiangsu Province, China[J]. Food Control, 2015, 59:690-694.
[13]DIAZ J H. Global incidence of rhabdomyolysis after cooked seafood consumption (Haff disease)[J]. Clinical Toxicology, 2015, 53(5):421.
[14]CHAN T Y. The emergence and epidemiology of Haff disease in China[J]. Toxins,2016,8(12):359.
[15]何韶衡. 基础过敏反应学[M]. 北京:科学出版社, 2009.
[16]ZHANG B, YANG G, YU X B, et al. Haff disease after eating crayfish in east China[J]. Internal Medicine, 2012, 51(5):487-489.
[17]XIE P, HU J, HUANG J M, et al. Crayfish-related Haff disease rhabdomyolysis; diagnosis supported by bone scintigraphy[J]. Hellenic Journal of Nuclear Medicine, 2013, 16(1):60-61.
[18]马宁, 李凤琴, 李宁,等. 食源性横纹肌溶解综合征概述[J]. 中国食品卫生杂志, 2010, 22(6):564-567.
[19]林江伟. 克氏原螯虾致横纹肌溶解危害物与过敏原的分析[D]. 厦门:集美大学, 2012.
[20]黄颂敏. 横纹肌溶解综合征的诊治[J]. 中国中西医结合肾病杂志, 2004, 5(4):187-188.
[21]张琴, 王杰赞, 黄卫东. 横纹肌溶解综合征的诊治进展[J]. 中华急诊医学杂志, 2011, 20(4):445-446.
[22]LUCK R P, VERBIN S. Rhabdomyolysis: a review of clinical presentation, etiology, diagnosis, and management[J]. Pediatric Emergency Care, 2008, 24(4):262-268.
[23]YUMUL R, STEEN S N, OSIBAMIRO-SEDUN A, et al. Rhabdomyolysis: a historical review with two illustrative cases[J]. Sedun, 2004(14):143-147.
[24]TSIRONI M, ANDRIOPOULOS P, XAMODRAKA E, et al. The patient with rhabdomyolysis: have you considered quail poisoning?[J]. Canadian Medical Association Journal, 2004, 171(4):325-326.
[25]LAMEIRAS J L V, COSTA O T F D, MORONI F T, et al. Systemic rhabdomyolysis induced by venom of freshwater stingrays plesiotrygon iwamae, and potamotrygon motoro, (chondrichthyes-potamotrygonidae) from the Amazon Basin[J]. Toxicon, 2014, 77(1):105-113.
[26]MATSUURA M, SAIKAWA Y, INUI K, et al. Identification of the toxic trigger in mushroom poisoning [J]. Nature Chemical Biology, 2009, 5(7):465.
[27]NIEMINEN P, MUSTONEN A M, KIRSI M. Increased plasma creatine kinase activities triggered by edible wild mushrooms[J]. Food and Chemical Toxicology, 2005, 43(1):133-138.
 黄琼,赵敏,王凤岩,谭剑斌,梁骏华,陈壁锋,李雪琪,周轶琳,汤莉,刘哲,谢晓萍,卢玲玲,黄俊明,邓小玲,杨杏芬,张永慧.小龙虾相关横纹肌溶解综合征的人群流行病学调查和小鼠体内触发试验研究[J].中国食品卫生杂志,2017,29(3):269-276.
黄琼,赵敏,王凤岩,谭剑斌,梁骏华,陈壁锋,李雪琪,周轶琳,汤莉,刘哲,谢晓萍,卢玲玲,黄俊明,邓小玲,杨杏芬,张永慧.小龙虾相关横纹肌溶解综合征的人群流行病学调查和小鼠体内触发试验研究[J].中国食品卫生杂志,2017,29(3):269-276.