
жқЁжҷ¶,зҺӢзәў,еј жЎӮ,зҶҠиЎҚж–Ү,йҮ‘дёң.иҮӘиҙЎеёӮиӮүеҸҠе…¶еҲ¶е“ҒдёӯзІӘиӮ зҗғиҸҢиҖҗиҚҜжҖ§жҜ’еҠӣеҹәеӣ е’ҢеӨҡдҪҚзӮ№еәҸеҲ—еҲҶжһҗ[J].дёӯеӣҪйЈҹе“ҒеҚ«з”ҹжқӮеҝ—,2017,29(3):277-282.
DOi:10.13590/j.cjfh.2017.03.005
иҮӘиҙЎеёӮиӮүеҸҠе…¶еҲ¶е“ҒдёӯзІӘиӮ зҗғиҸҢиҖҗиҚҜжҖ§жҜ’еҠӣеҹәеӣ е’ҢеӨҡдҪҚзӮ№еәҸеҲ—еҲҶжһҗ
жқЁжҷ¶1пјҢзҺӢзәў2пјҢеј жЎӮ1пјҢзҶҠиЎҚж–Ү1пјҢйҮ‘дёң1
(1.дёӯеӣҪз–ҫз—…йў„йҳІжҺ§еҲ¶дёӯеҝғдј жҹ“з—…жүҖ дј жҹ“з—…йў„йҳІжҺ§еҲ¶еӣҪ家йҮҚзӮ№е®һйӘҢе®ӨпјҢеҢ—дә¬102206пјӣ 2.иҮӘиҙЎеёӮз–ҫз—…йў„йҳІжҺ§еҲ¶дёӯеҝғпјҢеӣӣе·қ иҮӘиҙЎ643000)
дҪңиҖ…з®Җд»Ӣпјҡ жқЁжҷ¶еҘіеҠ©зҗҶз ”з©¶е‘ҳз ”з©¶ж–№еҗ‘дёәиӮ йҒ“з»ҶиҸҢеҲҶзҰ»йүҙе®ҡеҸҠж–°з—…еҺҹеҸ‘зҺ°E-mailпјҡyangjing@icdc.cn
йҖҡдҝЎдҪңиҖ…пјҡ йҮ‘дёңз”·еүҜз ”з©¶е‘ҳз ”з©¶ж–№еҗ‘дёәж–°з—…еҺҹеҸ‘зҺ°еҸҠз»ҶиҸҢиҖҗиҚҜE-mailпјҡjindong@icdc.cn
收зЁҝж—Ҙжңҹпјҡ 2017-04-13
еҹәйҮ‘йЎ№зӣ®пјҡ еӣҪ家иҮӘ然科еӯҰеҹәйҮ‘йҮҚеӨ§йЎ№зӣ®пјҲ81290340пјҢ81290345пјүпјӣеӣҪ家йҮҚзӮ№з ”еҸ‘и®ЎеҲ’пјҲ2016YFC1202700пјҢ2016YFC1201903пјү
ж‘ҳиҰҒ:зӣ®зҡ„ дәҶи§Јеӣӣе·қзңҒиҮӘиҙЎеёӮиӮүеҸҠе…¶еҲ¶е“ҒеҲҶзҰ»зІӘиӮ зҗғиҸҢзҡ„жҠ—з”ҹзҙ иҖҗиҚҜжҖ§е’ҢжҗәеёҰжҜ’еҠӣеҹәеӣ жғ…еҶөпјҢд»ҘеҸҠеӨҡйҮҚиҖҗиҚҜиҸҢж Әзҡ„еәҸеҲ—еҲҶеһӢпјҲSTпјүгҖӮж–№жі•2013е№ҙ4жңҲ17пҪһ21ж—ҘеҜ№147д»ҪиӮүеҸҠе…¶еҲ¶е“Ғж ·е“ҒжұЎжҹ“зҡ„зІӘиӮ зҗғиҸҢиҝӣиЎҢеҲҶзҰ»йүҙе®ҡпјҢдҪҝз”Ёе…ЁиҮӘеҠЁеҫ®з”ҹзү©йүҙе®ҡд»ӘеҜ№еҲҶзҰ»иҸҢж Әзҡ„иҖҗиҚҜжҖ§иҝӣиЎҢжЈҖйӘҢпјҢеә”з”ЁиҒҡеҗҲй…¶й“ҫејҸеҸҚеә”пјҲPCRпјүж–№жі•жЈҖжөӢеҲҶзҰ»еҲ°зҡ„зІӘиӮ зҗғиҸҢжҗәеёҰ4з§Қеёёи§ҒжҜ’еҠӣеҹәеӣ зҡ„жғ…еҶөпјҢ并еҜ№еӨҡйҮҚиҖҗиҚҜиҸҢж ӘиҝӣиЎҢеӨҡдҪҚзӮ№еәҸеҲ—еҲҶеһӢпјҲMLSTпјүз ”з©¶гҖӮз»“жһңд»Һ147д»ҪиӮүеҸҠе…¶еҲ¶е“Ғж ·е“Ғдёӯе…ұеҲҶзҰ»еҲ°65ж ӘзІӘиӮ зҗғиҸҢпјҢе…¶дёӯиҖҗиҚҜиҸҢж ӘжҜ”дҫӢдёә58.5%пјҲ38/65пјүпјӣеҲҶзҰ»иҸҢж ӘеҜ№еӣӣзҺҜзҙ зҡ„иҖҗиҚҜзҺҮжңҖй«ҳпјҢдёә41.5%пјҲ27/65пјүпјҢеҜ№еҲ©зҰҸе№ігҖҒж°Ҝйңүзҙ е’Ңзәўйңүзҙ д№ҹеқҮжңүиҫғй«ҳзҡ„иҖҗиҚҜзҺҮпјӣеҲҶзҰ»иҸҢж ӘеҜ№й«ҳжө“еәҰй“ҫйңүзҙ е’Ңй«ҳжө“еәҰеәҶеӨ§йңүзҙ зҡ„иҖҗиҚҜзҺҮеҲҶеҲ«иҫҫеҲ°дәҶ15.4%пјҲ10/65пјүе’Ң12.3%пјҲ8/65пјүпјӣжңӘеҲҶзҰ»еҲ°еҜ№йқ’йңүзҙ зұ»пјҲйқ’йңүзҙ е’Ңж°ЁиӢ„иҘҝжһ—пјүгҖҒзі–иӮҪзұ»пјҲдёҮеҸӨйңүзҙ пјүе’Ңи„ӮиӮҪзұ»пјҲиҫҫжүҳйңүзҙ пјүжҠ—з”ҹзҙ иҖҗиҚҜзҡ„иҸҢж ӘгҖӮ4з§Қеёёи§ҒжҜ’еҠӣеҹәеӣ пјҲgelEгҖҒasa1гҖҒespгҖҒcylAпјүеңЁ65ж ӘеҲҶзҰ»ж ӘдёӯеқҮжңүжҗәеёҰпјҢйҳіжҖ§зҺҮеҲҶеҲ«дёә.9%пјҲ37/65пјүгҖҒ21.5%пјҲ14/65пјүгҖҒ9.2%пјҲ6/65пјүе’Ң7.7%пјҲ5/65пјүгҖӮ14ж ӘеӨҡйҮҚиҖҗиҚҜиҸҢж Әе…ұжңү9дёӘMLSTеһӢеҲ«пјҢеҢ…жӢ¬4ж ӘST16гҖҒ2ж ӘST81е’Ң2ж ӘST480иҸҢж ӘпјҢдё”зӣёеҗҢSTеһӢеҲ«зҡ„зІӘиӮ зҗғиҸҢжңүзӣёдјјзҡ„иҖҗиҚҜи°ұе’ҢжҜ’еҠӣеҹәеӣ жҗәеёҰжғ…еҶөгҖӮз»“и®әеӣӣе·қзңҒиҮӘиҙЎеёӮиӮүеҸҠе…¶еҲ¶е“ҒдёӯзӣёеҗҢSTеһӢеҲ«зҡ„зІӘиӮ зҗғиҸҢжңүзӣёдјјзҡ„иҖҗиҚҜи°ұе’ҢжҜ’еҠӣеҹәеӣ жҗәеёҰжғ…еҶөпјҢеә”йҮҚи§ҶиӮүеҸҠе…¶еҲ¶е“ҒдёӯиҖҗиҚҜзІӘиӮ зҗғиҸҢеҜ№е…¬дј—еҒҘеә·зҡ„жҪңеңЁеЁҒиғҒгҖӮ
е…ій”®иҜҚ:
иӮүпјӣ иӮүеҲ¶е“Ғпјӣ зІӘиӮ зҗғиҸҢпјӣ иҖҗиҚҜжҖ§пјӣ жҜ’еҠӣеҹәеӣ пјӣ еӨҡдҪҚзӮ№еәҸеҲ—еҲҶжһҗпјӣ йЈҹжәҗжҖ§иҮҙз—…иҸҢпјӣ иҮӘиҙЎеёӮ
дёӯеӣҫеҲҶзұ»еҸ·пјҡ R155 ж–ҮзҢ®ж ҮиҜҶз ҒпјҡA ж–Үз« зј–еҸ·пјҡ1004-8456(2017)03-0277-06
Antimicrobial susceptibility, virulence genes and multilocus sequence typing of
Enterococcus faecalis strains isolated from meat and meat products in Zigong City
YANG Jing1пјҢ WANG Hong2пјҢ ZHANG Gui1пјҢ XIONG Yan-wen1пјҢ JIN Dong1
(1.State Key Laboratory of Infectious Disease Prevention and ControlпјҢNational Institute for Communicable Disease Control and PreventionпјҢChinese Center for Disease Control and PreventionпјҢBeijing 102206пјҢ Chinaпјӣ 2.Zigong Center for Disease Control and PreventionпјҢSichuan Zigong 643000пјҢChina)
Abstract:Objective To investigate the antibiotic resistance and the distribution of virulence genes in Enterococcus faecalis isolated from meat and meat products collected from food market in Zigong City, Sichuan Province, and to observe sequence typingпјҲSTпјүidentified by multilocus sequence typing (MLST) among multi-drug resistant Enterococcus faecalis. MethodsEnterococcus faecalis strains were isolated from 147 meat samples including raw meats and cooked meats from 17 to 21 April,2013. The antimicrobial susceptibilities of Enterococcus faecalis isolates were determined by automatic bacteriology identification. The presence of four virulence genes (cylA, asa1, gelE and esp) were investigated by polymerase chain reactionпјҲPCRпјү, and ST types were detected in multi-drug resistant isolates. ResultsA total of 65 isolates were obtained from 147 samples, 58.5%пјҲ38/65пјүof the isolates were resistant to at least one drug. Of all isolates, resistance to tetracycline was the highest (41.5%,27/65), and resistance to rifampicin, chloramphenicol and erythromycin was also fairly high. Moreover, resistance to high concentrations of streptomycin and gentamicin in Enterococcus faecalis isolates were 15.4% пјҲ10/65пјү and 12.3% пјҲ8/65пјү, respectively. Strains resistant to penicillin, glycopeptides and lipopeptides were failed to acquire in this study. Four virulence genes which were common in Enterococcus faecalis were distributed in all 65 isolates, and the positive rates of gelE , asa1, esp and cylA were 56.9%пјҲ37/65пјү,21.5%пјҲ14/65пјү,9.2%пјҲ6/65пјү and 7.7%пјҲ5/65пјү, respectively. There were 14 isolates, which showed resistance to three or more antibiotics, belonged to 9 STs mainly comprised of ST16 (n=4), ST81 (n=2) and ST480 (n=2). The profile of resistance and virulence genes were similar in the Enterococcus faecalis isolates with same STs. ConclusionThe same ST type of Enterococcus faecalis strains from meat and meat products in Zigong City harbored similar virulence genes and multi-drug resistant pattern, which should be paid attention to the potential threat to human health.
Key words:
Meatпјӣ meat productsпјӣ Enterococcus faecalisпјӣ antimicrobial susceptibilityпјӣ virulence geneпјӣ multilocus sequence typingпјӣ foodborne pathogensпјӣ Zigong City
зІӘиӮ зҗғиҸҢжҳҜжҲ‘еӣҪеҶңдёҡйғЁжү№еҮҶзҡ„еҸҜз”ЁдәҺйҘІж–ҷж·»еҠ зҡ„иҸҢз§Қд№ӢдёҖпјҢе…¶еңЁз•ңзҰҪе…»ж®–е’ҢиӮүеҲ¶е“Ғз”ҹдә§еҠ е·Ҙзҡ„еҗ„дёӘзҺҜиҠӮдёӯйғҪжңүеҲҶеёғпјҢжҳҜиҜ„дј°йЈҹе“ҒгҖҒйЈҹе“ҒеҠ е·Ҙи®ҫеӨҮеҸҠйЈҹе“Ғз”ҹдә§зҺҜеўғеҚ«з”ҹзҠ¶еҶөзҡ„жҢҮж ҮиҸҢд№ӢдёҖгҖӮиҖҗиҚҜиӮ зҗғиҸҢе·Із»ҸжҲҗдёәйҷўеҶ…ж„ҹжҹ“зҡ„йҮҚиҰҒз—…еҺҹиҸҢгҖӮ2014е№ҙжҲ‘еӣҪдё»иҰҒең°еҢәдёҙеәҠеҲҶзҰ»йқ©е…°йҳіжҖ§иҸҢдёӯпјҢиӮ зҗғиҸҢеұһиҸҢж ӘеҚ 第дәҢдҪҚпјҢе…¶дёӯзІӘиӮ зҗғиҸҢзҡ„жҜ”дҫӢдёә45.4%
пј»1пјҪгҖӮйЈҹжәҗжҖ§йҖ”еҫ„жҳҜиҖҗиҚҜиҸҢж ӘпјҲеҢ…жӢ¬е…¶иҖҗиҚҜеҹәеӣ пјүз”ұеҠЁзү©еҲ°дәәзҡ„дё»иҰҒдј ж’ӯйҖ”еҫ„гҖӮеҠЁзү©иӮ йҒ“иҮҙз—…иҸҢе’ҢиҖҗиҚҜиҸҢеҰӮжІҷй—ЁиҸҢгҖҒз©әиӮ ејҜжӣІиҸҢзӯүеңЁеұ е®°е’ҢйЈҹе“ҒеҠ е·ҘиҝҮзЁӢдёӯжһҒжҳ“жұЎжҹ“иӮүеҸҠе…¶еҲ¶е“ҒпјҢдәәеңЁж‘„йЈҹиҝҷдәӣйЈҹзү©еҗҺйҷӨдәҶдјҡйҖ жҲҗйЈҹжәҗжҖ§дј жҹ“з—…зҡ„жҡҙеҸ‘еӨ–пјҢз»ҶиҸҢзҡ„иҖҗиҚҜжҖ§д№ҹдјҡйҖ жҲҗдёҙеәҠжІ»з–—зҡ„еӣ°йҡҫе’ҢиҖҗиҚҜеҹәеӣ зҡ„дј ж’ӯ
пј»2-5пјҪгҖӮ然иҖҢзҺ°еңЁеҜ№дәҺйЈҹе“ҒдёӯзІӘиӮ зҗғиҸҢзҡ„иҖҗиҚҜжҖ§гҖҒиҮҙз—…еҹәеӣ гҖҒеҹәеӣ еҲҶеһӢзӯүзү№еҫҒзҡ„дәҶи§Јиҫғе°‘пјҢеӣ жӯӨејҖеұ•иӮүеҸҠе…¶еҲ¶е“ҒеҲҶзҰ»зІӘиӮ зҗғиҸҢиҖҗиҚҜеҸҠжҜ’еҠӣеҹәеӣ жҗәеёҰзү№еҫҒи°ғжҹҘпјҢеҜ№дәҺдәҶи§Јең°еҢәиҢғеӣҙеҶ…иӮүеҸҠе…¶еҲ¶е“ҒдёӯзІӘиӮ зҗғиҸҢеҜ№дәәзұ»еҒҘеә·зҡ„жҪңеңЁеЁҒиғҒе…·жңүйҮҚиҰҒж„Ҹд№үгҖӮеӨҡдҪҚзӮ№еәҸеҲ—еҲҶеһӢпјҲmultilocus sequence typingпјҢMLSTпјүжҳҜдёҖз§ҚеҹәдәҺ管家еҹәеӣ еәҸеҲ—жҜ”еҜ№зҡ„еҲҶеӯҗеҲҶеһӢж–№жі•пјҢз”ұдәҺе…¶ж“ҚдҪңз®ҖеҚ•пјҢз»“жһңе®ўи§ӮеҸҜйқ пјҢдё”жҳ“дәҺе®һйӘҢе®Өй—ҙжҜ”иҫғзҡ„зү№зӮ№иҖҢе№ҝжіӣз”ЁдәҺеӨҡз§Қз—…еҺҹиҸҢзҡ„жөҒиЎҢз—…еӯҰз ”з©¶гҖӮйҖҡиҝҮе…¬е…ұж•°жҚ®еә“пјҢMLSTеҸҜд»Ҙе®һзҺ°жҹҗдәӣз—…еҺҹиҸҢеңЁе…ЁзҗғиҢғеӣҙзҡ„й•ҝжңҹж•°жҚ®жҜ”иҫғеҲҶжһҗ
пј»6пјҪгҖӮеңЁж¬§жҙІзҡ„дёҖйЎ№еҜ№еӨҡдёӘеӣҪ家еҢ»йҷўе’ҢзӨҫеҢәеҲҶзҰ»зҡ„зІӘиӮ зҗғиҸҢз ”з©¶
пј»7пјҪиЎЁжҳҺпјҢеӨҡйҮҚиҖҗиҚҜзІӘиӮ зҗғиҸҢеӨҡеұһдәҺCC2пјҢCC16е’ҢCC87дёүдёӘе…ӢйҡҶзҫӨгҖӮе…¶дёӯCC16пјҲST16дёәдё»иҰҒд»ЈиЎЁпјүе…ӢйҡҶзҫӨзҡ„еӨҡйҮҚиҖҗиҚҜзІӘиӮ зҗғиҸҢеңЁеҢ»йҷўе’ҢзӨҫеҢәйғҪжңүеҲҶеёғпјҢдё”зӨҫеҢәдёӯеҜ№й«ҳжө“еәҰж°Ёеҹәзі–иӢ·зұ»жҠ—з”ҹзҙ иҖҗиҚҜзҡ„зІӘиӮ зҗғиҸҢз»қеӨ§еӨҡж•°йғҪдёәST16еһӢгҖӮеӨҡдёӘиҮҙз—…еҹәеӣ еҸӮдёҺзІӘиӮ зҗғиҸҢзҡ„иҮҙз—…иҝҮзЁӢпјҢе…¶ж„ҹжҹ“жңәеҲ¶иҫғдёәеӨҚжқӮпјҢзӣ®еүҚз ”з©¶иҫғйҖҸеҪ»зҡ„иҮҙз—…еҹәеӣ дёәз»Ҷиғһжә¶иЎҖзҙ пјҲcytolysinпјҢcylAпјүгҖҒжҳҺиғ¶й…¶EпјҲgelatinaseпјҢgelEпјүгҖҒиЎЁйқўиӣӢзҷҪпјҲenterococcal surface proteinпјҢespпјүе’ҢиҒҡйӣҶзү©иҙЁпјҲaggregation substanceпјҢasa1пјүиҝҷ4з§Қ
пј»8-11пјҪгҖӮз ”з©¶зІӘиӮ зҗғиҸҢжҗәеёҰжҜ’еҠӣеҹәеӣ зҡ„жғ…еҶөпјҢ并еҜ№е…¶иҝӣиЎҢеҲҶеӯҗеҲҶеһӢеҸҜд»Ҙжңүж•ҲзӯӣжҹҘеҮәе…·жңүжҪңеңЁиҮҙз—…жҖ§зҡ„зІӘиӮ зҗғиҸҢгҖӮжң¬з ”究еҜ№еӣӣе·қзңҒиҮӘиҙЎеёӮеӨҡдёӘиҸңеёӮеңәгҖҒеҶңиҙёеёӮеңәе’ҢйӨҗйҰҶиҙ©еҚ–иӮүеҸҠе…¶еҲ¶е“ҒжҗәеёҰзҡ„зІӘиӮ зҗғиҸҢиҝӣиЎҢз ”з©¶пјҢдәҶи§Је…¶иҖҗиҚҜеҸҠжҗәеёҰжҜ’еҠӣеҹәеӣ зҡ„жғ…еҶөпјҢ并еҜ№еӨҡйҮҚиҖҗиҚҜзІӘиӮ зҗғиҸҢиҝӣиЎҢMLSTеҲҶжһҗпјҢд»ҘдәҶи§ЈиҜҘең°еҢәиӮүеҸҠе…¶еҲ¶е“ҒдёӯжҗәеёҰе…·жңүжҪңеңЁиҮҙз—…жҖ§зІӘиӮ зҗғиҸҢзҡ„жғ…еҶөпјҢиҜ„дј°е…¶еҜ№дәәзұ»еҒҘеә·зҡ„жҪңеңЁеЁҒиғҒгҖӮ
1жқҗж–ҷдёҺж–№жі•
1.1жқҗж–ҷ
1.1.1ж ·е“ҒйҮҮйӣҶе’ҢиҸҢж ӘжқҘжәҗ
2013е№ҙ4жңҲ17пҪһ21ж—ҘеңЁеӣӣе·қзңҒиҮӘиҙЎеёӮзҡ„6дёӘиҸңеёӮеңәгҖҒеҶңиҙёеёӮеңәе’ҢйӨҗйҰҶйҮҮйӣҶиӮүеҸҠе…¶еҲ¶е“Ғж ·е“Ғ147д»ҪгҖӮж ·е“ҒеҢ…жӢ¬з”ҹиӮүпјҲз”ҹзүӣиӮүпјүгҖҒи…ҠиӮүгҖҒзҶҹиӮүеҲ¶е“Ғе’Ңй…ұеҚӨиӮүеҲ¶е“ҒгҖӮиҚҜж•ҸиҜ•йӘҢиҙЁжҺ§иҸҢж ӘзІӘиӮ зҗғиҸҢпјҲATCC 29212пјүдёәжң¬е®һйӘҢе®Өдҝқи—ҸгҖӮжҜ’еҠӣеҹәеӣ жЈҖжөӢйҳіжҖ§еҜ№з…§иҸҢж ӘеұҺиӮ зҗғиҸҢпјҲATCC BAA-472пјүе’ҢзІӘиӮ зҗғиҸҢпјҲATCC 51299пјүеқҮиҙӯиҮӘзҫҺеӣҪжЁЎејҸеҹ№е…»зү©йӣҶеӯҳеә“пјҲAmerican Type Culture CollectionпјҢATCCпјүгҖӮ
1.1.2дё»иҰҒд»ӘеҷЁдёҺиҜ•еүӮ
MicroScan WalkAway 40 SIе…ЁиҮӘеҠЁеҫ®з”ҹзү©йүҙе®ҡд»ӘпјҲзҫҺеӣҪиҙқе…Ӣжӣјеә“е°”зү№пјүгҖҒSensoQuest Labcycler PCRд»ӘпјҲеҫ·еӣҪSensoпјүгҖҒGel Doc XR+SystemеҮқиғ¶жҲҗеғҸзі»з»ҹпјҲзҫҺеӣҪBio-RadпјүгҖҒBAGMIXERеқҮиҙЁеҷЁгҖӮEx Taq
TM Version 2.0 plus dyeпјҲеӨ§иҝһе®қз”ҹзү©е·ҘзЁӢжңүйҷҗе…¬еҸёпјүпјӣBacteriaGen DNAз»ҶиҸҢеҹәеӣ з»„жҸҗеҸ–иҜ•еүӮзӣ’пјҲеҢ—дә¬еә·дёәдё–зәӘе…¬еҸёпјүпјӣPos MIC Panel Type 29йқ©е…°йҳіжҖ§иҸҢиҚҜж•ҸжқҝпјҲзҫҺеӣҪиҙқе…Ӣжӣјеә“е°”зү№пјүпјӣе“ҘдјҰжҜ”дәҡиЎҖе№іжқҝпјҲиӢұеӣҪOxoidпјүпјӣKFй“ҫзҗғиҸҢйҖүжӢ©жҖ§еҹ№е…»еҹәпјҲеҢ—дә¬йҷҶжЎҘжҠҖжңҜжңүйҷҗе…¬еҸёпјүпјӣеј•зү©з”ұз”ҹе·Ҙз”ҹзү©е·ҘзЁӢпјҲдёҠжө·пјүжңүйҷҗе…¬еҸёеҗҲжҲҗпјҢPCRдә§зү©зәҜеҢ–еҸҠжөӢеәҸз”ұеҢ—дә¬еӨ©дёҖиҫүиҝңз”ҹзү©з§‘жҠҖжңүйҷҗе…¬еҸёе®ҢжҲҗгҖӮ
1.2ж–№жі•
1.2.1ж ·е“ҒеӨ„зҗҶ
еңЁж— иҸҢжқЎд»¶дёӢеҸ–25 gиӮүеҸҠиӮүеҲ¶е“Ғж”ҫе…ҘиЈ…жңү225 mlзј“еҶІиӣӢзҷҪиғЁж°ҙзҡ„еқҮиҙЁиўӢдёӯпјҢд»Ҙ8 000 r/minеқҮиҙЁ1пҪһ2 minпјҢеҲ¶жҲҗ1вҲ¶10зҡ„ж ·е“ҒеҢҖж¶ІгҖӮ
1.2.2иҸҢж ӘеҲҶзҰ»е’Ңйүҙе®ҡ
е°ҶеӨ„зҗҶеҗҺзҡ„ж ·е“ҒжҺҘз§ҚдәҺKFй“ҫзҗғиҸҢйҖүжӢ©жҖ§еҹ№е…»еҹәпјҢ37 в„ғгҖҒ5%CO2жқЎд»¶дёӢеҹ№е…»48 hгҖӮжҢ‘йҖү3пҪһ5дёӘеҸҜз–‘еҚ•иҸҢиҗҪпјҲзҙ«иүІгҖҒеңҶж¶ҰгҖҒеӨ§иҸҢиҗҪпјүжҺҘз§ҚдәҺе“ҘдјҰжҜ”дәҡиЎҖе№іжқҝдёҠиҝӣиЎҢзәҜеҢ–еҹ№е…»гҖӮйҮҮз”ЁAPI 20 Strepз”ҹеҢ–йүҙе®ҡзі»з»ҹеҜ№зәҜеҹ№е…»зү©иҝӣиЎҢз”ҹеҢ–йүҙе®ҡпјӣеҗҢж—¶дҪҝз”ЁDNAиҜ•еүӮзӣ’жҢүз…§иҜҙжҳҺд№ҰжҸҗеҸ–зәҜеҹ№е…»зү©зҡ„еҹәеӣ з»„ж ёй…ёпјҢиҝӣиЎҢ16S rDNAеәҸеҲ—е’ҢsodAеҹәеӣ еәҸеҲ—
пј»12пјҪйүҙе®ҡгҖӮжҜҸд»ҪйҳіжҖ§ж ·е“Ғд»…дҝқз•ҷ1ж ӘзІӘиӮ зҗғиҸҢгҖӮ
1.2.3иҚҜж•ҸиҜ•йӘҢ
дҪҝз”ЁMicroScan WalkAway 40 SIе…ЁиҮӘеҠЁеҫ®з”ҹзү©йүҙе®ҡд»ӘеҸҠе…¶й…ҚеҘ—зҡ„Pos MIC Panel Type 29йқ©е…°йҳіжҖ§иҸҢиҚҜж•ҸжқҝпјҢжҢүз…§д»ӘеҷЁе’ҢиҚҜж•ҸжқҝдҪҝз”ЁиҜҙжҳҺпјҢдҪҝз”Ёеҝ«йҖҹжҺҘз§Қжі•иҝӣиЎҢиҚҜж•ҸиҜ•йӘҢгҖӮиҚҜж•Ҹз»“жһңеҲӨж–ӯеҸӮз…§2015е№ҙзҫҺеӣҪдёҙеәҠе’Ңе®һйӘҢе®Өж ҮеҮҶеҚҸдјҡпјҲCLSIпјүж ҮеҮҶ
пј»13пјҪгҖӮ
1.2.4жҜ’еҠӣеҹәеӣ зҡ„жЈҖжөӢ
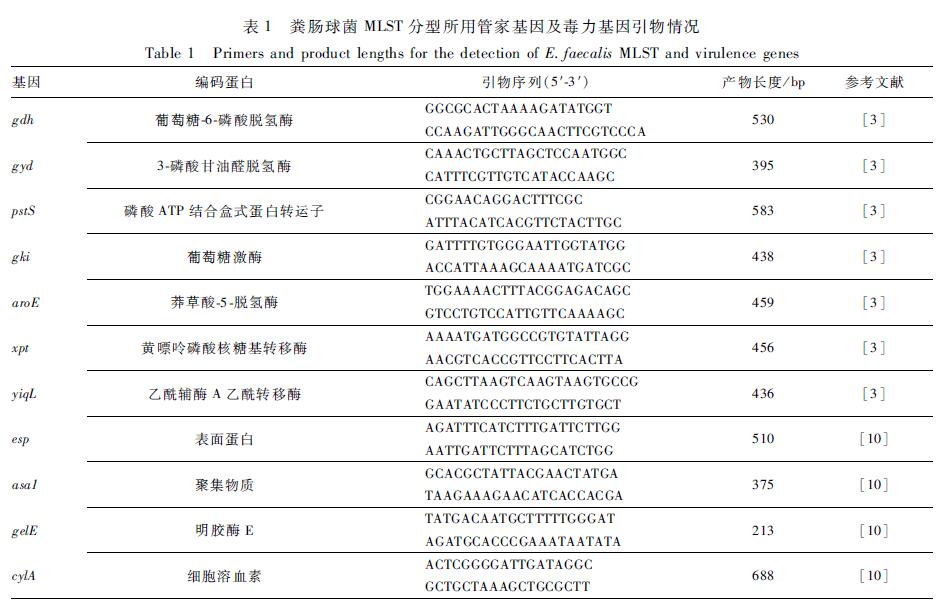
дҪҝз”ЁиҒҡеҗҲй…¶й“ҫејҸеҸҚеә”пјҲPCRпјүж–№жі•еҜ№зІӘиӮ зҗғиҸҢеҲҶзҰ»ж Әзҡ„4з§ҚжҜ’еҠӣеҹәеӣ пјҡcylAгҖҒgelEгҖҒespгҖҒasa1иҝӣиЎҢжЈҖжөӢгҖӮеј•зү©еәҸеҲ—еҸҠдә§зү©й•ҝеәҰи§ҒиЎЁ1гҖӮPCRеҸҚеә”дҪ“зі»дёәпјҡ2Г—Ex Taq Mix 10 ОјlпјҢ10 Ојmol/Lзҡ„дёҠдёӢжёёеј•зү©еҗ„1 ОјlпјҢжЁЎжқҝDNA 1.0 ОјlпјҢеҠ ж°ҙиҮі20 ОјlгҖӮ
PCRеҸҚеә”зЁӢеәҸдёәпјҡ94 в„ғйў„еҸҳжҖ§5 minпјӣ94 в„ғеҸҳжҖ§30 sпјҢ52 в„ғйҖҖзҒ«30 sпјҢ72 в„ғ延伸45 sпјҢ30дёӘеҫӘзҺҜпјӣ72 в„ғ延伸10 minгҖӮйҳіжҖ§еҜ№з…§еҹәеӣ дёәеұҺиӮ зҗғиҸҢпјҲATCC BAA-472пјҢasa1гҖҒgelEеҹәеӣ йҳіжҖ§пјүе’ҢзІӘиӮ зҗғиҸҢпјҲATCC 51299пјҢespеҹәеӣ йҳіжҖ§пјүгҖӮ
еҜ№cylAеҹәеӣ жү©еўһйҳіжҖ§дә§зү©иҝӣиЎҢеәҸеҲ—жөӢе®ҡе’ҢжҜ”еҜ№д»ҘзЎ®и®Өз»“жһңгҖӮ
1.2.5MLSTеҲҶжһҗ
зІӘиӮ зҗғиҸҢзҡ„MLSTиҜ•йӘҢж–№жЎҲеҸӮиҖғзІӘиӮ зҗғиҸҢMLSTж•°жҚ®еә“пјҲhttp://pubmlst.org/efaecalis/пјүжҸҗдҫӣзҡ„еҲҶеһӢж–№жЎҲпјҢ7дёӘ管家еҹәеӣ gdhгҖҒgydгҖҒpstSгҖҒgkiгҖҒaroEгҖҒxptе’ҢyqiLзҡ„еј•зү©еәҸеҲ—еҸҠдә§зү©еӨ§е°Ҹи§ҒиЎЁ1гҖӮPCRеҸҚеә”дҪ“зі»дёәпјҡ2Г—Ex Taq Mix 25 ОјlпјҢ10 Ојmol/Lзҡ„дёҠдёӢжёёеј•зү©еҗ„2.5 ОјlпјҢжЁЎжқҝDNA 2.0 ОјlпјҢеҠ ж— иҸҢж°ҙиҮі50 ОјlгҖӮPCRеҸҚеә”зЁӢеәҸпјҡ94 в„ғйў„еҸҳжҖ§5 minпјӣ94 в„ғеҸҳжҖ§30 sпјҢ52 в„ғйҖҖзҒ«30 sпјҢ72 в„ғ延伸45 sпјҢ30дёӘеҫӘзҺҜпјӣ72 в„ғ延伸10 minгҖӮPCRдә§зү©з»ҸзәҜеҢ–еҗҺпјҢиҝӣиЎҢеҸҢеҗ‘жөӢеәҸгҖӮеәҸеҲ—еҲҶжһҗз”ЁSeqManиҪҜ件еҜ№зӯүдҪҚеҹәеӣ еәҸеҲ—иҝӣиЎҢжӢјжҺҘе’Ңж ЎжӯЈпјҢе°Ҷж•ҙзҗҶеҘҪзҡ„еәҸеҲ—жҸҗдәӨиҮіMLSTж•°жҚ®еә“пјҢзЎ®е®ҡжҜҸдёӘ管家еҹәеӣ зҡ„еәҸеҲ—еҸ·пјҢ7дёӘ管家еҹәеӣ еәҸеҲ—еҸ·зҡ„з»„еҗҲеҚідёәиҜҘиҸҢж Әзҡ„STеһӢгҖӮеә”з”ЁeBURSTиҪҜ件жһ„е»әeBURSTеӣҫд»ҘзЎ®е®ҡеҲҶзҰ»иҸҢж ӘдёҺж•°жҚ®еә“е…¶д»–иҸҢж Әзҡ„е…ізі»пјҢд»ҘдёӨдёӘзӯүдҪҚеҹәеӣ зҡ„е·®ејӮдёәе®ҡд№үе…ӢйҡҶзҫӨзҡ„ж ҮеҮҶгҖӮ
2з»“жһң
2.1иҸҢж ӘеҲҶзҰ»еҸҠиҖҗиҚҜеҲҶжһҗ
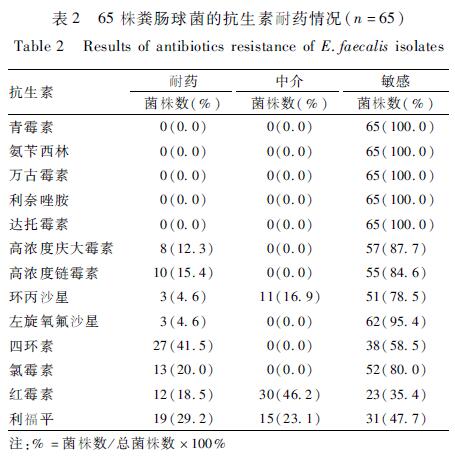
147д»ҪиӮүеҸҠе…¶еҲ¶е“Ғж ·е“Ғдёӯе…ұжңү65д»Ҫж ·е“ҒеҲҶзҰ»еҮәзІӘиӮ зҗғиҸҢпјҲ65ж ӘпјүпјҢйҳіжҖ§зҺҮдёә44.2%пјҲ65/147пјүгҖӮ65ж ӘзІӘиӮ зҗғиҸҢеҜ№13з§Қеёёи§ҒжҠ—з”ҹзҙ иЎЁзҺ°еҮәдёҚеҗҢзЁӢеәҰзҡ„иҖҗиҚҜжғ…еҶөпјҢиҜҰз»Ҷз»“жһңи§ҒиЎЁ2гҖӮе…¶дёӯиҖҗиҚҜзІӘиӮ зҗғиҸҢдёә38ж ӘпјҢиҖҗиҚҜзҺҮдёә58.5%пјҲ38/65пјүгҖӮеңЁ38ж ӘиҖҗиҚҜзІӘиӮ зҗғиҸҢиҸҢж ӘдёӯпјҢд»…еҜ№1з§ҚжҠ—з”ҹзҙ иҖҗиҚҜзҡ„иҸҢж Әжңү18ж ӘпјҢеҜ№2з§ҚжҠ—з”ҹзҙ иҖҗиҚҜзҡ„иҸҢж Әжңү6ж ӘпјҢеӨҡйҮҚиҖҗиҚҜиҸҢж Әжңү14ж ӘгҖӮдёҚиҖҗиҚҜзҡ„иҸҢж Әе…ұ27ж ӘпјҢе…¶дёӯ3ж ӘиҸҢж ӘеҜ№13з§ҚжҠ—з”ҹзҙ е…ЁйғЁж•Ҹж„ҹпјҢеҜ№1пҪһ2з§ҚжҠ—з”ҹзҙ дёӯд»Ӣзҡ„иҸҢж Әжңү24ж ӘгҖӮ65ж ӘеҲҶзҰ»зҡ„зІӘиӮ зҗғиҸҢеҜ№еӣӣзҺҜзҙ зҡ„иҖҗиҚҜзҺҮжңҖй«ҳпјҢиҫҫеҲ°дәҶ41.5%пјҲ27/65пјүпјӣеҜ№еҲ©зҰҸе№іе’Ңж°Ҝйңүзҙ зҡ„иҖҗиҚҜзҺҮж¬Ўд№ӢпјҢеҲҶеҲ«дёә29.2%пјҲ19/65пјүе’Ң20.0%пјҲ13/65пјүпјӣ
2.2жҜ’еҠӣеҹәеӣ еҲҶеёғжғ…еҶө
еҜ№65ж ӘзІӘиӮ зҗғиҸҢиҝӣиЎҢ4з§Қеёёи§ҒжҜ’еҠӣеҹәеӣ пјҲcylAгҖҒgelEгҖҒespе’Ңasa1пјүжҗәеёҰжғ…еҶөжЈҖжөӢпјҢз»“жһңиЎЁжҳҺ4з§ҚжҜ’еҠӣеҹәеӣ еңЁ65ж ӘеҲҶзҰ»ж ӘдёӯеқҮжңүжҗәеёҰпјҢе…¶дёӯgelEеҹәеӣ йҳіжҖ§зҺҮжңҖй«ҳпјҢдёә56.9%пјҲ37/65пјүпјҢasa1гҖҒespе’ҢcylAеҹәеӣ зҡ„йҳіжҖ§зҺҮеҲҶеҲ«дёә21.5%пјҲ14/65пјүгҖҒ9.2%пјҲ6/65пјүе’Ң7.7%пјҲ5/65пјүгҖӮиҖҗиҚҜзІӘиӮ зҗғиҸҢgelEеҹәеӣ йҳіжҖ§зҺҮдёә73.7%пјҲ28/38пјүпјҢиҖҢдёҚиҖҗиҚҜзҡ„иҸҢж ӘйҳіжҖ§зҺҮдёә33.3%пјҲ9/27пјүгҖӮasa1еҹәеӣ еңЁзІӘиӮ зҗғиҸҢдёӯзҡ„жҗәеёҰжғ…еҶөдёҺgelEеҹәеӣ зӣёдјјпјҢе…¶еңЁиҖҗиҚҜиҸҢж Әдёӯзҡ„йҳіжҖ§зҺҮдёә28.9%пјҲ11/38пјүпјҢиҖҢеңЁдёҚиҖҗиҚҜиҸҢж Әдёӯзҡ„йҳіжҖ§зҺҮдёә11.1%пјҲ3/27пјүгҖӮйҷӨ1ж ӘдёҚиҖҗиҚҜиҸҢж ӘжҗәеёҰespеҹәеӣ еӨ–пјҢе…¶д»–espеҹәеӣ йҳіжҖ§иҸҢж ӘеқҮдёәеӨҡйҮҚиҖҗиҚҜзІӘиӮ зҗғиҸҢпјҢcylAеҹәеӣ зҡ„жҗәеёҰжғ…еҶөдёҺespеҹәеӣ дёҖиҮҙгҖӮ
2.3MLSTеҲҶжһҗ
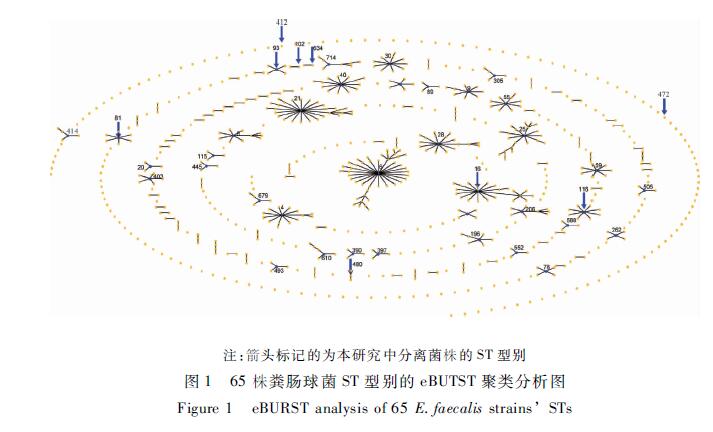
14ж ӘеӨҡйҮҚиҖҗиҚҜиҸҢж Әе…ұжңү9дёӘMLSTеһӢеҲ«пјҢеҲҶеҲ«дёәST16пјҲ4ж ӘпјүгҖҒST81пјҲ2ж ӘпјүгҖҒST480пјҲ2ж Әпјүд»ҘеҸҠST93гҖҒST102гҖҒST116гҖҒST412гҖҒST472е’ҢST634еҗ„1ж ӘпјҢеҗ„дёӘSTеһӢеҲ«еңЁMLSTж•°жҚ®еә“дёӯзҡ„дҪҚзҪ®и§Ғеӣҫ1гҖӮзӣёеҗҢSTеһӢеҲ«зҡ„зІӘиӮ зҗғиҸҢжңүзӣёдјјзҡ„иҖҗиҚҜи°ұе’ҢжҜ’еҠӣеҹәеӣ жҗәеёҰжғ…еҶөгҖӮеңЁ4ж ӘST16зІӘиӮ зҗғиҸҢдёӯйҷӨ1ж ӘдёәеҲ©зҰҸе№ідёӯд»ӢпјҢдё”espеҹәеӣ йҳҙжҖ§зҡ„иҸҢз§ҚеӨ–пјҢе…¶д»–3ж Әзҡ„иҖҗиҚҜи°ұе’ҢжҜ’еҠӣеҹәеӣ жҗәеёҰжғ…еҶөдёҖиҮҙпјҢиҖҗиҚҜи°ұдёәй«ҳжө“еәҰеәҶеӨ§йңүзҙ -еӣӣзҺҜзҙ -ж°Ҝйңүзҙ -зәўйңүзҙ -еҲ©зҰҸе№іпјҢesp-asa1-cylAйҳіжҖ§гҖӮиҖҢST81е’ҢST480иҖҗиҚҜи°ұе’ҢжҜ’еҠӣеҹәеӣ жҗәеёҰжғ…еҶөд№ҹеӯҳеңЁдёҖиҮҙжҖ§пјҢиЎЁзҺ°дёә2ж ӘST81иҸҢж ӘиҖҗиҚҜи°ұдёәеӣӣзҺҜзҙ -ж°Ҝйңүзҙ -еҲ©зҰҸе№іпјҢзәўйңүзҙ дёӯд»Ӣе’ҢgelEеҹәеӣ йҳіжҖ§пјӣ2ж ӘST480иҸҢж ӘеҲҷжҳҜеҜ№жң¬иҜ•йӘҢдёӯзҡ„13з§ҚжҠ—з”ҹзҙ йғҪиҖҗиҚҜпјҢеҗҢж—¶espеҹәеӣ е‘ҲйҳіжҖ§гҖӮе…·дҪ“жғ…еҶөи§ҒиЎЁ3гҖӮжіЁпјҡз®ӯеӨҙж Үи®°зҡ„дёәжң¬з ”究дёӯеҲҶзҰ»иҸҢж Әзҡ„STеһӢеҲ«
3и®Ёи®ә
йҡҸзқҖзҺ°д»Је…»ж®–дёҡзҡ„еҸ‘еұ•пјҢжҠ—з”ҹзҙ зҡ„дҪҝз”ЁйҮҸе’ҢдҪҝз”ЁиҢғеӣҙдёҚж–ӯжү©еӨ§пјҢжҠ—з”ҹзҙ дёҚд»…з”ЁдәҺжІ»з–—ж„ҹжҹ“жҖ§з–ҫз—…пјҢиҝҳиў«з”ЁдәҺйҘІж–ҷж·»еҠ еүӮд»ҘеҠ еҝ«з•ңзҰҪз”ҹй•ҝйҖҹеәҰе’ҢжҸҗй«ҳйҘІж–ҷиҪ¬еҢ–ж•ҲзҺҮгҖӮжҚ®з»ҹи®ЎпјҢ2013е№ҙжҲ‘еӣҪж¶ҲиҖ—жҠ—з”ҹзҙ 16.2дёҮеҗЁпјҢе…¶дёӯ52%дёәе…Ҫз”Ё
пј»14пјҪгҖӮе–№иҜәй…®зұ»гҖҒж°Ёеҹәзі–иӢ·зұ»гҖҒеӨ§зҺҜеҶ…й…Ҝзұ»гҖҒеӣӣзҺҜзҙ зұ»д»ҘеҸҠеҲ©зҰҸе№ізӯүжҠ—з”ҹзҙ е№ҝжіӣз”ЁдәҺз•ңзү§дёҡе’Ңж°ҙдә§е…»ж®–дёҡпјҢиҝҷдәӣжҠ—з”ҹзҙ зҡ„еӨ§йҮҸдҪҝз”ЁйҖ жҲҗеҠЁзү©дёӯиҖҗиҚҜиҸҢзҡ„еӨ§йҮҸеҮәзҺ°е’ҢиҖҗиҚҜеҹәеӣ зҡ„е№ҝжіӣдј ж’ӯгҖӮеңЁеұ е®°еҸҠйЈҹе“ҒеҠ е·ҘиҝҮзЁӢдёӯпјҢиҝҷдәӣиҖҗиҚҜиҸҢеҸҜиғҪдјҡжұЎжҹ“иӮүеҸҠе…¶еҲ¶е“ҒпјҢжңҖз»ҲеҜјиҮҙйЈҹе“ҒдёӯжҗәеёҰеҜ№
еҸӮиҖғж–ҮзҢ®
пј»1пјҪиғЎд»ҳе“ҒпјҢжңұеҫ·еҰ№пјҢжұӘеӨҚпјҢзӯү.2014е№ҙCHINETдёӯеӣҪз»ҶиҸҢиҖҗиҚҜжҖ§зӣ‘жөӢпј»JпјҪ.дёӯеӣҪж„ҹжҹ“дёҺеҢ–з–—жқӮеҝ—пјҢ2015пјҢ15(5):401-410.
пј»2пјҪзҺӢзӮіеҸ‘,жӣ№жҳҘиҝң,йҷҲеүҚиҝӣпјҢзӯү.дёӨиө·иӮ зӮҺжІҷй—ЁиҸҢжүҖиҮҙйЈҹзү©дёӯжҜ’зҡ„з—…еҺҹеӯҰз ”з©¶еҸҠжәҜжәҗеҲҶжһҗпј»JпјҪ.дёӯеӣҪйЈҹе“ҒеҚ«з”ҹжқӮеҝ—, 2016, 28(1):32-36.
пј»3пјҪPAULSEN I T, BANERJEI L, MYERS G S, et al. Role of mobile DNA in the evolution of vancomycin-resistant Enterococcus faecalisпј»JпјҪ. Science, 2003, 299(5615): 2071-2074.
пј»4пјҪзҺӢдёҪдёҪ,йҷҲеҖ©.дёҖиө·йЈҹзү©дёӯжҜ’з—…еҺҹиҸҢж–ҜеқҰеҲ©жІҷй—ЁиҸҢзҡ„еҲҶеӯҗеҲҶеһӢеҸҠиҖҗиҚҜжҖ§еҲҶжһҗпј»JпјҪ.дёӯеӣҪйЈҹе“ҒеҚ«з”ҹжқӮеҝ—, 2016, 28(1): 27-31.
пј»5пјҪйғӯзҺүжў…, з§ҰдёҪдә‘, еү§ж…§ж ӢпјҢзӯү.зҶҹиӮүеҸҠйҖҹеҶ»зұійқўйЈҹе“ҒдёӯеҸҳеҪўжқҶиҸҢжұЎжҹ“зҠ¶еҶөеҸҠиҖҗиҚҜзү№еҫҒеҲҶжһҗпј»JпјҪ.дёӯеӣҪйЈҹе“ҒеҚ«з”ҹжқӮеҝ—, 2016, 28(1):99-102.
пј»6пјҪAANENSEN D M, SPRATT B G. The multilocus sequence typing network: mlst.net пј»JпјҪ.Nucleic Acids Res, 2005пјҢ33пјҡ728-733.
пј»7пјҪKUCH A, WILLEMS R J, WERNER G, et al. Insight into antimicrobial susceptibility and population structure of contemporary human Enterococcus faecalis isolates from Europe пј»JпјҪ. J Antimicrob Chemoth, 2012, 67(3): 551-558.
пј»8пјҪHAAS W, GILMORE M S. Molecular nature of a novel bacterial toxin: the cytolysin of Enterococcus faecalis пј»JпјҪ. Med Microbiol ImmunoпјҢ1999, 187(4): 183-190.
пј»9пјҪGASPAR F, TEIXEIRA N, RIGOTTIER-GOIS L, et al. Virulence of Enterococcus faecalis dairy strains in an insect model: the role of fsrB and gelE пј»JпјҪ. Microbiol, 2009, 155(11): 3564-3571.
пј»10пјҪSHANKAR V, BAGHDAYAN A S, HUYCKE M M, et al. Infection-derived Enterococcus faecalis strains are enriched in esp, a gene encoding a novel surface protein пј»JпјҪ. Infec Immuno, 1999, 67(1):193-200.
пј»11пјҪGALLI D, LOTTSPEICH F, WIRTH R. Sequence analysis of Enterococcus faecalis aggregation substance encoded by the sex pheromone plasmid pAD1 пј»JпјҪ. Mol Microbiol, 1990, 4(6): 895-904.
пј»12пјҪPOYART C, BERCHE P, TRIEU-CUOT P. Characterization of superoxide dismutase genes from gram-positive bacteria by polymerase chain reaction using degenerate primers пј»JпјҪ. FEMS Microbiol Lett, 1995, 131(1): 41-45.
пј»13пјҪClinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testingпјҡtwenty-fifth informational supplementпјҡM100-S25 пј»SпјҪ. Wayne: CLSI, 2015.
пј»14пјҪZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: source analysis, multimedia modeling, and linkage to bacterial resistance пј»JпјҪ. Environ Sci Technol, 2015, 49(11): 6772-6782.
пј»15пјҪMUNDY L M, SAHM D F, GILMORE M. Relationships between enterococcal virulence and antimicrobial resistanceпј»JпјҪ. Clinical Microbiology Reviews, 2000, 13(4): 513-522.
пј»16пјҪLEAVIS H L, BONTEN M J, WILLEMS R J. Identiо•”cation of high-risk enterococcal clonal complexes: global dispersion and antibiotic resistance пј»JпјҪ. Curr Opin Microbiol, 2006, 9пјҲ5пјүпјҡ454-460.
пј»17пјҪQUINONES D, KOBAYASHI N, NAGASHIMA S. Molecular epidemiologic analysis of Enterococcus faecalis isolated in Cuba by multilocus sequence typing пј»JпјҪ. Microbiol Drug Resist, 2009, 15пјҲ4пјү:287-293.
пј»18пјҪKUDO M, NOMURA T, YOMODA S, et al. Nosocomial infection caused by vancomycin-susceptible multidrug-resistant Enterococcus faecalis over a long period in a university hospital in Japan пј»JпјҪ. Microbiol Immunol, 2014, 58(11): 607-614.

 жқЁжҷ¶,зҺӢзәў,еј жЎӮ,зҶҠиЎҚж–Ү,йҮ‘дёң.иҮӘиҙЎеёӮиӮүеҸҠе…¶еҲ¶е“ҒдёӯзІӘиӮ зҗғиҸҢиҖҗиҚҜжҖ§жҜ’еҠӣеҹәеӣ е’ҢеӨҡдҪҚзӮ№еәҸеҲ—еҲҶжһҗ[J].дёӯеӣҪйЈҹе“ҒеҚ«з”ҹжқӮеҝ—,2017,29(3):277-282.
жқЁжҷ¶,зҺӢзәў,еј жЎӮ,зҶҠиЎҚж–Ү,йҮ‘дёң.иҮӘиҙЎеёӮиӮүеҸҠе…¶еҲ¶е“ҒдёӯзІӘиӮ зҗғиҸҢиҖҗиҚҜжҖ§жҜ’еҠӣеҹәеӣ е’ҢеӨҡдҪҚзӮ№еәҸеҲ—еҲҶжһҗ[J].дёӯеӣҪйЈҹе“ҒеҚ«з”ҹжқӮеҝ—,2017,29(3):277-282.