DOi:10.13590/j.cjfh.2017.03.007
2012—2015年北京市西城区单核细胞增生李斯特菌多位点序列分型及耐药研究
(北京市西城区疾病预防控制中心,北京100053)
作者简介: 霍哲女主管检验技师研究方向为微生物致病菌检测 E-mail:rubyrain121118@hotmail.com
收稿日期: 2016-11-04
基金项目: 北京市西城区优秀人才培养项目(20150051)
摘要:目的 探讨单核细胞增生李斯特菌多位点序列分型(MLST)与耐药性的关联性,确定某些具有高致病性潜能的流行克隆株的存在。方法采用Kirby-Bauer(K-B)纸片扩散法和E-test药敏试条法对14种抗生素进行药物敏感性试验,以MLST技术对50株菌株进行基因分型。结果单核细胞增生李斯特菌耐药率为22.00%(11/50),并出现多重耐药株。50株单核细胞增生李斯特菌MLST分析共获得12个型别,以ST9和ST121为优势型别。结论特定ST型别在食品生产过程中存在特定菌株之间的传递,人源性和食源性单核细胞增生李斯特菌中均发现耐药株,可能存在耐药基因的传递,应加强对具有潜在致病性的ST型别的监测力度。
关键词:
单核细胞增生李斯特菌; 多位点序列分型; 药物敏感性; 进化树; 食源性致病菌; 耐药
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)03-0289-05
Study on the homologous and antibiotic susceptibility of foodborne
Listeria monocytogens in a district of Beijing
Listeria monocytogens in a district of Beijing
(Xicheng Center of Disease Control and Prevention,Beijing 100053,China)
Abstract:Objective To investigate the association between the multilocus sequence tying(MLST)of Listeria monocytogenes and its antibiotic susceptibility, and to determine the presence of some clonal strains with high pathogenic potential.MethodsSusceptibility tests were performed through the Kirby-Bauer (K-B) method and E-test method with fourteen antibiotics; and then 50 Listeria monocytogenes strains were genotyped by MLST. ResultsThe antibiotic resistant rate of Listeria monocytogenes was 22.00%(11/50), and multi-resistant strains appeared during the tests. The 50 Listeria monocytogenes strains were divided into 12 types based on MLST typing with ST9 and ST121 was being the dominant types. ConclusionSpecific STs could transfer to particular strains during food production processes. The resistant strains were found in both foodborne and human source Listeria monocytogenes. There was a possibility of the transmission of antibiotic-resistant genes, thus the monitoring of potentially pathogenic ST-type was quite important to reduce Listeria monocytogenes.
Key words:
Listeria monocytogens; multilocus sequence tying; antibiotic susceptibility; phylogenetic tree; foodborne pathogens; antibiotic resistance
单核细胞增生李斯特菌(Listeria monocytogenes,Lm)能引起人和动物脑膜炎、败血症、流产和单核细胞增多等,死亡率为20%~30%,被世界卫生组织(WHO)列为关系食品卫生安全的重要病原菌之一[1-2]。2015年,美国蓝钟(Blue Bell)冰淇淋事件,8人因感染Lm患病就医,其中3人死亡。我国2000—2009年文献[3]检索出Lm病例92例,其中围产期病例为54例,给家庭和社会带来巨大的疾病负担。另一方面,随着抗生素在临床和畜牧业中的广泛使用与滥用,Lm面临严重的抗生素选择压力,已有报道[4]指出我国出现对二线药物耐药的菌株,给临床用药的选择带来了很大的挑战。多位点序列分型(multilocus sequence typing,MLST)是高通量测序技术与成熟的群体遗传学结合的产物[5],适用于菌株的进化关系和微生物群体遗传学分析,一般用于广义的流行病学调查[6-7]。本研究对食源性和人源性Lm进行了MLST分析,以期了解不同来源Lm的种群特征和遗传多样性,确定某些具有高致病性潜能的流行克隆株的存在。探讨MLST型别与耐药性的关联性,追踪耐药菌株间的亲缘关系,为进一步预防控制李斯特菌病的发生提供科学依据。
blgA基因退火温度为45 ℃,其他扩增步骤同上。引物序列见表1。
1材料与方法
1.1材料
1.1.1菌株来源
食源性菌株来自2012—2015年北京市西城区采集的生禽畜肉、熟肉制品、水产品、凉拌菜、熟制米面制品、冷冻饮品和西式煎牛排、猪排等共计7类食品中检测出的42株Lm。人源性菌株来自临床诊断为败血症、慢性淋巴细胞白血病、化脓性脑膜炎及流产等的患者的脑脊液和静脉血中培养出的8株Lm。标准菌株为Lm(ATCC 27708),药敏质控菌株为金黄色葡萄球菌(ATCC 12600),均购自北京陆桥技术股份有限公司。
1.1.2主要仪器与试剂
T100 Thermal Cycler梯度PCR仪(美国BIO-RAD),QIAxcel Advanced全自动核酸分析仪(德国Qiagen)。药敏纸片、E-test条均购自英国OXOID,细菌基因组DNA提取试剂盒(德国Qiagen,批号:151044868),产品均在有效期内。
1.2方法
1.2.1抗生素敏感试验
采用Kirby-Bauer(K-B)法和E-test药敏试条法,按照美国临床实验室标准研究所(Clinical and Laboratory Standards Institute,CLSI)推荐的Lm药敏试验抗生素选择原则[8]及欧洲抗菌药物敏感实验委员会(EUCAST)标准[9],结合临床用药和研究需要,共选择10类,共14种抗生素进行药物敏感性试验,分别为青霉素类:青霉素(PEN)和氨苄西林(AMP);糖肽类:万古霉素(VAN);大环内酯类:红霉素(ERY);氯霉素类:氯霉素(CHL);氨基糖苷类:庆大霉素(GEN)和阿米卡星(AN);氟喹诺酮类:环丙沙星(CIP)和左氧氟沙星(LEV);β-内酰胺类:氨苄西林/舒巴坦(SAM);碳青霉烯类:亚胺培南(IPM)和美罗培南(IMP);四环素类:四环素(TET);头孢类:头孢噻肟(CTX)。
1.2.2DNA模板的提取
将Lm菌株接种于脑心浸液琼脂培养基中,置于37 ℃恒温箱中过夜培养。培养物按试剂盒说明书进行操作,DNA模板置于-20 ℃冰箱备用。
1.2.3管家基因的扩增
Lm共有7对管家基因,管家基因引物序列均来自于Institut Pasteur在线数据库[10],PCR扩增条件(除blgA基因以外):94 ℃预变性4 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸2 min(35个循环);72 ℃延伸10 min。blgA基因退火温度为45 ℃,其他扩增步骤同上。引物序列见表1。

|
表1Lm管家基因引物序列 Table 1MLST primers of Listeria monocytogenes |
1.2.4ST型的获得及最小生成树的绘制
获得测序基因后,基因序列用CExpress软件进行修正,然后在Institut Pasteur[10]进行提交,查询得到菌株的序列类型(sequence types,STs),结合耐药结果,采用BioNumerics软件,以categorical法计算相似性系数,构建最小生成树。
2结果
2.1Lm耐药结果
对50株Lm进行14种抗生素的药敏试验,结果显示耐药率为22.00%(11/50),其耐药的抗生素有头孢噻肟、环丙沙星、红霉素、氯霉素、左氧氟沙星、美罗培南和四环素,耐受1种抗生素的菌株有8株,耐受2种抗生素的菌株有2株,耐受3种抗生素的菌株有1株,为多重耐药株,多重耐药率为2.00%(1/50),具体结果见表2。

|
表2Lm的耐药谱(n=50) Table 2Types of the antimicrobial resistance of Listeria monocytogenes isolates |
2.2MLST分型结果
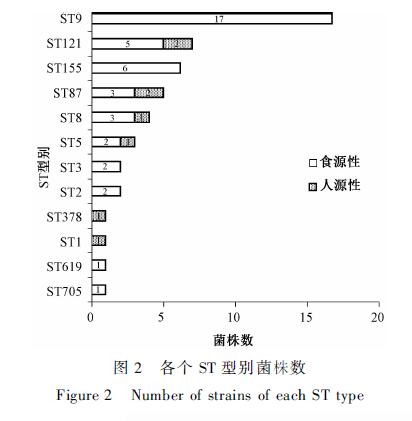
通过MLST分型,把50株菌株分为12个ST型别,每个ST型别含1~17株菌株,其中ST9和ST121为优势型别,分别占34.00%(17/50)和14.00%(7/50),其次是ST87(5株)、ST155(6株)、ST8(4株)和ST5(3株),剩余的ST型别只有1~2株菌株,见表3。在7个管家基因的等位基因型中,拥有5个以上相同等位基因型的菌株组成一个克隆复合物(clonal complex,CC)[11]。这些菌株中出现了1个克隆复合物,即CC155,包括ST155和ST705。在最小生成树中,从进化距离可以看出,分为两大进化谱系,分别以ST155和ST5为中心。ST155和ST3型间差异最多为7,ST705和ST155型间差异最少为1,见图1。
2.3不同来源菌株MLST型别比较
对食源性和人源性菌株进行MLST比较,结果显示,其ST型别分布也不同。42株食源性菌株分布在10个ST型中,其中6个ST型别全部来自食源性菌株:ST9、ST155、ST3、ST2、ST619和ST705。8株人源性菌株分布在6个ST型中,其中ST1和ST378全部来自人源性菌株。ST5、ST8、ST87和ST121这4种型别为人源性和食源性菌株混合存在,见图2。

|
表3菌株编号及对应的来源、ST型别和分离年份 Table 3Strain number and the sample source,ST type and isolated time |

|
图 150株Lm最小生成树 Figure 1Minimum spanning tree analysis of 50 Lm isolates |
|
图2各个ST型别菌株数 Figure 2Number of strains of each ST type |
2.4耐药特征与ST型别的关系分析
11株耐药菌株共得到7个ST型别,ST155耐药率为27.27%(3/11),ST121、ST9耐药率均为18.18%(2/11),ST619、ST3、ST5、ST8耐药率均为9.09%(1/11)。ST1、ST2、ST87、ST378和ST705这5个型别没有检出耐药株。其中ST9和ST155为我国Lm耐药株常见型别[10],唯一的一株多重耐药株是ST9型,见图3。8株人源性Lm中有3株(ST5、ST8和ST121)均对头孢噻肟耐药,耐药率37.50%(3/8)。ST8只在人源性Lm中发现耐药株,ST5和ST121在人源性和食源性Lm中均发现耐药株,ST3、ST9、ST155和ST619只在食源性Lm中发现耐药株。

|
图3Lm耐药株与ST型别的最小生成树分析图 Figure 3Minimum spanning tree analysis of antimicrobial resistance and ST type of Lm |
3讨论
本研究对2012—2015年北京市西城区分离到的50株食源性和人源性Lm进行14种抗生素的药物敏感性试验,耐药率为22.00%(11/50),结果提示人源性Lm的耐药率(37.50%,3/8)明显高于食源性Lm的耐药率(19.05%,8/42)。食源性Lm耐药率基本与2012年北京市的食源性Lm耐药率(17.14%)接近[12],人源性的相关数据较少。一线药物没有出现耐药情况,但是二线药物对抗生素的耐受性呈不断上升的趋势,2007—2009年报道[13]红霉素和环丙沙星出现了耐药性,本研究同样出现了红霉素和环丙沙星的耐药株。本研究中对头孢噻肟耐药的Lm数量最多,共有8株,耐药率为16.00%(8/50),头孢类药物在临床上已不作为治疗Lm感染的主要药物。MLST研究的靶基因是细菌生存和繁殖所必需的管家基因[14],这些管家基因核苷酸改变较慢,长时间内比较稳定,适合研究种群结构和长期进化[14-15],而且基因分型技术具备清晰的等位基因图谱定义,可以通过互联网实现数据分析和信息共享[16]。从世界和中国的研究[17-18]情况可以看出,以ST9为主的CC9是食品中广泛存在的CC,有文献[12]报道,2012年我国73株食源性Lm的MLST结果中,以ST155最多,其次为ST9。本研究对2012—2015年北京市42株食源性Lm分析的MLST共得到10个型别,其中ST9最多,其次为ST121和ST155。可以分析出,ST9依然是食源性Lm的优势型别,广泛存在于食品中,近几年ST121在食源性Lm中有增加的趋势,值得引起关注。通过对8株人源性Lm的MLST分析发现,ST1和ST387只在人源性Lm中发现,虽然分离菌株数量少,但有报道[19]指出ST1可能具有引起李斯特菌病暴发的潜能,ST387的Lm分离株来自一名产下死胎的患者的胎盘,该型别是否与妊娠期妇女的李斯特菌病有关还需要进一步探讨。ST5、ST8、ST87和ST121型别中人源性和食源性分离株均有,这些型别是否具有致病性也值得进一步研究。通过对食源性和人源性菌株进行MLST分析,结果提示Lm具有较高的种群多样性,但以其中某几类ST为主,不同来源Lm的种群特征和遗传多样性不同,即具有不同的优势ST。MLST分析揭示50株Lm中以ST155为主要耐药菌株。有文献[12]报道耐受四环素的Lm明显集中在ST155、ST705和ST515这3个型别,本研究对四环素耐受的Lm为ST155。长期以来,ST9一直是食源性Lm中的优势型别,在ST9中发现1株多重耐药株,提示特定ST型别在食品生产过程中特定菌株之间的传递,可能存在耐药基因的传递整合。ST5和ST121在人源性和食源性Lm中均发现耐药株,可能存在耐药基因的传递,这种现象提示在耐药基因检测和耐药机制探索中应加强对具有潜在致病性ST型别的监测力度。李斯特菌病感染主要发生在老年人、孕妇、新生儿以及免疫功能低下的人群。本研究获得4株来自孕妇和新生儿患者的Lm,但是涉及的其他高危人群病例有限,需要加大对人源性Lm的监测力度。由于新生儿李斯特菌病绝大多数源于母亲,而且Lm会导致孕妇流产、死胎、早产,因此妊娠期早期识别、早期正确治疗是降低新生儿李斯特菌病的重要环节。Lm耐药菌株和多重耐药菌株的出现,可能与抗生素滥用有着紧密的联系,应该进一步加强抗生素的管理,合理使用抗生素,降低耐药性菌株出现的风险。MLST分析Lm的菌群结构,在分子水平上了解其变化趋势及流行特征,耐药性和MLST之间的联系能够更好的促进Lm的流行病学研究,为北京市李斯特菌病的预防和控制提供科学依据。
参考文献
[1]WHO,FAO.Risk assessment of Listeria monocytogenes in ready-to-eat foods[EB/OL].(2004)[2016-07-26]. http://www.who.int/foodsafety/publications/micro/mralisteria./en/index.html.
[2]VAZQUEZ-BOLAND J A,KUHN M,BERCHE P,et al.Listeria pathogenesis and molecular virulence determinants[J].Clinical Microbiology Reviews,2001,14(3):584-640.
[3]冯延芳,冉陆,张立实.2000—2009年中国李斯特菌病文献报告病例分析[J].疾病监测,2011,26(8):654-659.
[4]杨洋,付萍,郭云昌,等.2005年中国食源性单核细胞增生李斯特菌耐药性趋势分析[J].卫生研究,2008,37(2):183-186.
[5]MARRI P R,HARRIS L K,HOUMIEL K,et al.The effect of chromosome geometry on genetic diversity[J].Genetics,2008,179(1):511-516.
[6]王中强,邱少富,王勇,等.多位点序列分型技术及其研究进展[J].军事医学,2010,34(1):76-79.
[7]谢蟪旭,王萍,刘敏川.多位点序列分型法在感染性疾病中的应用[J].国际口腔医学杂志,2009,36(5):557-560.
[8]CLSI.Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria approved guideline-second edition:M45-A2[S].2013.
[9]EUCAST.Listeria monocytogenes calibration of zone diameter breakpoints to MIC values,Version 1.2[S].2013.
[10]Institut Pasteur MLST and whole genome MLST databases[DB/OL].(2015-09-14)[2016-07-29].http://bigsdb.pasteur.fr/listeria/listeria.html.
[11]SALCEDO C,ARREAZA L,ALCAL B,et al.Development of a multilocus sequence typing method for analysis of Listeria monocytogenes clones[J].J Clin Microbiol,2003,41(2):757-762.
[12]闫韶飞,裴晓燕,杨大进,等.2012年中国食源性单核细胞增生李斯特菌耐药特征及多位点序列分型研究[J].中国食品卫生杂志,2014,26(6):537-542.
[13]赵悦,付萍,裴晓燕,等.中国食源性单核细胞增生李斯特菌耐药特征分析[J].中国食品卫生杂志,2012,24(1):5-8.
[14]CHEN Y.DNA sequence-based subtyping of epidemic clones and outbreak clones of Listeria monocytogenes[D].Pennsylvania State:The Pennsylvania State University,2007.
[15]CHEN Y,ZHANG W,KNABEL S J.Multi-virulence-locus sequence typing identifies single nucleotide polymorphisms which differentiate epidemic clones and outbreak strains of Listeria monocytogenes[J].J Clin Microbiol,2007,45(3):835-846.
[16]MAIDEN M C.Multilocus sequence typing of bacteria[J].Annu Rev Microbiol,2006,60(60):561-588.
[17]CHENAL-FRANCISQUE V,LOPEZ J,CANTINELLI T,et al.Worldwide distribution of major clones of Listeria monocytogenes[J].Emerg Infect Dis,2011,17(6):1110-1112.
[18]WANG Y,ZHAO A,ZHU R,et al.Genetic diversity and molecular typing of Listeria monocytogenes in China[J].BMC Microbiol,2012,12(1):119.
[19]王国梁.不同来源单核细胞增生性李斯特菌分离株的分子分型研究[D].扬州:扬州大学,2013.
[2]VAZQUEZ-BOLAND J A,KUHN M,BERCHE P,et al.Listeria pathogenesis and molecular virulence determinants[J].Clinical Microbiology Reviews,2001,14(3):584-640.
[3]冯延芳,冉陆,张立实.2000—2009年中国李斯特菌病文献报告病例分析[J].疾病监测,2011,26(8):654-659.
[4]杨洋,付萍,郭云昌,等.2005年中国食源性单核细胞增生李斯特菌耐药性趋势分析[J].卫生研究,2008,37(2):183-186.
[5]MARRI P R,HARRIS L K,HOUMIEL K,et al.The effect of chromosome geometry on genetic diversity[J].Genetics,2008,179(1):511-516.
[6]王中强,邱少富,王勇,等.多位点序列分型技术及其研究进展[J].军事医学,2010,34(1):76-79.
[7]谢蟪旭,王萍,刘敏川.多位点序列分型法在感染性疾病中的应用[J].国际口腔医学杂志,2009,36(5):557-560.
[8]CLSI.Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria approved guideline-second edition:M45-A2[S].2013.
[9]EUCAST.Listeria monocytogenes calibration of zone diameter breakpoints to MIC values,Version 1.2[S].2013.
[10]Institut Pasteur MLST and whole genome MLST databases[DB/OL].(2015-09-14)[2016-07-29].http://bigsdb.pasteur.fr/listeria/listeria.html.
[11]SALCEDO C,ARREAZA L,ALCAL B,et al.Development of a multilocus sequence typing method for analysis of Listeria monocytogenes clones[J].J Clin Microbiol,2003,41(2):757-762.
[12]闫韶飞,裴晓燕,杨大进,等.2012年中国食源性单核细胞增生李斯特菌耐药特征及多位点序列分型研究[J].中国食品卫生杂志,2014,26(6):537-542.
[13]赵悦,付萍,裴晓燕,等.中国食源性单核细胞增生李斯特菌耐药特征分析[J].中国食品卫生杂志,2012,24(1):5-8.
[14]CHEN Y.DNA sequence-based subtyping of epidemic clones and outbreak clones of Listeria monocytogenes[D].Pennsylvania State:The Pennsylvania State University,2007.
[15]CHEN Y,ZHANG W,KNABEL S J.Multi-virulence-locus sequence typing identifies single nucleotide polymorphisms which differentiate epidemic clones and outbreak strains of Listeria monocytogenes[J].J Clin Microbiol,2007,45(3):835-846.
[16]MAIDEN M C.Multilocus sequence typing of bacteria[J].Annu Rev Microbiol,2006,60(60):561-588.
[17]CHENAL-FRANCISQUE V,LOPEZ J,CANTINELLI T,et al.Worldwide distribution of major clones of Listeria monocytogenes[J].Emerg Infect Dis,2011,17(6):1110-1112.
[18]WANG Y,ZHAO A,ZHU R,et al.Genetic diversity and molecular typing of Listeria monocytogenes in China[J].BMC Microbiol,2012,12(1):119.
[19]王国梁.不同来源单核细胞增生性李斯特菌分离株的分子分型研究[D].扬州:扬州大学,2013.
 霍哲,王晨,徐俊,高波,曹玮.2012—2015年北京市西城区单核细胞增生李斯特菌多位点序列分型及耐药研究[J].中国食品卫生杂志,2017,29(3):289-293.
霍哲,王晨,徐俊,高波,曹玮.2012—2015年北京市西城区单核细胞增生李斯特菌多位点序列分型及耐药研究[J].中国食品卫生杂志,2017,29(3):289-293.