DOi:10.13590/j.cjfh.2017.03.008
2014—2016年湖州市水产品与临床腹泻病例中副溶血性弧菌的分布特征
(湖州市疾病预防控制中心,浙江 湖州313000)
作者简介: 袁瑞男医师研究方向为公共卫生监测 E-mail:yuanrui751@163.com
通信作者: 张鹏男副主任医师研究方向为公共卫生监测 E-mail:hzjkzp@163.com
收稿日期: 2017-04-14
摘要:目的 探讨湖州市水产品副溶血性弧菌(VP)污染与临床腹泻病例间的关联性。方法收集2014—2016年湖州市653份水产品和8 112例临床腹泻病例,分别对水产品与临床腹泻病例粪便或肛拭子标本进行定性VP检测、O群血清分群及tdh与trh毒力基因型检测。比较分析VP在水产品与临床腹泻病例中的流行分布特征。结果水产品的VP检出率为28.02%(183/653),其中淡水产品检出率为33.67%(132/392),海产品检出率为19.54%(51/261),差异有统计学意义(χ2=14.823,P<0.001)。临床腹泻病例粪便或肛拭子标本的VP检出率为4.87%(395/8 112),其中暴露于水产动物及其制品的检出率达15.40%(170/1 104)。在时间分布上,水产品与粪便或肛拭子标本的检出率基本一致,均在7~9月检出率相对较高;在血清型分布上,二者均以O3、O4血清型为主;在毒力基因型分布上,临床腹泻病例以tdh(+)/trh(+)为主(60.51%,239/395),而水产品以tdh(-)/trh(-)为主(42.08%,7/183)。
结论湖州市水产品副溶血性弧菌污染与临床病例感染在时间分布和生物学特征上具有一定关联,应进一步加强水产品中副溶血性弧菌的监测与管理。
结论湖州市水产品副溶血性弧菌污染与临床病例感染在时间分布和生物学特征上具有一定关联,应进一步加强水产品中副溶血性弧菌的监测与管理。
关键词:
水产品; 腹泻病例; 副溶血性弧菌; 食源性致病菌; 食品; 食源性疾病; 湖州
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)03-0294-05
Epidemiological distribution characteristics of Vibrio parahaemolyticus in aquatic
products and clinical diarrhea cases in Huzhou from 2014-2016
products and clinical diarrhea cases in Huzhou from 2014-2016
(Huzhou Center for Disease Control and Prevention,Zhejiang Huzhou 313000,China)
Abstract: Objective To explore the correlation between Vibrio parahaemolyticus (VP) contamination of aquatic products and clinical diarrhea cases. MethodsTotally 654 aquatic product samples and 8 112 clinical diarrhea cases were collected in Huzhou City between 2014 to 2016. Aquatic products and faecal or anal swab specimens of clinical diarrhea cases were tested for VP, O group of serum and the virulence gens tdh and trh, respectively. The distribution characteristics of VP in aquatic products and clinical diarrhea cases was analyzed and compared. ResultsThe detection rate of VP in aquatic products was 28.02% (183/653), of which freshwater products and seafood counted for 33.67% (132/392) and 19.54% (51/261) respectively, and the difference was statistically significant (χ2=14.823, P<0.001). The detection rate of VP in clinical diarrhea cases was 4.87% (395/8 112), and 15.40% (170/1 104) of them had exposure to aquatic and its products. In the time distribution, the detection rate of VP in aquatic products and clinical diarrhea cases were basically the same, and the detection rates were relatively high in July to September. In the serotype distribution, O3 and O4 were the two main serotypes both in aquatic products and clinical diarrhea cases. In the virulence genotype distribution, the tdh( + )/trh( + ) was predominant (60.51%, 239/395) in clinical diarrhea cases, while the tdh( - )/trh( - ) was the predominant one (42.08%, 77/183) in aquatic products. ConclusionThere was a certain correlation between VP contamination in aquatic products and clinical diarrhea cases in the time distribution and biological characteristics. Therefore, it is necessary to further strengthen the monitoring and management of VP in aquatic products.
Key words:
Aquatic products; diarrhea cases; Vibrio parahaemolyticus; foodborne pathogens; foods; foodborne diseases; Huzhou
副溶血性弧菌(Vibrio parahaemolyticus,VP)是我国最主要的食源性致病菌之一,约占细菌性食源性疾病总病例数的7.5%[1]。由于其嗜盐特性,广泛分布于近海岸海水、海产品及其海底沉积物中,是沿海地区细菌性食源性疾病的首要致病菌。然而,在淡水中也能检测到VP[2-3],食源性疾病监测结果[4]表明,VP也是淡水资源丰富区域的主要食源性致病菌。湖州地处太湖南岸,淡水资源丰富,既往监测结果发现湖州地区水产品和临床腹泻病例中VP检出率均较高。为探讨水产品VP污染与临床腹泻病例间的关联性,比较分析VP在水产品与临床腹泻病例中的流行分布特征,为防治VP提供信息参考。
在时间分布上,形成一条单峰流行
1材料与方法
1.1材料
1.1.1样本来源及检测
水产品:由疾病预防控制中心食品专业采样人员采样,时间跨度2014—2016年,地点包括养殖场、批发市场、农贸市场、超市、网店等,共采集653份水产品样品,其中淡水产品392份,海产品261份,包括虾类、鱼类、甲壳类、软体动物及贝类。临床腹泻病例:收集2014—2016年湖州市食源性疾病监测系统中的8 112例临床腹泻病例,其定义是以腹泻症状为主诉就诊的门诊或住院病例,24 h内排便次数≥3次,粪便性状异常(如稀便、水样便、黏液便或脓血便等)。采集粪便或肛拭子标本进行VP检测。
1.1.2主要仪器与试剂
7300型荧光定量PCR仪(美国ABI)、台式高速离心机、恒温培养箱。碱性蛋白胨水(APW)、胰蛋白胨大豆琼脂(TSA)、血平板均购自上海哈灵生物技术有限公司,科玛嘉弧菌显色琼脂(郑州博赛生物技术研究所),API 20E肠道菌试剂鉴定条(法国生物梅里埃),11种O群分群血清(日本生研株式会社),tdh和trh基因检测试剂盒(深圳市生科源技术有限公司)。
1.2方法
1.2.1VP检测
水产品样品用自来水冲洗体表后,用75%酒精棉球擦净,鱼类取鱼鳃和鱼肠,蟹取中心内脏及肉,虾取腹节内肌肉,贝类取全部内容物,无菌操作称取待检样品25 g,放入盛有225 ml无菌碱性蛋白胨水的均质袋中,均质制成10-1稀释液,37 ℃增菌培养18~24 h。粪便或肛拭子标本直接放入盛有3% NaCl碱性蛋白胨水的试管中,37 ℃增菌培养18~24 h。将上述增菌液分别接种于科玛嘉弧菌显色琼脂平板上,37 ℃培养24 h。挑取可疑菌落,应用API 20E肠道菌试剂鉴定条进行生化鉴定。
1.2.2血清分群
使用11种O抗原血清(O1~O11群)进行分群。先接种一管3% NaCl胰蛋白胨大豆琼脂试管斜面,37 ℃培养24 h,用含3% NaCl的5%甘油溶液冲洗斜面培养物,制成浓厚的菌悬液,121 ℃高压1 h后,4 000 r/min 离心15 min,弃去上层液体,沉淀用生理盐水洗3次,每次4 000 r/min离心15 min,最后一次离心后留少许上层液体,混匀制成菌悬液,进行玻片凝集,观察是否有阳性凝集反应,同时用无菌生理盐水作自凝对照。
1.2.3PCR扩增tdh和trh毒力基因
经生化鉴定为阳性样品/标本转种血平板,37 ℃培养24 h,刮取菌落溶于100 μl ddH2O中,100 ℃金属浴15 min后,12 000 r/min离心5 min,其上清液即为DNA模板液。使用单重实时荧光PCR法扩增tdh和trh毒力基因,按照试剂盒说明书操作,反应条件为50 ℃预变性2 min,95 ℃变性3 min,95 ℃退火5 s,55 ℃延伸60 s,40个循环;在55 ℃进行FAM通道荧光检测。
1.3统计学分析
建立Excel数据库,采用SPSS 19.0软件进行统计学分析。定性资料采用率或构成比描述,用χ2检验或Fisher确切概率法进行统计分析,检验水准α=0.05,P<0.05为差异有统计学意义。
2结果
2.1水产品中VP污染情况
653份水产品中VP检出率为28.02%(183/653),其中淡水产品的检出率为33.67%(132/392),海产品的检出率为19.54%(51/261),经χ2检验,两者间差异有统计学意义(χ2=14.823,P<0.001)。在时间分布上,不同月份的VP检出率差异有统计学意义(χ2=113.581,P<0.001),在2~6月的检出率相对较低,7~10月的检出率相对较高,其中9月的检出率最高,达55.00%(33/66),详见图1。在空间分布上,养殖环节中未有VP检出,但在其他流通环节均有VP检出。在保存方式上,淡水产品的冰鲜保存(66.67%,12/18)与海产品的鲜活保存(37.50%,24/64)的VP检出率最高。在水产品的分类上,淡水产品的虾类(53.85%,21/39)与海产品的贝类(37.50%,15/40)的VP检出率最高,详见表1。
2.2腹泻病例中VP感染情况
8 112份临床腹泻病例的粪便或肛拭子标本中VP检出率为4.87%(395/8 112),其中女性为5.41%(220/4 070),男性为4.33%(175/4 042),女性高于男性,差异有统计学意义(χ2=5.079,P<0.05)。在时间分布上,形成一条单峰流行

|
图1湖州市水产品与临床腹泻病例的粪便或肛拭子标本中VP在不同月份的检出情况 Figure 1Time distribution of VP in aquatic products and faecal or anal swab specimens of clinical diarrhea cases in Huzhou |

|
表1湖州市653份水产品中VP检出情况 Table 1Detection rate of VP in 653 aquatic product samples in Huzhou |

|
表2湖州市8 112份临床腹泻病例粪便或肛拭子标本中 VP检出情况 Table 2Detection rate of VP in 8 112 faecal or anal swab specimens of clinical diarrhea cases in Huzhou |
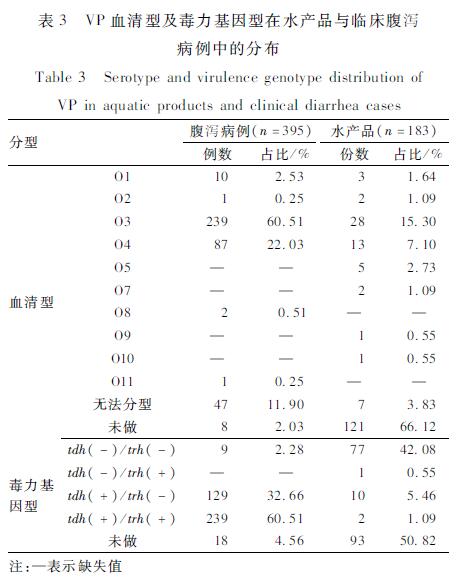
2.3VP血清型及毒力基因型分布
表3显示了湖州市水产品与临床腹泻病例中VP的血清型及毒力基因型分布情况。在血清型分布上,二者基本一致,均以O3血清型为主,其次为O4血清型。在毒力基因型分布上,临床腹泻病例以tdh( + )/trh( + )为主,占60.51%(239/395),其次为tdh( + )/trh( - ),占32.66%(129/395),而水产品以tdh( - )/trh( - )为主,占42.08%(77/183)。
|
表3VP血清型及毒力基因型在水 产品与临床腹泻 病例中的分布 Table 3Serotype and virulence genotype distribution of VP in aquatic products and clinical diarrhea cases |
3讨论
VP是一种嗜盐性细菌,主要通过生食海鲜或食用未经烧熟煮透的海产品感染人类[5]。然而既往调查[6] 显示,VP也可在内陆地区的淡水养殖、流通和餐饮各个环节中检出,内陆多地也时有淡水鱼携带VP的报道[7-8],从而表明VP已不仅仅是沿海地区的首要食源性致病菌,也是内陆地区主要的食源性致病菌。尽管VP感染引起的胃肠炎通常是自限性的,但对于免疫低下者可能引发败血症而危及生命[3]。林云等[9]研究报道嘉兴市VP疾病负担较重,然而相邻城市的湖州水产品与临床腹泻病例中VP检出率均较高,为更好地开展该地区VP防治工作,本研究比较分析了湖州市水产品与临床腹泻病例中VP流行分布情况。653份水产品中VP检出率为28.02%,与浙江省水产品中30.41%的检出率相近,但淡水产品的检出率(33.67%)高于海产品的检出率(19.54%),这与既往报道VP主要存在于海产品的结论不一致[7,10],由于在流通环节中除养殖环节未有VP检出外,其他环节均有检出,且存储方式上海产品的鲜活保存检出率(37.50%)最高,而淡水产品的冰鲜保存检出率(66.67%)最高,因此推测食品间的交叉污染可能是导致淡水产品VP污染更严重的原因,但淡水产品鲜活保存的检出率(33.76%)提示也存在淡水养殖环节直接污染的可能。在时间分布上,7~10月VP检出率相对较高,这与夏季水的温度较高更有利于细菌生长繁殖有关[11]。在水产品的分类上,淡水产品的虾类VP检出率最高,这与既往研究结果[11]一致。对于海产品贝类VP检出率最高,其原因与贝类属于滤食性动物有关,容易富集周围环境中的致病性弧菌。8 112份临床腹泻病例的粪便或肛拭子标本中VP的检出率为4.87%,略低于温州市的检出率(5.20%)[12],但高于嘉兴市的检出率(2.62%)[9],说明湖州市VP疫情严峻。在人群分布上,女性高于男性,年龄主要集中于16~65岁,这与相关报道[9]一致。在时间分布上,7~9月VP感染率较高,这与水产品中VP检出率的时间分布相一致,且在暴露食品的分类上,食用水产动物及其制品的患者VP检出率高于食用其他食品种类者,说明食用被VP污染的水产品是发病的危险因素,这也进一步说明湖州市水产品污染与VP感染有直接的联系。在VP血清型分布方面,水产品与临床腹泻病例中均以O3血清型为主,其次是O4血清型,这与既往研究关于O3、O4血清型主要存在临床病例而很少分布于水产品的结论不一致[13-14],但这也从病原微生物学特征方面佐证了湖州市水产品污染与VP感染间存在着直接的联系。既往调查[14]显示O3、O4血清型属暴发型菌株,因此应进一步加强水产品中VP的监测。在毒力基因型分布上,临床腹泻病例中以携带毒力基因tdh的菌株为主,而水产品中则以未携带毒力基因的菌株为主,这与相关报道一致[13,15],与临床菌株相比,来自环境与食物中的菌株一般很少能够产生耐热直接溶血素(tdh)和(或)耐热相关溶血素(trh)。本研究比较分析了湖州市水产品与临床腹泻病例中VP的流行分布特征,从时间分布、血清型分布及病例暴露食品种类方面均提示湖州市水产品VP污染与临床感染病例间存在着直接关联,因此加强水产品VP的监测对湖州市食源性疾病的防控具有重要意义。本次研究还发现湖州市淡水产品VP污染严重,其具体原因还有待进一步的调查研究。由于本次研究数据来源于常规监测数据,一些信息难以获取,建议以后工作中进一步完善阳性菌株相关信息(如血清型、毒力基因型等)的检测与上报,以更好地指导当地的防控工作。
参考文献
[1]赵怀龙,付留杰,唐功臣. 我国主要的食源性致病菌[J]. 医学动物防制, 2012, 28(11): 1212-1216.
[2]FUKUSHIMA H, SEKI R. Ecology of Vibrio vulnificus and Vibrio parahaemolyticus in brackish environments of the Sada River in Shimane Prefecture, Japan[J]. FEMS Microbiology Ecology, 2004, 48(2): 221-229.
[3]SU Y C, LIU C. Vibrio parahaemolyticus: a concern of seafood safety[J]. Food Microbiology, 2007, 24(6): 549-558.
[4]唐靓,李跃中,徐水祥,等. 我国食品食源性致病菌监测结果分析[J]. 中国卫生检验杂志, 2016, 26(21): 3049-3052.
[5]NEWTON A, KENDALL M, VUGIA D J, et al. Increasing rates of vibriosis in the United States, 1996-2010: review of surveillance data from 2 systems[J]. Clin Infect Dis, 2012, 54(Suppl 5): 391-395.
[6]裴晓燕,余波,张秀丽,等. 中国内陆6省(自治区)淡水鱼养殖、销售和餐饮环节常见嗜盐性弧菌污染调查[J]. 中国食品卫生杂志, 2016, 28(1): 79-83.
[7]王燕梅,唐震,乔昕,等. 江苏省水产及其制品中副溶血性弧菌污染情况调查[J]. 中国卫生检验杂志, 2016, 26(19): 2846-2848.
[8]张晓华,张凡非,姚素霞,等. 太原市水产品中副溶血性弧菌污染状况与毒力基因检测[J]. 中国卫生检验杂志,2014, 24(8): 1101-1103.
[9]林云,孙炀明,罗建勇,等. 嘉兴市副溶血性弧菌腹泻流行特征及疾病负担评估[J]. 预防医学, 2016, 28(7): 687-689.
[10]梅玲玲,潘雪霞,朱敏,等. 浙江省副溶血性弧菌污染水平及贝类海产品风险评估[J]. 中国人兽共患病学报, 2012, 28(7): 700-704.
[11]TIRUVAYIPATI S, BHASSU S. Host, pathogen and the environment: the case of Macrobrachium rosenbergii, Vibrio parahaemolyticus and magnesium[J]. Gut Pathogens, 2016(8):15.
[12]林丹,王黎荔,山若青,等. 2014年温州市特定病原体的食源性疾病病例监测结果分析[J]. 中国食品卫生杂志, 2016,28(3): 378-381.
[13]吴青,韩海红,余东敏,等. 北京市水产品污染与感染病例中副溶血性弧菌血清型和毒力基因型的比较研究[J]. 中国食品卫生杂志, 2015, 27(4): 363-367.
[14]张蔚,潘劲草,孟冬梅,等. 杭州地区2000—2002年副溶血弧菌的分子分型研究[J]. 中华流行病学杂志, 2006, 27(4): 343-346.
[15]CECCARELLI D, HASAN N A, HUQ A, et al. Distribution and dynamics of epidemic and pandemic Vibrio parahaemolyticus virulence factors[J]. Frontiers in Cellular and Infection Microbiology, 2013, 3(8): 97.
[2]FUKUSHIMA H, SEKI R. Ecology of Vibrio vulnificus and Vibrio parahaemolyticus in brackish environments of the Sada River in Shimane Prefecture, Japan[J]. FEMS Microbiology Ecology, 2004, 48(2): 221-229.
[3]SU Y C, LIU C. Vibrio parahaemolyticus: a concern of seafood safety[J]. Food Microbiology, 2007, 24(6): 549-558.
[4]唐靓,李跃中,徐水祥,等. 我国食品食源性致病菌监测结果分析[J]. 中国卫生检验杂志, 2016, 26(21): 3049-3052.
[5]NEWTON A, KENDALL M, VUGIA D J, et al. Increasing rates of vibriosis in the United States, 1996-2010: review of surveillance data from 2 systems[J]. Clin Infect Dis, 2012, 54(Suppl 5): 391-395.
[6]裴晓燕,余波,张秀丽,等. 中国内陆6省(自治区)淡水鱼养殖、销售和餐饮环节常见嗜盐性弧菌污染调查[J]. 中国食品卫生杂志, 2016, 28(1): 79-83.
[7]王燕梅,唐震,乔昕,等. 江苏省水产及其制品中副溶血性弧菌污染情况调查[J]. 中国卫生检验杂志, 2016, 26(19): 2846-2848.
[8]张晓华,张凡非,姚素霞,等. 太原市水产品中副溶血性弧菌污染状况与毒力基因检测[J]. 中国卫生检验杂志,2014, 24(8): 1101-1103.
[9]林云,孙炀明,罗建勇,等. 嘉兴市副溶血性弧菌腹泻流行特征及疾病负担评估[J]. 预防医学, 2016, 28(7): 687-689.
[10]梅玲玲,潘雪霞,朱敏,等. 浙江省副溶血性弧菌污染水平及贝类海产品风险评估[J]. 中国人兽共患病学报, 2012, 28(7): 700-704.
[11]TIRUVAYIPATI S, BHASSU S. Host, pathogen and the environment: the case of Macrobrachium rosenbergii, Vibrio parahaemolyticus and magnesium[J]. Gut Pathogens, 2016(8):15.
[12]林丹,王黎荔,山若青,等. 2014年温州市特定病原体的食源性疾病病例监测结果分析[J]. 中国食品卫生杂志, 2016,28(3): 378-381.
[13]吴青,韩海红,余东敏,等. 北京市水产品污染与感染病例中副溶血性弧菌血清型和毒力基因型的比较研究[J]. 中国食品卫生杂志, 2015, 27(4): 363-367.
[14]张蔚,潘劲草,孟冬梅,等. 杭州地区2000—2002年副溶血弧菌的分子分型研究[J]. 中华流行病学杂志, 2006, 27(4): 343-346.
[15]CECCARELLI D, HASAN N A, HUQ A, et al. Distribution and dynamics of epidemic and pandemic Vibrio parahaemolyticus virulence factors[J]. Frontiers in Cellular and Infection Microbiology, 2013, 3(8): 97.
 袁瑞,付云,张鹏.2014—2016年湖州市水产品与临床腹泻病例中副溶血性弧菌的分布特征[J].中国食品卫生杂志,2017,29(3):294-298.
袁瑞,付云,张鹏.2014—2016年湖州市水产品与临床腹泻病例中副溶血性弧菌的分布特征[J].中国食品卫生杂志,2017,29(3):294-298.