DOi:10.13590/j.cjfh.2017.03.011
иғ¶дҪ“йҮ‘е…Қз–«еұӮжһҗжҠҖжңҜеҝ«йҖҹжЈҖжөӢи°·зү©дёӯ3з§ҚзңҹиҸҢжҜ’зҙ зҡ„з ”з©¶
пјҲ1пјҺжӯҰиӯҰеҗҺеӢӨйғЁз–ҫз—…йў„йҳІжҺ§еҲ¶дёӯеҝғпјҢеҢ—дә¬102613пјӣ 2пјҺйғ‘е·һдёӯйҒ“з”ҹзү©жҠҖжңҜжңүйҷҗе…¬еҸёпјҢжІіеҚ— йғ‘е·һ450000пјү
дҪңиҖ…з®Җд»Ӣпјҡ жӣ№еҫ·еә·з”·дё»д»»еҢ»еёҲз ”з©¶ж–№еҗ‘дёәеҶӣдәӢйў„йҳІеҢ»еӯҰеҸҠзҺҜеўғзӣ‘жөӢE-mailпјҡ13301080538@163.com
йҖҡдҝЎдҪңиҖ…пјҡ иӢҸе»әеҝ з”·дё»жІ»еҢ»еёҲз ”з©¶ж–№еҗ‘дёәеҚ«з”ҹзӣ‘зқЈеҸҠзҺҜеўғзӣ‘жөӢE-mailпјҡwjsjz@139.com
收зЁҝж—Ҙжңҹпјҡ 2017-02-10
еҹәйҮ‘йЎ№зӣ®пјҡ жӯҰиӯҰеҗҺеӢӨйғЁеҚ«з”ҹеұҖз§‘з ”иҜҫйўҳпјҲWJWSB2015-01пјү
ж‘ҳиҰҒ:зӣ®зҡ„ еә”з”Ёиғ¶дҪ“йҮ‘е…Қз–«еұӮжһҗжҠҖжңҜејҖеҸ‘дёҖз§Қеҝ«йҖҹжЈҖжөӢи°·зү©дёӯй»„жӣІйңүжҜ’зҙ B1пјҲAFB1пјүгҖҒзҺүзұіиөӨйңүзғҜй…®пјҲZENпјүе’Ңе‘•еҗҗжҜ’зҙ пјҲDONпјүзҡ„дёүиҒ”жЈҖжөӢеҚЎгҖӮж–№жі•дјҳеҢ–иғ¶дҪ“йҮ‘жә¶ж¶ІpHеҖјгҖҒйҮ‘ж ҮжҠ—дҪ“йҮҸеҸҠжҠ—еҺҹеҢ…иў«йҮҸеҲ¶еӨҮ3з§Қиғ¶дҪ“йҮ‘иҜ•зәёжқЎпјҢе°ҶиҜ•зәёжқЎз»„иЈ…жҲҗжЈҖжөӢеҚЎпјҢз ”з©¶иҜҘеҚЎзҡ„жЈҖжөӢйҷҗгҖҒеҮҶзЎ®еәҰгҖҒзү№ејӮжҖ§е’ҢзЁіе®ҡжҖ§гҖӮз»“жһңAFB1гҖҒZENе’ҢDON 3з§ҚиҜ•зәёжқЎзҡ„иғ¶дҪ“йҮ‘жә¶ж¶ІжңҖйҖӮpHеҖјеҲҶеҲ«дёә7.5гҖҒ7.5е’Ң7.0пјҢйҮ‘ж ҮжҠ—дҪ“йҮҸеҲҶеҲ«дёә4.2гҖҒ7.2е’Ң9.6 Ојg/mlпјҢжҠ—еҺҹеҢ…иў«йҮҸеҲҶеҲ«дёә1.0гҖҒ1.4е’Ң0.8 mg/mlгҖӮжЈҖжөӢеҚЎзҡ„жЈҖжөӢз»“жһңдёҺд»ӘеҷЁжЈҖжөӢз»“жһңеҹәжң¬дёҖиҮҙпјҢйҮҚеӨҚжҖ§иҫғеҘҪпјҢдёҺз»“жһ„зұ»дјјзү©еҸҠе…¶д»–йңүиҸҢжҜ’зҙ ж— дәӨеҸүеҸҚеә”пјҢеңЁе®Өжё©жқЎд»¶дёӢеҸҜд»Ҙдҝқеӯҳ12дёӘжңҲгҖӮз»“и®әиҜҘдёүиҒ”жЈҖжөӢеҚЎж“ҚдҪңз®ҖдҫҝгҖҒеҝ«йҖҹгҖҒеҮҶзЎ®гҖҒзЁіе®ҡпјҢдё”иғҪеҗҢж—¶жЈҖжөӢ3з§ҚзңҹиҸҢжҜ’зҙ пјҢеңЁи°·зү©зҡ„зҺ°еңәжЈҖжөӢдёӯжңүиҫғеҘҪзҡ„еә”з”ЁеүҚжҷҜгҖӮ
е…ій”®иҜҚ:
иғ¶дҪ“йҮ‘е…Қз–«еұӮжһҗжі•пјӣ и°·зү©пјӣ зңҹиҸҢжҜ’зҙ пјӣ жЈҖжөӢеҚЎпјӣ еҝ«йҖҹжЈҖжөӢпјӣ йЈҹе“ҒжұЎжҹ“зү©пјӣ йЈҹе“Ғе®үе…Ё
дёӯеӣҫеҲҶзұ»еҸ·пјҡ R155 ж–ҮзҢ®ж ҮиҜҶз ҒпјҡA ж–Үз« зј–еҸ·пјҡ1004-8456(2017)03-0306-07
Research on the rapid detection of three kinds of mycotoxin in grains
by colloidal gold immunochromatographic method
by colloidal gold immunochromatographic method
пјҲ1.Center for Diseases Control and Prevention of Chinese Peopleо„Ӣs Armed Police ForcesпјҢ Beijing 102613пјҢChinaпјӣ 2.Zhengzhou Zhongdao Biotechnology Co., LtdпјҢHenan Zhengzhou 450000пјҢChinaпјү
Abstract:Objective The colloidal gold immunochromatographic strip was developed to detect aflatoxin B1 (AFB1), zearalenone (ZEN) and deoxynivalenol (DON) in grains. MethodsThe pH of colloidal gold solution and the dosage of the specific antibody and antigen were optimized through three combinations. The limit of quantitation, accuracy, specificity and the stability of the detection strip were investigated. ResultsThe optimal pH of colloidal gold solution for AFB1, ZEN and DON was 7.5, 7.5 and 7.0, respectively. The optimal concentration of antibody marking was 4.2, 7.2 and 9.6 Ојg/ml, respectively. The optimal concentration of the specific antigen was 1.0, 1.4 and 0.8 mg/ml, respectively. Sixty samples were detected through instrument method and colloidal gold immunochromatographic method simultaneously, and the results were consistent with each other. No cross-reaction was observed with other analogue and mycotoxins, and the triple strip could be stored at room temperature for 12 months. ConclusionThe triple strip was a simple, accurate and stable method for monitoring AFB1, ZEN and DON in grains, and had good application foreground in field analysis.
Key words:
Colloidal gold immunochromatographic methodпјӣ grainsпјӣ mycotoxinпјӣ detection cardпјӣ rapid detectionпјӣ food contaminantпјӣ food safety
й»„жӣІйңүжҜ’зҙ B1пјҲAFB1пјүжҳҜиҝ„д»Ҡе·ІзҹҘжңҖејәзҡ„еҢ–еӯҰиҮҙзҷҢзү©д№ӢдёҖпј»1пјҪпјҢеҸҜеҗҢж—¶иҜұеҸ‘еӨҡз§ҚзҷҢз—ҮпјҢжӯӨеӨ–иҝҳе…·жңүејәзғҲзҡ„иҮҙз•ёжҖ§е’ҢиҮҙзӘҒеҸҳжҖ§пј»2пјҪгҖӮзҺүзұіиөӨйңүзғҜй…®пјҲZENпјүдјҡеј•иө·йӣҢжҖ§жҝҖзҙ дёӯжҜ’з—ҮпјҢйҖ жҲҗз”ҹж®–зі»з»ҹзҡ„дёҘйҮҚжҚҹдјӨпјҢиҝҳеҸҜиҜұеҜјDNA收缩пјҢеҜјиҮҙжҹ“иүІдҪ“еӨұеёёпј»3пјҪгҖӮе‘•еҗҗжҜ’зҙ пјҲDONпјүдёҘйҮҚеҪұе“Қдәәзҡ„ж¶ҲеҢ–зі»з»ҹпјҢе…·жңүз»ҶиғһжҜ’жҖ§гҖҒе…Қз–«жҜ’жҖ§е’ҢзҘһз»ҸжҜ’жҖ§пј»4пјҪгҖӮиҝҷ3з§ҚжҜ’зҙ жҷ®йҒҚеӯҳеңЁдәҺи°·зү©дёӯпјҢи¶…иҝҮеӣҪ家йҷҗйҮҸж ҮеҮҶеҗҺпјҢеҜ№дәәзұ»зҡ„еҒҘеә·е’Ңе®үе…ЁйҖ жҲҗдёҘйҮҚеЁҒиғҒпјҢеңЁGB 2761вҖ”2011гҖҠйЈҹе“Ғе®үе…ЁеӣҪ家ж ҮеҮҶ йЈҹе“ҒдёӯзңҹиҸҢжҜ’зҙ йҷҗйҮҸгҖӢпј»5пјҪдёӯ规е®ҡпјҢAFB1еңЁйәҰд»Ғе’Ңе°Ҹзұідёӯзҡ„йҷҗйҮҸеҖјдёә5 Ојg/kgгҖҒзҺүзұізіҒдёӯйҷҗйҮҸеҖјдёә20 Ојg/kgгҖҒеӨ§зұідёӯйҷҗйҮҸеҖјдёә10 Ојg/kgпјӣZENеңЁи°·зү©еҸҠе…¶еҲ¶е“Ғдёӯзҡ„йҷҗйҮҸеҖјеқҮдёә60 Ојg/kgпјӣDONеңЁи°·зү©еҸҠе…¶еҲ¶е“Ғдёӯзҡ„йҷҗйҮҸеҖјеқҮдёә1 000 Ојg/kgпјҢзҺүзұігҖҒзҺүзұізіҒпјҲжёЈгҖҒзүҮпјүгҖҒеӨ§йәҰгҖҒе°ҸйәҰгҖҒйәҰзүҮгҖҒе°ҸйәҰзІүзҡ„йҷҗйҮҸеҖјеқҮдёә1 000 Ојg/kgпјӣеӣ жӯӨпјҢеҜ№и°·зү©дёӯзңҹиҸҢжҜ’зҙ зҡ„жЈҖжөӢжҳҜдёҖйЎ№иү°е·ЁиҖҢйҮҚиҰҒзҡ„д»»еҠЎгҖӮ
зӣ®еүҚпјҢжЈҖжөӢAFB1гҖҒZENе’ҢDONзҡ„ж–№жі•жңүеҫҲеӨҡпјҢдё»иҰҒжңүи–„еұӮиүІи°ұпјҲTLCпјүжі•гҖҒж°”зӣёиүІи°ұпјҲGCпјүжі•гҖҒй«ҳж•Ҳж¶ІзӣёиүІи°ұпјҲHPLCпјүжі•гҖҒй…¶иҒ”е…Қз–«еҗёйҷ„пјҲELISAпјүжі•е’Ңиғ¶дҪ“йҮ‘е…Қз–«еұӮжһҗпјҲGICAпјүжі•пј»6-10пјҪгҖӮTLCжҳҜеә”з”ЁжңҖж—©гҖҒжңҖе№ҝжіӣзҡ„жЈҖжөӢжҠҖжңҜпјҢд№ҹжҳҜжЈҖжөӢзңҹиҸҢжҜ’зҙ жңҖз»Ҹе…ёзҡ„ж–№жі•гҖӮдҪҶе…¶зҒөж•ҸеәҰдҪҺгҖҒйҮҚзҺ°жҖ§е·®гҖҒж“ҚдҪңз№ҒзҗҗгҖҒж—¶й—ҙй•ҝдё”е®үе…ЁжҖ§е·®гҖӮGCе’ҢHPLCеҸҜд»ҘеҜ№ж ·е“ҒдёӯзңҹиҸҢжҜ’зҙ иҝӣиЎҢзІҫзЎ®е®ҡйҮҸпјҢиҖҢдё”з»“жһңзЁіе®ҡпјҢжҳҜжңҖжқғеЁҒзҡ„ж–№жі•пјҢдҪҶеүҚеӨ„зҗҶзӣёеҜ№еӨҚжқӮпјҢжЈҖжөӢе‘Ёжңҹй•ҝпјҢйңҖиҰҒжҳӮиҙөзҡ„д»ӘеҷЁе№¶иҖ—иҙ№еӨ§йҮҸдәәеҠӣгҖӮELISAж“ҚдҪңзӣёеҜ№з®ҖеҚ•гҖҒзҒөж•ҸеәҰй«ҳпјҢдҪҶд№ҹйңҖиҰҒдё“й—Ёд»ӘеҷЁпјҢиҖ—ж—¶иҫғй•ҝгҖӮжӯӨеӨ–пјҢд»ҘдёҠжЈҖжөӢжҠҖжңҜеқҮдёәеҚ•дёҖжҢҮж ҮжЈҖжөӢпјҢдёҚиғҪеҗҢж—¶жЈҖжөӢеӨҡз§ҚзңҹиҸҢжҜ’зҙ гҖӮй’ҲеҜ№дёҠиҝ°жЈҖжөӢжҠҖжңҜзҡ„дёҚи¶іпјҢжң¬иҜ•йӘҢеә”з”Ёиғ¶дҪ“йҮ‘е…Қз–«еұӮжһҗжі•з ”еҲ¶AFB1гҖҒZENе’ҢDONжЈҖжөӢиҜ•зәёжқЎе№¶з»„иЈ…жҲҗдёүиҒ”жЈҖжөӢеҚЎпјҢжЈҖжөӢи°·зү©дёӯжұЎжҹ“зҡ„зңҹиҸҢжҜ’зҙ гҖӮиҜҘжі•ж“ҚдҪңз®ҖеҚ•гҖҒеҝ«йҖҹпјҢдёҚйңҖиҰҒдё“дёҡдәәе‘ҳе’Ңд»ӘеҷЁи®ҫеӨҮпјҢйҖӮеҗҲзҺ°еңәжЈҖжөӢпјҢеҖјеҫ—жҺЁе№ҝеә”з”ЁгҖӮ
AFB1еҚ•е…ӢйҡҶжҠ—дҪ“гҖҒZENеҚ•е…ӢйҡҶжҠ—дҪ“гҖҒDONеҚ•е…ӢйҡҶжҠ—дҪ“гҖҒAFB1-зүӣиЎҖжё…зҷҪиӣӢзҷҪпјҲBSAпјүгҖҒZEN-BSAгҖҒDON-BSAгҖҒеұұзҫҠжҠ—е°Ҹйј IgGеқҮиҙӯиҮӘжҙӣйҳідҪ°еҘҘйҖҡз”ҹзү©жҠҖжңҜжңүйҷҗе…¬еҸёпјҢAFB1пј»GBW(E)100302пјҪгҖҒZENпј»GBW(E)100301пјҪгҖҒDONпј»GBW(E)100383пјҪж ҮеҮҶе“ҒеқҮиҙӯиҮӘеӣҪ家ж ҮеҮҶзү©иҙЁдёӯеҝғпјҢзЎқй…ёзәӨз»ҙзҙ иҶңпјҲNCиҶңпјҢеҫ·еӣҪиөӣеӨҡеҲ©ж–ҜпјүпјҢиҒҡж°Ҝд№ҷзғҜпјҲPVCпјүеә•жқҝгҖҒж ·е“Ғеһ«гҖҒеҗёж°ҙзәёгҖҒзҺ»з’ғзәӨз»ҙеқҮиҙӯиҮӘдёҠжө·йҮ‘ж Үз”ҹзү©е…¬еҸёпјҢж°ҜйҮ‘й…ёпјҲзҫҺеӣҪSigmaпјүпјҢзўій…ёй’ҫпјҢжҹ жӘ¬й…ёдёүй’ пјҢйҳҙжҖ§ж ·е“Ғпјҡд»ӘеҷЁж–№жі•зЎ®е®ҡзҡ„дёҚеҗ«AFB1гҖҒZENе’ҢDONзҡ„е°ҸзұігҖҒзҺүзұізіҒгҖҒйәҰд»Ғе’ҢеӨ§зұігҖӮ
AFB1жЈҖжөӢжө“еәҰдёә0гҖҒ0.5гҖҒ1.0е’Ң2.0 ng/mlзҡ„ж ҮеҮҶе“ҒпјҢZENжЈҖжөӢжө“еәҰдёә0гҖҒ5.0гҖҒ10е’Ң20 ng/mlзҡ„ж ҮеҮҶе“ҒпјҢDONжЈҖжөӢжө“еәҰдёә0гҖҒ100гҖҒ200е’Ң300 ng/ml зҡ„ж ҮеҮҶе“ҒпјҢжҜ”иҫғAFB1-BSA/ZEN-BSA/DON-BSAжө“еәҰзҡ„еҸҳеҢ–еҜ№иҜ•зәёжқЎжЈҖжөӢз»“жһңзҡ„еҪұе“ҚгҖӮйҖүжӢ©жЈҖжөӢзәҝжңҖдҪіжө“еәҰзҡ„ж ҮеҮҶеҰӮдёӢпјҡйҳҙжҖ§жә¶ж¶Іпј»0.01 mol pH=7.4 зЈ·й…ёзӣҗпјҲPBSпјүзј“еҶІж¶ІпјҪж»ҙе®ҡж—¶пјҢCзәҝе’ҢTзәҝжҳҫиүІж·ұеәҰйҖӮдёӯпјҢдёӨзәҝжҳҫиүІдёҖиҮҙжҲ–TзәҝжҳҫиүІеӨ§дәҺCзәҝпјӣз”Ёж ҮеҮҶе“Ғж»ҙе®ҡж—¶пјҢиҜ•зәёжқЎзҒөж•ҸеәҰи¶Ҡй«ҳи¶ҠеҘҪгҖӮ
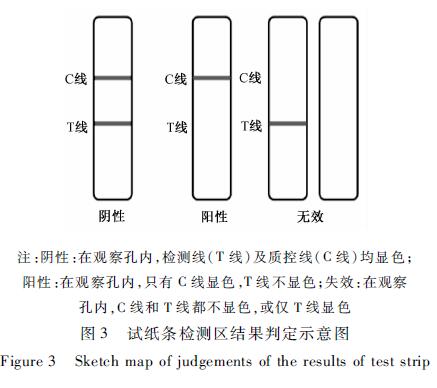
з”Ёж»ҙз®ЎеҗёеҸ–еҫ…жөӢж¶Іж»ҙеҠ дәҺеҠ ж ·еӯ”дёӯпјҢжҜҸеӯ”2пҪһ3ж»ҙгҖӮеҠ ж ·еҗҺејҖе§Ӣи®Ўж—¶пјҢз»“жһңеә”еңЁ5пҪһ8 minиҜ»еҸ–пјҢе…¶д»–ж—¶й—ҙеҲӨиҜ»ж— ж•ҲгҖӮиҜ»еҸ–з»“жһңж—¶пјҢжЈҖжөӢеҚЎдёӯжҜҸдёӘиҜ•зәёжқЎз»“жһңи§ЈйҮҠи§Ғеӣҫ3гҖӮ
дёҺHPLCжі•жҜ”иҫғпјҡжҢүз…§1.2.6ж–№жі•жЈҖжөӢж ·е“Ғдёӯ3з§ҚжҜ’зҙ еҗ«йҮҸпјҢеӨ§дәҺзӯүдәҺжЈҖжөӢйҷҗзҡ„еҲӨдёәйҳіжҖ§пјҢеҸҚд№ӢеҲӨдёәйҳҙжҖ§гҖӮеҗҢж—¶з”ЁHPLCжі•еҲҶеҲ«жЈҖжөӢж ·е“Ғдёӯзҡ„ZENпј»12пјҪгҖҒDONпј»13пјҪе’ҢAFB1пј»14пјҪпјҢж №жҚ®еӣҪ家规е®ҡзҡ„зңҹиҸҢжҜ’зҙ еңЁи°·зү©дёӯзҡ„йҷҗйҮҸж ҮеҮҶеҲӨе®ҡз»“жһңпј»5пјҪгҖӮ
зү№ејӮжҖ§иҜ•йӘҢпјҡйҖҡиҝҮдёҺз»“жһ„зұ»дјјзү©еҸҠе…¶д»–йңүиҸҢжҜ’зҙ зҡ„дәӨеҸүеҸҚеә”иҜ•йӘҢжқҘз ”з©¶гҖӮз”Ёеҗ«15%з”ІйҶҮзҡ„PBSзј“еҶІж¶ІеҲҶеҲ«е°ҶAFB1гҖҒAFM1гҖҒAFB2гҖҒDONгҖҒиөӯжӣІйңүжҜ’зҙ AгҖҒT-2жҜ’зҙ гҖҒZENгҖҒзҺүзұіиөӨйңүйҶҮеҲ¶еӨҮжҲҗжө“еәҰдёә1.0гҖҒ5.0гҖҒ100е’Ң500 ng/mlзҡ„жә¶ж¶ІпјҢз”ЁдёүиҒ”жЈҖжөӢеҚЎиҝӣиЎҢжЈҖжөӢгҖӮ
зЁіе®ҡжҖ§иҜ•йӘҢпјҡе°ҶдёүиҒ”жЈҖжөӢеҚЎзҪ®дәҺй“қз®”иўӢдёӯпјҢеҠ е№ІзҮҘеүӮеҜҶй—ӯеҢ…иЈ…пјҢж”ҫдәҺ37 в„ғжқЎд»¶дёӢдҝқеӯҳ8е‘ЁгҖӮеҲҶеҲ«еңЁз¬¬1еӨ©гҖҒ第2еӨ©гҖҒ第4еӨ©гҖҒ第7еӨ©д»ҘеҸҠд№ӢеҗҺзҡ„жҜҸе‘ЁеҸ–еҮәдёүиҒ”жЈҖжөӢеҚЎжЈҖжөӢеҗ«15%з”ІйҶҮзҡ„PBSзј“еҶІж¶ІеҸҠжө“еәҰдёә100 ng/mlзҡ„3з§Қж ҮеҮҶе“Ғжә¶ж¶ІгҖӮи§ӮеҜҹTзәҝгҖҒCзәҝзҡ„жҳҫиүІејәеәҰгҖҒзЁіе®ҡжҖ§жғ…еҶөеҸҠйҮ‘ж ҮжҠ—дҪ“зҡ„йҮҠж”ҫжғ…еҶөгҖӮ
зӣ®еүҚпјҢжЈҖжөӢAFB1гҖҒZENе’ҢDONзҡ„ж–№жі•жңүеҫҲеӨҡпјҢдё»иҰҒжңүи–„еұӮиүІи°ұпјҲTLCпјүжі•гҖҒж°”зӣёиүІи°ұпјҲGCпјүжі•гҖҒй«ҳж•Ҳж¶ІзӣёиүІи°ұпјҲHPLCпјүжі•гҖҒй…¶иҒ”е…Қз–«еҗёйҷ„пјҲELISAпјүжі•е’Ңиғ¶дҪ“йҮ‘е…Қз–«еұӮжһҗпјҲGICAпјүжі•пј»6-10пјҪгҖӮTLCжҳҜеә”з”ЁжңҖж—©гҖҒжңҖе№ҝжіӣзҡ„жЈҖжөӢжҠҖжңҜпјҢд№ҹжҳҜжЈҖжөӢзңҹиҸҢжҜ’зҙ жңҖз»Ҹе…ёзҡ„ж–№жі•гҖӮдҪҶе…¶зҒөж•ҸеәҰдҪҺгҖҒйҮҚзҺ°жҖ§е·®гҖҒж“ҚдҪңз№ҒзҗҗгҖҒж—¶й—ҙй•ҝдё”е®үе…ЁжҖ§е·®гҖӮGCе’ҢHPLCеҸҜд»ҘеҜ№ж ·е“ҒдёӯзңҹиҸҢжҜ’зҙ иҝӣиЎҢзІҫзЎ®е®ҡйҮҸпјҢиҖҢдё”з»“жһңзЁіе®ҡпјҢжҳҜжңҖжқғеЁҒзҡ„ж–№жі•пјҢдҪҶеүҚеӨ„зҗҶзӣёеҜ№еӨҚжқӮпјҢжЈҖжөӢе‘Ёжңҹй•ҝпјҢйңҖиҰҒжҳӮиҙөзҡ„д»ӘеҷЁе№¶иҖ—иҙ№еӨ§йҮҸдәәеҠӣгҖӮELISAж“ҚдҪңзӣёеҜ№з®ҖеҚ•гҖҒзҒөж•ҸеәҰй«ҳпјҢдҪҶд№ҹйңҖиҰҒдё“й—Ёд»ӘеҷЁпјҢиҖ—ж—¶иҫғй•ҝгҖӮжӯӨеӨ–пјҢд»ҘдёҠжЈҖжөӢжҠҖжңҜеқҮдёәеҚ•дёҖжҢҮж ҮжЈҖжөӢпјҢдёҚиғҪеҗҢж—¶жЈҖжөӢеӨҡз§ҚзңҹиҸҢжҜ’зҙ гҖӮй’ҲеҜ№дёҠиҝ°жЈҖжөӢжҠҖжңҜзҡ„дёҚи¶іпјҢжң¬иҜ•йӘҢеә”з”Ёиғ¶дҪ“йҮ‘е…Қз–«еұӮжһҗжі•з ”еҲ¶AFB1гҖҒZENе’ҢDONжЈҖжөӢиҜ•зәёжқЎе№¶з»„иЈ…жҲҗдёүиҒ”жЈҖжөӢеҚЎпјҢжЈҖжөӢи°·зү©дёӯжұЎжҹ“зҡ„зңҹиҸҢжҜ’зҙ гҖӮиҜҘжі•ж“ҚдҪңз®ҖеҚ•гҖҒеҝ«йҖҹпјҢдёҚйңҖиҰҒдё“дёҡдәәе‘ҳе’Ңд»ӘеҷЁи®ҫеӨҮпјҢйҖӮеҗҲзҺ°еңәжЈҖжөӢпјҢеҖјеҫ—жҺЁе№ҝеә”з”ЁгҖӮ
1жқҗж–ҷдёҺж–№жі•
1.1жқҗж–ҷ
1.1.1ж ·е“ҒжқҘжәҗ
еҢ—дә¬еёӮжҹҗи¶…еёӮгҖҒжҹҗйӣҶиҙёеёӮеңәиҙӯд№°зҡ„е°ҸзұігҖҒзҺүзұізіҒгҖҒйәҰд»Ғе’ҢеӨ§зұіпјҢеҗ„15д»ҪгҖӮ
1.1.2дё»иҰҒд»ӘеҷЁдёҺиҜ•еүӮ
HM3030еһӢXYZдёүз»ҙеҲ’иҶңе–·йҮ‘д»ӘпјҲдёҠжө·йҮ‘ж ҮпјүгҖҒзҙ«еӨ–еҸҜи§ҒеҲҶе…үе…үеәҰи®ЎпјҲдёҠжө·зҫҺи°ұиҫҫд»ӘеҷЁжңүйҷҗе…¬еҸёпјүгҖҒзңҹз©әе№ІзҮҘз®ұгҖҒдҪҺжё©й«ҳйҖҹзҰ»еҝғжңәгҖҒZQ3500еһӢж•°жҺ§еҝ«йҖҹж–©еҲҮжңәгҖҒжҒ’жё©еҹ№е…»з®ұгҖҒеҲҮжқЎжңәгҖҒзЈҒеҠӣжҗ…жӢҢеҷЁгҖҒpHи®ЎгҖӮAFB1еҚ•е…ӢйҡҶжҠ—дҪ“гҖҒZENеҚ•е…ӢйҡҶжҠ—дҪ“гҖҒDONеҚ•е…ӢйҡҶжҠ—дҪ“гҖҒAFB1-зүӣиЎҖжё…зҷҪиӣӢзҷҪпјҲBSAпјүгҖҒZEN-BSAгҖҒDON-BSAгҖҒеұұзҫҠжҠ—е°Ҹйј IgGеқҮиҙӯиҮӘжҙӣйҳідҪ°еҘҘйҖҡз”ҹзү©жҠҖжңҜжңүйҷҗе…¬еҸёпјҢAFB1пј»GBW(E)100302пјҪгҖҒZENпј»GBW(E)100301пјҪгҖҒDONпј»GBW(E)100383пјҪж ҮеҮҶе“ҒеқҮиҙӯиҮӘеӣҪ家ж ҮеҮҶзү©иҙЁдёӯеҝғпјҢзЎқй…ёзәӨз»ҙзҙ иҶңпјҲNCиҶңпјҢеҫ·еӣҪиөӣеӨҡеҲ©ж–ҜпјүпјҢиҒҡж°Ҝд№ҷзғҜпјҲPVCпјүеә•жқҝгҖҒж ·е“Ғеһ«гҖҒеҗёж°ҙзәёгҖҒзҺ»з’ғзәӨз»ҙеқҮиҙӯиҮӘдёҠжө·йҮ‘ж Үз”ҹзү©е…¬еҸёпјҢж°ҜйҮ‘й…ёпјҲзҫҺеӣҪSigmaпјүпјҢзўій…ёй’ҫпјҢжҹ жӘ¬й…ёдёүй’ пјҢйҳҙжҖ§ж ·е“Ғпјҡд»ӘеҷЁж–№жі•зЎ®е®ҡзҡ„дёҚеҗ«AFB1гҖҒZENе’ҢDONзҡ„е°ҸзұігҖҒзҺүзұізіҒгҖҒйәҰд»Ғе’ҢеӨ§зұігҖӮ
1.2ж–№жі•
1.2.1иғ¶дҪ“йҮ‘зҡ„еҲ¶еӨҮ
з”Ёи¶…зәҜж°ҙе°Ҷ1.0%ж°ҜйҮ‘й…ёзЁҖйҮҠжҲҗ0.01%пјҢзҪ®дәҺзЈҒеҠӣжҗ…жӢҢеҷЁдёҠжҗ…жӢҢз…®жІёпјҢиҝ…йҖҹеҠ е…Ҙ1.0 ml 1%жҹ жӘ¬й…ёдёүй’ пјҢ继з»ӯеҠ зғӯз…®жІё15 minпјҢжә¶ж¶Із”ұзҒ°иүІеҸҳжҲҗй»‘иүІпјҢйҡҸеҗҺзЁіе®ҡжҲҗзәўиүІгҖӮе…ій—ӯеҠ зғӯз”өжәҗпјҢеҶ·еҚҙиҮіе®Өжё©еҗҺз”Ёи¶…зәҜж°ҙиЎҘи¶ідҪ“з§ҜпјҢз”Ёзҙ«еӨ–еҸҜи§ҒеҲҶе…үе…үеәҰи®Ўжү«жҸҸжқҘдј°з®—йҮ‘йў—зІ’зҡ„еӨ§е°ҸпјҢ4 в„ғжқЎд»¶дёӢдҝқеӯҳеӨҮз”ЁгҖӮ
1.2.2иғ¶дҪ“йҮ‘жә¶ж¶ІжңҖйҖӮpHеҖјзҡ„зЎ®е®ҡ
еҸ–10ж”Ҝ5 mlзҺ»з’ғе°ҸиҜ•з®ЎпјҢеҲҶеҲ«еҠ е…Ҙ1.0 mlиғ¶дҪ“йҮ‘жә¶ж¶ІпјҢз”Ё0.1 mol/Lзҡ„K2CO3и°ғиҠӮpHеҖјдёә5.5гҖҒ6.0гҖҒ6.5гҖҒ7.0гҖҒ7.5гҖҒ8.0гҖҒ8.5гҖҒ9.0гҖҒ9.5гҖҒ10.0пјҢжҜҸз®ЎеҠ е…Ҙ10 Ојg AFB1еҚ•е…ӢйҡҶжҠ—дҪ“гҖӮж··еҢҖ并йқҷзҪ®10 minеҗҺпјҢеҲҶеҲ«еҠ е…Ҙ100 Ојl 10%NaClжә¶ж¶ІпјҢж··еҢҖеҗҺйқҷзҪ®2 hпјҢи§ӮеҜҹжә¶ж¶ІйўңиүІзҡ„еҸҳеҢ–гҖӮжә¶ж¶ІдҝқжҢҒзәўиүІзҡ„жңҖдҪҺpHеҖјеҸҜзЎ®е®ҡдёәиғ¶дҪ“йҮ‘жә¶ж¶Ізҡ„жңҖйҖӮpHеҖјгҖӮиғ¶дҪ“йҮ‘з»“еҗҲZENе’ҢDONеҚ•е…ӢйҡҶжҠ—дҪ“зҡ„жңҖйҖӮpHеҖјд№ҹжҢүжӯӨж–№жі•зЎ®е®ҡгҖӮ
1.2.3жҠ—дҪ“ж Үи®°йҮҸзҡ„зЎ®е®ҡ
3з§ҚжҠ—дҪ“еҲҶеҲ«йҖүжӢ©1.2.2дёӯзЎ®е®ҡзҡ„жңҖйҖӮpHеҖјзҡ„иғ¶дҪ“йҮ‘жә¶ж¶ІпјҢеҗ„еҸ–9з®ЎпјҢжҜҸз®Ў1.0 mlгҖӮеҠ е…ҘдёҚеҗҢйҮҸзҡ„жҠ—дҪ“пјҢAFB1еҚ•е…ӢйҡҶжҠ—дҪ“еҠ е…ҘйҮҸзҡ„иҢғеӣҙдёә20пҪһ55 ОјlпјҲжҠ—дҪ“жө“еәҰ0.1 mg/mlпјүпјҢZENе’ҢDONеҚ•е…ӢйҡҶжҠ—дҪ“еҠ е…ҘйҮҸзҡ„иҢғеӣҙеқҮдёә2.0пҪһ16 ОјlпјҲжҠ—дҪ“жө“еәҰ1.0 mg/mlпјүпјҢиЎҘи¶ідҪ“з§ҜиҮі1.1 mlпјҢеҜ№з…§з®Ўд»…еҠ 0.1 mlзЁҖйҮҠж¶ІпјҢж··еҢҖгҖӮ5 minеҗҺпјҢеңЁеҗ„з®ЎеҠ е…Ҙ0.1 ml 10% NaClжә¶ж¶ІпјҢж··еҢҖеҗҺйқҷзҪ®2 hпјҢи§ӮеҜҹжә¶ж¶ІйўңиүІзҡ„еҸҳеҢ–гҖӮжә¶ж¶ІдҝқжҢҒзәўиүІзҡ„жңҖдҪҺжҠ—дҪ“йҮҸеҸҜзЎ®е®ҡдёәзЁіе®ҡиғ¶дҪ“йҮ‘зҡ„жңҖдҪҺжҠ—дҪ“йҮҸгҖӮеңЁжңҖдҪҺжҠ—дҪ“йҮҸзҡ„еҹәзЎҖдёҠеҶҚеўһеҠ 10%пҪһ20%еҚідёәиғ¶дҪ“йҮ‘ж Үи®°зҡ„жңҖдҪіжҠ—дҪ“йҮҸпј»11пјҪгҖӮ
1.2.4жЈҖжөӢзәҝжңҖдҪіжө“еәҰзҡ„зЎ®е®ҡ
е°Ҷ1.0 mg/mlзҡ„еұұзҫҠжҠ—е°Ҹйј IgGеҢ…иў«еңЁNCиҶңзҡ„иҙЁжҺ§зәҝпјҲCзәҝпјүдёҠпјҢеҗҢж—¶е°ҶAFB1-BSAгҖҒZEN-BSAе’ҢDON-BSAеҲҶеҲ«жўҜеәҰзЁҖйҮҠжҲҗ0.4гҖҒ0.6гҖҒ0.8гҖҒ1.0гҖҒ1.2гҖҒ1.4е’Ң1.6 mg/ml 7дёӘжө“еәҰеҢ…иў«еңЁNCиҶңзҡ„жЈҖжөӢзәҝпјҲTзәҝпјүдёҠпјҢе–·йҮҸеқҮдёә1.0 Ојl/cmпјҢй—ҙи·қдёә5 mmпјҢ37 в„ғе№ІзҮҘ2 hпјҢдҪңдёәиҜ•зәёжқЎзҡ„жЈҖжөӢеҢәпјҢдёҺжңҖйҖӮжқЎд»¶дёӢеҲ¶еӨҮзҡ„з»“еҗҲеһ«з»„иЈ…жҲҗиҜ•зәёжқЎгҖӮAFB1жЈҖжөӢжө“еәҰдёә0гҖҒ0.5гҖҒ1.0е’Ң2.0 ng/mlзҡ„ж ҮеҮҶе“ҒпјҢZENжЈҖжөӢжө“еәҰдёә0гҖҒ5.0гҖҒ10е’Ң20 ng/mlзҡ„ж ҮеҮҶе“ҒпјҢDONжЈҖжөӢжө“еәҰдёә0гҖҒ100гҖҒ200е’Ң300 ng/ml зҡ„ж ҮеҮҶе“ҒпјҢжҜ”иҫғAFB1-BSA/ZEN-BSA/DON-BSAжө“еәҰзҡ„еҸҳеҢ–еҜ№иҜ•зәёжқЎжЈҖжөӢз»“жһңзҡ„еҪұе“ҚгҖӮйҖүжӢ©жЈҖжөӢзәҝжңҖдҪіжө“еәҰзҡ„ж ҮеҮҶеҰӮдёӢпјҡйҳҙжҖ§жә¶ж¶Іпј»0.01 mol pH=7.4 зЈ·й…ёзӣҗпјҲPBSпјүзј“еҶІж¶ІпјҪж»ҙе®ҡж—¶пјҢCзәҝе’ҢTзәҝжҳҫиүІж·ұеәҰйҖӮдёӯпјҢдёӨзәҝжҳҫиүІдёҖиҮҙжҲ–TзәҝжҳҫиүІеӨ§дәҺCзәҝпјӣз”Ёж ҮеҮҶе“Ғж»ҙе®ҡж—¶пјҢиҜ•зәёжқЎзҒөж•ҸеәҰи¶Ҡй«ҳи¶ҠеҘҪгҖӮ
1.2.5иғ¶дҪ“йҮ‘е…Қз–«еұӮжһҗиҜ•зәёжқЎе’ҢдёүиҒ”жЈҖжөӢеҚЎзҡ„з»„иЈ…
е°Ҷиғ¶дҪ“йҮ‘ж Үи®°зҡ„еҚ•е…ӢйҡҶжҠ—дҪ“пјҲд»ҘдёӢз®Җз§°йҮ‘ж ҮжҠ—дҪ“пјүе–·еңЁзҺ»з’ғзәӨз»ҙдёҠеҲ¶жҲҗз»“еҗҲеһ«пјҢе°Ҷе®Ңе…ЁжҠ—еҺҹе’ҢеұұзҫҠжҠ—е°Ҹйј IgGеҢ…иў«дәҺNCиҶңдёҠпјҢеҲҶеҲ«дҪңдёәTзәҝе’ҢCзәҝгҖӮз»ҸеӨ„зҗҶзҡ„ж ·е“Ғеһ«пјҲ1.5 cmГ—10 cmпјүгҖҒз»“еҗҲеһ«пјҲ1.5 cmГ—10 cmпјүгҖҒNCиҶңпјҲ2.5 cmГ—10 cmпјүе’Ңеҗёж°ҙеһ«пјҲ1.5 cmГ—10 cmпјүжҜҸдёӨйғЁеҲҶд»Ҙ2 mmйҮҚеҸ пјҢдҫқж¬ЎзІҳеңЁPVCеә•жқҝпјҲ6 cmГ—5 cmпјүдёҠпјҢз”ЁеҲҮжқЎжңәеҲҮжҲҗе®Ҫ3 mmзҡ„иғ¶дҪ“йҮ‘е…Қз–«еұӮжһҗиҜ•зәёжқЎпјҢе…¶дҫ§йқўз»“жһ„зӨәж„Ҹеӣҫи§Ғеӣҫ1гҖӮе°Ҷ3з§ҚиҜ•зәёжқЎжҢүжҢҮе®ҡдҪҚзҪ®ж”ҫе…ҘдёүиҒ”жЈҖжөӢеҚЎеҚЎж§ҪеҶ…пјҢзӣ–дёҠеҚЎзӣ–пјҢз»„иЈ…жҲҗдёүиҒ”жЈҖжөӢеҚЎпјҲи§Ғеӣҫ2пјүгҖӮ
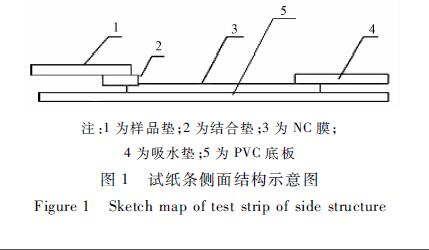
|
жіЁпјҡ1дёәж ·е“Ғеһ«пјӣ2дёәз»“еҗҲеһ«пјӣ3дёәNCиҶңпјӣ 4дёәеҗёж°ҙеһ«пјӣ5дёәPVCеә•жқҝ еӣҫ1иҜ•зәёжқЎдҫ§йқўз»“жһ„зӨәж„Ҹеӣҫ Figure 1Sketch map of test strip of side structure |

|
еӣҫ2зңҹиҸҢжҜ’зҙ дёүиҒ”жЈҖжөӢеҚЎе®һзү©еӣҫ Figure 2Physical map of triple detection card of mycotoxin |
1.2.6и°·зү©дёӯ3з§ҚзңҹиҸҢжҜ’зҙ зҡ„жЈҖжөӢ
е°ҶзҺүзұізіҒзІүзўҺеҗҺиҝҮ0.850 mmзӯӣеӯ”зҡ„зӯӣеӯҗгҖӮз§°еҸ–2.0 gж ·е“ҒзҪ®дәҺ50 mlзҡ„зҰ»еҝғз®ЎдёӯпјҢеҠ е…Ҙ4.0 mlзҡ„з”ІйҶҮ-PBSзј“еҶІж¶ІпјҲ7вҲ¶3пјҢV/VпјүпјҢе……еҲҶжҢҜиҚЎ5 minпјҢ5 000 r/minзҰ»еҝғ6 minгҖӮеҸ–дёҠжё…ж¶І0.2 mlеҠ е…Ҙ0.8 ml PBSзј“еҶІж¶ІзЁҖйҮҠ5еҖҚдҪңдёәеҫ…жөӢж¶ІгҖӮз”Ёж»ҙз®ЎеҗёеҸ–еҫ…жөӢж¶Іж»ҙеҠ дәҺеҠ ж ·еӯ”дёӯпјҢжҜҸеӯ”2пҪһ3ж»ҙгҖӮеҠ ж ·еҗҺејҖе§Ӣи®Ўж—¶пјҢз»“жһңеә”еңЁ5пҪһ8 minиҜ»еҸ–пјҢе…¶д»–ж—¶й—ҙеҲӨиҜ»ж— ж•ҲгҖӮиҜ»еҸ–з»“жһңж—¶пјҢжЈҖжөӢеҚЎдёӯжҜҸдёӘиҜ•зәёжқЎз»“жһңи§ЈйҮҠи§Ғеӣҫ3гҖӮ
|
жіЁпјҡйҳҙжҖ§пјҡеңЁи§ӮеҜҹеӯ”еҶ…пјҢжЈҖжөӢзәҝпјҲTзәҝпјүеҸҠиҙЁжҺ§зәҝпјҲCзәҝпјүеқҮжҳҫиүІпјӣ йҳіжҖ§пјҡеңЁи§ӮеҜҹеӯ”еҶ…пјҢеҸӘжңүCзәҝжҳҫиүІпјҢTзәҝдёҚжҳҫиүІпјӣеӨұж•ҲпјҡеңЁи§ӮеҜҹ еӯ”еҶ…пјҢCзәҝе’ҢTзәҝйғҪдёҚжҳҫиүІпјҢжҲ–д»…TзәҝжҳҫиүІ еӣҫ3иҜ•зәёжқЎжЈҖжөӢеҢәз»“жһңеҲӨе®ҡзӨәж„Ҹеӣҫ Figure 3Sketch map of judgements of the results of test strip |
1.2.7дёүиҒ”жЈҖжөӢеҚЎзҡ„иҙЁйҮҸиҜ„д»·
дёҚеҗҢз§Қзұ»ж ·е“Ғдёӯ3з§ҚжҜ’зҙ жЈҖжөӢйҷҗзҡ„зЎ®е®ҡпјҡ4з§ҚйҳҙжҖ§ж ·е“ҒпјҲе°ҸзұігҖҒзҺүзұізіҒгҖҒйәҰд»Ғе’ҢеӨ§зұіпјүеҲҶеҲ«еҸ–15д»ҪпјҢжҜҸд»Ҫ2.0 gгҖӮеҲҶеҲ«еҠ е…ҘдёҚеҗҢжө“еәҰзҡ„AFB1гҖҒZENе’ҢDONж ҮеҮҶе“ҒпјҢAFB1еҠ е…Ҙж ҮеҮҶе“Ғзҡ„жө“еәҰеҲҶеҲ«дёә0гҖҒ2.5гҖҒ5.0гҖҒ10е’Ң20 ng/gпјҢZENеҠ е…Ҙж ҮеҮҶе“Ғзҡ„жө“еәҰ0гҖҒ15гҖҒ30гҖҒ60е’Ң90 ng/gпјҢDONеҠ е…Ҙж ҮеҮҶе“Ғзҡ„жө“еәҰдёә0гҖҒ500гҖҒ750гҖҒ1 000е’Ң1 500 ng/gпјҢжҜҸдёӘжө“еәҰеҒҡ3ж¬ЎйҮҚеӨҚгҖӮжҢүз…§1.2.6ж–№жі•жЈҖжөӢж ·е“ҒдёӯжҜ’зҙ еҗ«йҮҸгҖӮдёҺHPLCжі•жҜ”иҫғпјҡжҢүз…§1.2.6ж–№жі•жЈҖжөӢж ·е“Ғдёӯ3з§ҚжҜ’зҙ еҗ«йҮҸпјҢеӨ§дәҺзӯүдәҺжЈҖжөӢйҷҗзҡ„еҲӨдёәйҳіжҖ§пјҢеҸҚд№ӢеҲӨдёәйҳҙжҖ§гҖӮеҗҢж—¶з”ЁHPLCжі•еҲҶеҲ«жЈҖжөӢж ·е“Ғдёӯзҡ„ZENпј»12пјҪгҖҒDONпј»13пјҪе’ҢAFB1пј»14пјҪпјҢж №жҚ®еӣҪ家规е®ҡзҡ„зңҹиҸҢжҜ’зҙ еңЁи°·зү©дёӯзҡ„йҷҗйҮҸж ҮеҮҶеҲӨе®ҡз»“жһңпј»5пјҪгҖӮ
зү№ејӮжҖ§иҜ•йӘҢпјҡйҖҡиҝҮдёҺз»“жһ„зұ»дјјзү©еҸҠе…¶д»–йңүиҸҢжҜ’зҙ зҡ„дәӨеҸүеҸҚеә”иҜ•йӘҢжқҘз ”з©¶гҖӮз”Ёеҗ«15%з”ІйҶҮзҡ„PBSзј“еҶІж¶ІеҲҶеҲ«е°ҶAFB1гҖҒAFM1гҖҒAFB2гҖҒDONгҖҒиөӯжӣІйңүжҜ’зҙ AгҖҒT-2жҜ’зҙ гҖҒZENгҖҒзҺүзұіиөӨйңүйҶҮеҲ¶еӨҮжҲҗжө“еәҰдёә1.0гҖҒ5.0гҖҒ100е’Ң500 ng/mlзҡ„жә¶ж¶ІпјҢз”ЁдёүиҒ”жЈҖжөӢеҚЎиҝӣиЎҢжЈҖжөӢгҖӮ
зЁіе®ҡжҖ§иҜ•йӘҢпјҡе°ҶдёүиҒ”жЈҖжөӢеҚЎзҪ®дәҺй“қз®”иўӢдёӯпјҢеҠ е№ІзҮҘеүӮеҜҶй—ӯеҢ…иЈ…пјҢж”ҫдәҺ37 в„ғжқЎд»¶дёӢдҝқеӯҳ8е‘ЁгҖӮеҲҶеҲ«еңЁз¬¬1еӨ©гҖҒ第2еӨ©гҖҒ第4еӨ©гҖҒ第7еӨ©д»ҘеҸҠд№ӢеҗҺзҡ„жҜҸе‘ЁеҸ–еҮәдёүиҒ”жЈҖжөӢеҚЎжЈҖжөӢеҗ«15%з”ІйҶҮзҡ„PBSзј“еҶІж¶ІеҸҠжө“еәҰдёә100 ng/mlзҡ„3з§Қж ҮеҮҶе“Ғжә¶ж¶ІгҖӮи§ӮеҜҹTзәҝгҖҒCзәҝзҡ„жҳҫиүІејәеәҰгҖҒзЁіе®ҡжҖ§жғ…еҶөеҸҠйҮ‘ж ҮжҠ—дҪ“зҡ„йҮҠж”ҫжғ…еҶөгҖӮ
2з»“жһңдёҺеҲҶжһҗ
2.1иғ¶дҪ“йҮ‘йў—зІ’зҡ„зү№еҫҒ
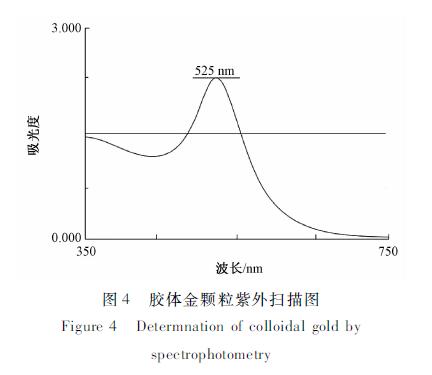
иғ¶дҪ“йҮ‘жә¶ж¶Ідёәжҫ„жё…зҡ„й…’зәўиүІпјҢжңӘеҸ‘зҺ°жјӮжө®зү©еҸҠйў—зІ’жІүж·Җзү©пјҢз”Ёзҙ«еӨ–еҸҜи§ҒеҲҶе…үе…үеәҰи®Ўжү«жҸҸеҸҜзҹҘпјҲи§Ғ еӣҫ4пјүпјҢзҙ«еӨ–жү«жҸҸзҡ„жңҖеӨ§еҗёж”¶еі°жіўй•ҝдёә525 nmгҖӮж №жҚ®еӣһеҪ’ж–№зЁӢy=0.4271x+514.56и®Ўз®—пј»15пјҪпјҢеҫ—еҲ°иғ¶дҪ“йҮ‘йў—зІ’зӣҙеҫ„еӨ§е°Ҹдёә25 nmгҖӮ
2.2иғ¶дҪ“йҮ‘жә¶ж¶ІжңҖйҖӮpHеҖјзҡ„зЎ®е®ҡ
дёҚеҗҢpHеҖјзҡ„иғ¶дҪ“йҮ‘жә¶ж¶ІдёҺжҠ—дҪ“з»“еҗҲпјҢиӢҘpHеҖјжңӘиҫҫеҲ°еҗҢиӣӢзҷҪз»“еҗҲзҡ„жңҖйҖӮзӮ№ж—¶пјҢиғ¶дҪ“йҮ‘дјҡиҒҡжІүпјҢжә¶ж¶Із”ұзәўиүІеҸҳдёәи“қиүІпјҢдҝқжҢҒзәўиүІзҡ„жңҖдҪҺpHеҖјдҪңдёәжңҖйҖӮpHеҖјгҖӮз”ұжӯӨеҸҜзҹҘпјҢAFB1йҮ‘ж ҮжҠ—дҪ“гҖҒZENйҮ‘ж ҮжҠ—дҪ“зҡ„жңҖйҖӮpHеҖјеқҮдёә7.5пјҢ DONйҮ‘ж ҮжҠ—дҪ“зҡ„жңҖйҖӮpHеҖјдёә7.0гҖӮ
|
еӣҫ4иғ¶дҪ“йҮ‘йў—зІ’зҙ«еӨ–жү«жҸҸеӣҫ Figure 4Determnation of colloidal gold by spectrophotometry |
2.3жҠ—дҪ“ж Үи®°йҮҸзҡ„зЎ®е®ҡ
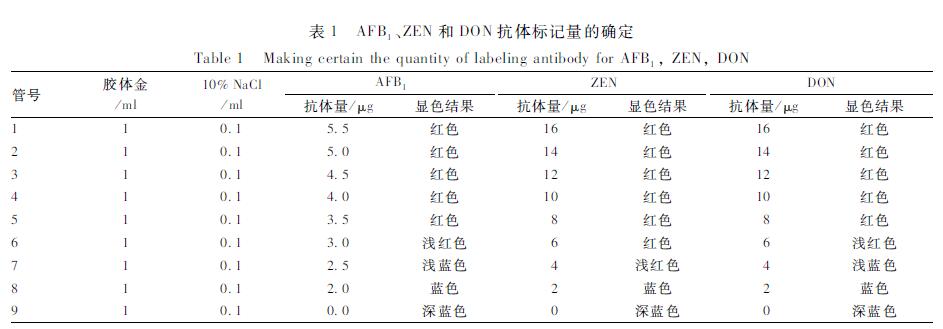
еҸ–дёҖзі»еҲ—pHеҖјдёә7.5пјҲAFB1е’ҢZENжҠ—дҪ“жңҖйҖӮпјүе’Ң7.0пјҲDONжҠ—дҪ“жңҖйҖӮпјүзҡ„иғ¶дҪ“йҮ‘жә¶ж¶ІпјҢзЎ®е®ҡдәҶ3з§ҚжҠ—дҪ“жңҖйҖӮж Үи®°йҮҸпјҢз»“жһңи§ҒиЎЁ1гҖӮеҸҜд»ҘзңӢеҮәпјҢеҗ‘1 mlиғ¶дҪ“йҮ‘жә¶ж¶ІдёӯеҠ е…ҘAFB1жҠ—дҪ“йҮҸвүҘ3.5 ОјgпјҢжҲ–еҠ е…ҘZENжҠ—дҪ“йҮҸвүҘ6 ОјgпјҢжҲ–еҠ е…ҘDONжҠ—дҪ“йҮҸвүҘ8 ОјgпјҢжә¶ж¶ІзЁіе®ҡпјҢйўңиүІз”ұи“қиүІеҸҳдёәзЁіе®ҡзҡ„зәўиүІгҖӮеңЁжӯӨеҹәзЎҖдёҠпјҢеўһеҠ 20%зҡ„иӣӢзҷҪйҮҸеҚідёәжңҖйҖӮжҠ—дҪ“з”ЁйҮҸпј»11пјҪгҖӮеӣ жӯӨпјҢAFB1гҖҒZENе’ҢDONжҠ—дҪ“зҡ„жңҖйҖӮжө“еәҰеҲҶеҲ«дёә4.2гҖҒ7.2е’Ң9.6 Ојg/mlгҖӮ
|
иЎЁ1AFB1гҖҒZENе’ҢDONжҠ—дҪ“ж Үи®°йҮҸзҡ„зЎ®е®ҡ Table 1Making certain the quantity of labeling antibody for AFB1, ZEN, DON |
2.4TзәҝжңҖдҪіжө“еәҰзҡ„зЎ®е®ҡ
CзәҝеұұзҫҠжҠ—е°Ҹйј IgGеҢ…иў«жө“еәҰдёә1.0 mg/mlпјҢеҪ“TзәҝAFB1-BSAеҢ…иў«йҮҸдёә1.0 mg/mlпјҢAFB1иҜ•зәёжқЎжҳҫиүІиҫғеҘҪпјҢеҠ ж ҮеҗҺжңүжҳҺжҳҫзҡ„жўҜеәҰпјҢж ҮеҮҶе“Ғжө“еәҰвүҘ1.0 ng/mlж—¶пјҢиҜ•зәёжқЎжЈҖжөӢдёәйҳіжҖ§пјӣеҪ“TзәҝZEN-BSAеҢ…иў«йҮҸдёә1.4 mg/mlпјҢеҠ ж ҮеҗҺжңүжҳҺжҳҫзҡ„жўҜеәҰпјҢж ҮеҮҶе“Ғжө“еәҰвүҘ5.0 ng/mlж—¶пјҢиҜ•зәёжқЎжЈҖжөӢдёәйҳіжҖ§пјӣеҪ“TзәҝDON-BSAеҢ…иў«йҮҸдёә0.8 mg/mlпјҢеҠ ж ҮеҗҺжңүжҳҺжҳҫзҡ„жўҜеәҰпјҢж ҮеҮҶе“Ғжө“еәҰвүҘ100 ng/mlж—¶пјҢиҜ•зәёжқЎжЈҖжөӢдёәйҳіжҖ§гҖӮз”ұжӯӨеҸҜи§ҒAFB1гҖҒZENе’ҢDONиҜ•зәёжқЎзҡ„зҒөж•ҸеәҰдҫқж¬Ўдёә1.0гҖҒ5.0гҖҒ100 ng/mlгҖӮ
2.5дёүиҒ”жЈҖжөӢеҚЎзҡ„иҙЁйҮҸиҜ„д»·
2.5.1ж ·е“ҒжЈҖжөӢйҷҗзҡ„зЎ®е®ҡ
еҰӮиЎЁ2жүҖзӨәпјҢйҳҙжҖ§ж ·е“Ғе°Ҹзұіе’ҢйәҰд»ҒдёӯпјҢAFB1еҠ е…Ҙжө“еәҰдёә2.5 ng/gж—¶пјҢз»“жһңжҳҫзӨәйҳҙжҖ§пјҢиҖҢеҠ е…Ҙ5.0 ng/g еҸҠд»ҘдёҠжө“еәҰж—¶пјҢз»“жһңдёәйҳіжҖ§пјҢиҜҙжҳҺж ·е“ҒжЈҖжөӢйҷҗдёә5.0 ng/gгҖӮеҗҢзҗҶпјҢйҳҙжҖ§ж ·е“ҒзҺүзұізіҒе’ҢеӨ§зұідёӯAFB1зҡ„жЈҖжөӢйҷҗеқҮдёә10 ng/gпјҢиҜҙжҳҺдёҚеҗҢж ·е“ҒдёӯAFB1зҡ„жЈҖжөӢйҷҗдёҚе®Ңе…ЁзӣёеҗҢгҖӮиҖҢеңЁе°ҸзұігҖҒзҺүзұізіҒгҖҒйәҰд»Ғе’ҢеӨ§зұі4з§Қж ·е“ҒдёӯпјҢZENзҡ„жЈҖжөӢйҷҗеқҮдёә60 ng/gпјҢDONзҡ„жЈҖжөӢйҷҗеқҮдёә1 000 ng/gгҖӮжүҖжңүжЈҖжөӢйЎ№зӣ®йҮҚеӨҚ3ж¬ЎиҜ•йӘҢпјҢз»“жһңеқҮдёҖиҮҙпјҢиҜ•йӘҢйҮҚеӨҚжҖ§иҫғеҘҪгҖӮ
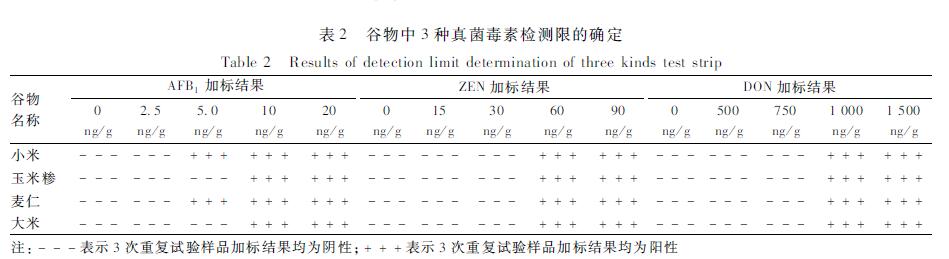
|
иЎЁ2и°·зү©дёӯ3з§ҚзңҹиҸҢжҜ’зҙ жЈҖжөӢйҷҗзҡ„зЎ®е®ҡ Table 2Results of detection limit determination of three kinds test strip |
2.5.2дёҺHPLCжі•жҜ”иҫғ
жЈҖжөӢж ·е“ҒдёӯAFB1гҖҒZENе’ҢDONж—¶пјҢдёӨз§Қж–№жі•з»“жһңеқҮдёҖиҮҙпјҢйҳіжҖ§зҺҮеҲҶеҲ«дёә33.3%пјҲ20/60пјүгҖҒ38.3%пјҲ23/60пјүе’Ң33.3%пјҲ20/60пјүгҖӮ4з§Қж ·е“ҒдёӯпјҢзҺүзұізіҒеҸ—3з§ҚжҜ’зҙ жұЎжҹ“зҡ„жғ…еҶөжңҖдёәдёҘйҮҚпјҢйҳіжҖ§ж ·е“Ғж•°еҲҶеҲ«дёә7д»ҪпјҲAFB1пјүгҖҒ9д»ҪпјҲZENпјүе’Ң7д»ҪпјҲDONпјүпјҢйҳіжҖ§зҺҮдҫқж¬Ўдёә46.7%пјҲ7/15пјүгҖҒ60.0%пјҲ9/15пјүе’Ң46.7%пјҲ7/15пјүпјҢе°ҸзұіеҸ—жұЎжҹ“жғ…еҶөжңҖиҪ»пјҢйҳіжҖ§ж ·е“Ғж•°еҲҶеҲ«дёә4д»ҪпјҲAFB1пјүгҖҒ3д»ҪпјҲZENпјүе’Ң2д»ҪпјҲDONпјүпјҢйҳіжҖ§зҺҮеҲҶеҲ«дёә26.7%пјҲ4/15пјүгҖҒ20.0%пјҲ3/15пјүе’Ң13.3%пјҲ2/15пјүгҖӮз»“жһңи§ҒиЎЁ3гҖӮ
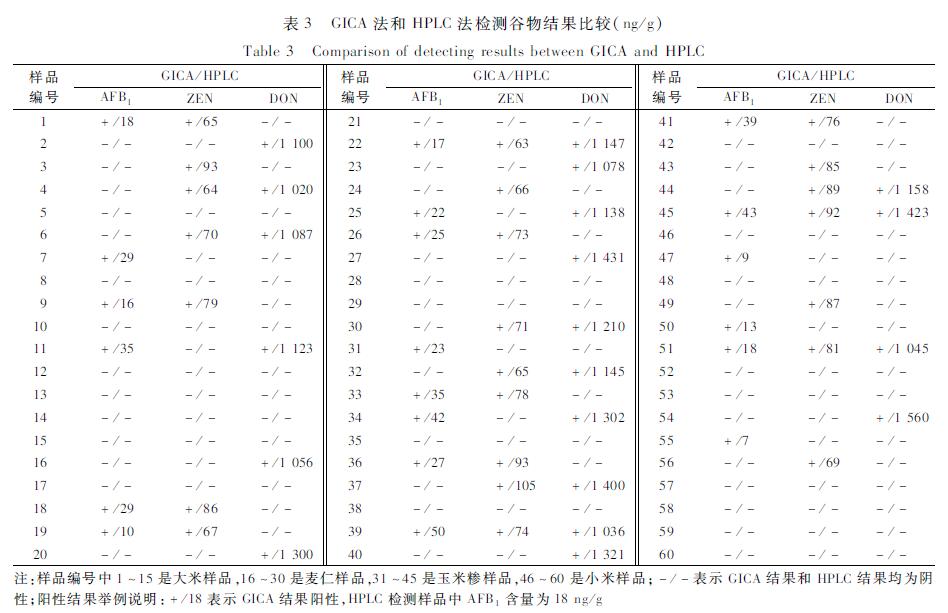
|
иЎЁ3GICAжі•е’ҢHPLCжі•жЈҖжөӢи°·зү©з»“жһңжҜ”иҫғпјҲng/gпјү Table 3Comparison of detecting results between GICA and HPLC |
2.5.3зү№ејӮжҖ§иҜ•йӘҢ
3з§ҚиҜ•зәёжқЎжЈҖжөӢеҗ„иҮӘжө“еәҰе°ҸдәҺзҒөж•ҸеәҰзҡ„ж ҮеҮҶе“Ғж—¶пјҢз»“жһңдёәйҳҙжҖ§пјҢжЈҖжөӢжө“еәҰеӨ§дәҺзӯүдәҺзҒөж•ҸеәҰзҡ„ж ҮеҮҶе“Ғж—¶пјҢз»“жһңдёәйҳіжҖ§пјӣдҪҶжЈҖжөӢжө“еәҰдёә1.0гҖҒ5.0гҖҒ100е’Ң500 ng/mlзҡ„з»“жһ„зұ»дјјзү©еҸҠе…¶д»–йңүиҸҢжҜ’зҙ ж—¶пјҢз»“жһңеқҮдёәйҳҙжҖ§пјҢиЎЁжҳҺиҜ•зәёжқЎзҡ„зү№ејӮжҖ§иҫғеҘҪпјҢ并且3з§ҚзңҹиҸҢжҜ’зҙ д№Ӣй—ҙжІЎжңүдәӨеҸүеҸҚеә”гҖӮз»“жһңи§ҒиЎЁ4гҖӮ
2.5.4зЁіе®ҡжҖ§иҜ•йӘҢ
жЈҖжөӢеҚЎдәҺ37 в„ғжқЎд»¶дёӢдҝқеӯҳ8е‘ЁпјҢжЈҖжөӢйҳҙжҖ§жә¶ж¶ІеқҮдёәдёӨжқЎзәҝпјҲTзәҝе’ҢCзәҝпјүпјҢжЈҖжөӢ100 ng/mlзҡ„ж ҮеҮҶе“ҒеқҮдёәдёҖжқЎзәҝпјҲCзәҝпјүпјҢдё”Tзәҝе’ҢCзәҝжқЎеёҰжё…жҷ°гҖӮеӣ жӯӨж №жҚ®37 в„ғжқЎд»¶дёӢ1 dзӣёеҪ“дәҺе®Өжё©дёӢ1е‘Ёи®Ўз®—пј»16пјҪпјҢжң¬жЈҖжөӢеҚЎеңЁе®Өжё©еҸҜд»Ҙдҝқеӯҳ12дёӘжңҲгҖӮ
3и®Ёи®ә
дёәдәҶиғҪеӨҹеҮҶзЎ®гҖҒеҝ«йҖҹгҖҒз®Җдҫҝзҡ„жЈҖжөӢи°·зү©пјҲе°ҸзұігҖҒзҺүзұізіҒгҖҒйәҰд»Ғе’ҢеӨ§зұіпјүдёӯAFB1гҖҒZENе’ҢDONпјҢжң¬иҜ•йӘҢеә”з”ЁGICAжі•з ”еҲ¶еҮә3з§ҚиҜ•зәёжқЎе№¶з»„иЈ…жҲҗзңҹиҸҢжҜ’зҙ дёүиҒ”жЈҖжөӢеҚЎгҖӮиҜҘеҚЎеңЁжЈҖжөӢж ·е“Ғж—¶пјҢйҖүжӢ©иғҪиҫғеҘҪжә¶и§ЈAFB1гҖҒZENе’ҢDONзҡ„з”ІйҶҮ-PBSзј“еҶІж¶ІпјҲ7вҲ¶3пјҢV/Vпјү
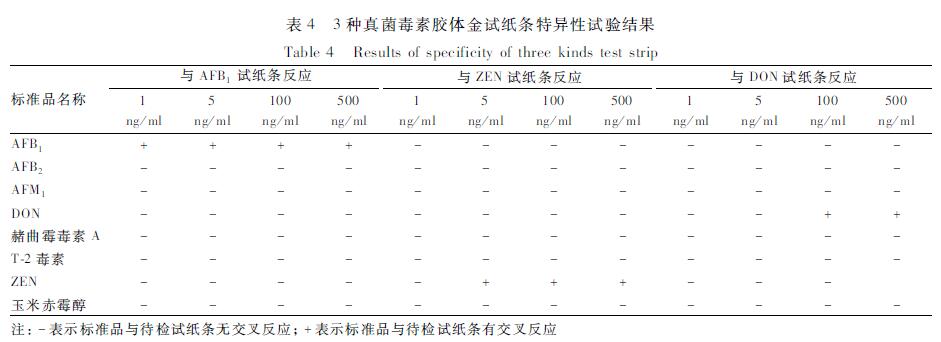
|
иЎЁ43з§ҚзңҹиҸҢжҜ’зҙ иғ¶дҪ“йҮ‘иҜ•зәёжқЎзү№ејӮжҖ§иҜ•йӘҢз»“жһң Table 4Results of specificity of three kinds test strip |
еҸӮиҖғж–ҮзҢ®
пј»1пјҪзҺӢиҗҚ. й»„жӣІйңүжҜ’зҙ е…Қз–«иғ¶д№іеҝ«йҖҹжЈҖжөӢжҠҖжңҜзҡ„з ”з©¶пј»DпјҪ. жӯҰжұүпјҡеҚҺдёӯеҶңдёҡеӨ§еӯҰ, 2007.
пј»2пјҪ马еҫ·е®Ҹ, е‘Ёе…ғеҶӣ. йҘІж–ҷдёӯй»„жӣІйңүжҜ’зҙ зҡ„еҚұе®іеҸҠе…¶жҺ§еҲ¶жҺӘж–Ҫпј»JпјҪ. дёҠжө·з•ңзү§е…ҪеҢ»йҖҡи®Ҝ, 2007пјҲ1пјү: 80-81.
пј»3пјҪMURATA H, SULTANA , SHIMADA N ,et al. Structure-activity relationships among zearalenone and its derivatives based on bovine neutrophil chemiluminescenceпј»JпјҪ. Vet Hum Toxico, 2003, 45(1): 18-20.
пј»4пјҪIKUNAGA Y, SATO I, GROND S, et al. Nocardioides sp. strain WSN05-2, isolated from a wheat field, degrades deoxynivalenol, producing the novel intermediate 3-epi-deoxynivalenolпј»JпјҪ. Applied Microbiology and Biotechnology, 2011, 89(2):419-427.
пј»5пјҪдёӯеҚҺдәәж°‘е…ұе’ҢеӣҪеҚ«з”ҹйғЁ. йЈҹе“Ғе®үе…ЁеӣҪ家ж ҮеҮҶ йЈҹе“ҒдёӯзңҹиҸҢжҜ’зҙ йҷҗйҮҸ:GB 2761вҖ”2011пј»SпјҪ. еҢ—дә¬пјҡдёӯеӣҪж ҮеҮҶеҮәзүҲзӨҫпјҢ2011.
пј»6пјҪзҶҠйҪҗиҚЈ, йҮ‘ж¶Ң, йӮўд»•жӯҢ, зӯү. иғ¶дҪ“йҮ‘иҜ•зәёжқЎжі•еҝ«йҖҹзӯӣжҹҘе°ҸйәҰе’ҢзҺүзұідёӯи„ұж°§йӣӘи…җй•°еҲҖиҸҢзғҜйҶҮзҡ„з ”з©¶пј»JпјҪ. йЈҹе“Ғ科жҠҖ, 2014, 39(2): 292-296.
пј»7пјҪжқҺзҝҳ, жЎ‘дёҪйӣ…, йҷҲ笑笑, зӯү. зҺүзұіиөӨйңүзғҜй…®иғ¶дҪ“йҮ‘еҝ«йҖҹжЈҖжөӢиҜ•еүӮжқҝзҡ„з ”еҲ¶пј»JпјҪ. йЈҹе“Ғе®үе…ЁиҙЁйҮҸжЈҖжөӢеӯҰжҠҘ, 2013, 4(2): 457-462.
пј»8пјҪеҗҙж–Үжҷ”, еҫҗзӮң, жқҺиүі, зӯү. еҗҢж—¶жЈҖжөӢдёӨз§ҚзңҹиҸҢжҜ’зҙ зҡ„иғ¶дҪ“йҮ‘иҜ•зәёжқЎзҡ„з ”еҲ¶пј»JпјҪ. йЈҹе“Ғе·ҘзЁӢ, 2011пјҲ4пјү: 46-49.
пј»9пјҪSUN Q, ZHU Z, DENG Q M, et al. A вҖңgreenвҖқ method to detect aflatoxin B1 residue in plant oil based on a colloidal gold immunochromatographic assayпј»JпјҪ. Analytical Methods, 2015, 8(3): 564-569.
пј»10пјҪBELOGLAZOVA N V, SPERANSKAYA E S, WU A, et al. Novel multiplex fluorescent immunoassays based on quantum dot nanolabels for mycotoxins determinationпј»JпјҪ. Biosensors and Bioelectronics, 2014, 62(6): 59-65.
пј»11пјҪROMANO E L, ROMANO M. Staphylococcal protein a bound to colloidal gold: a useful reagent to label antigen-antibody sites in electron microscopyпј»JпјҪ. Molecular Immunology, 1977, 14(9/10): 711-715.
пј»12пјҪйғ‘иҚЈ, жҜӣдё№, еј йҒ“е№ҝ, зӯү. HPLCжі•жөӢе®ҡеёёз”ЁйЈҹе“ҒдёӯзҺүзұіиөӨйңүзғҜй…®пј»JпјҪ. дёӯеӣҪеҚ«з”ҹжЈҖйӘҢжқӮеҝ—, 2008, 18(11):2266-2267.
пј»13пјҪжҜӣдё№, и®ёеӢҮ, еј йҒ“е№ҝ, зӯү. HPLCжі•жөӢе®ҡзІ®и°·дёӯзҡ„е‘•еҗҗжҜ’зҙ пј»JпјҪ. дёӯеӣҪеҚ«з”ҹжЈҖйӘҢжқӮеҝ—, 2007, 17(12):2207-2208.
пј»14пјҪжқҺиҝҺжў…, еӯҷжҷ“зәў, еҲҳеҪӨ, зӯү. й«ҳж•Ҳж¶Ізӣёжі•жЈҖжөӢйЈҹе“Ғдёӯй»„жӣІйңүжҜ’зҙ еҗ«йҮҸпј»JпјҪ. дёӯеӣҪеҚ«з”ҹж ҮеҮҶз®ЎзҗҶ, 2014, 5(1):93-94.
пј»15пјҪдҪҷдј йң–. зҺ°д»ЈеҢ»еӯҰе…Қз–«еӯҰпј»MпјҪ. дёҠжө·пјҡдёҠжө·еҢ»з§‘еӨ§еӯҰеҮәзүҲзӨҫ, 1998: 725-726.
пј»16пјҪVERHEIJEN R, OSSWALD I K, DIETRICH R, et al. Development of a one step strip test for the detection of (dihydro) streptomycin residues in raw milkпј»JпјҪ. Food and Agricultural Immunology, 2000, 12(1): 31-40.
пј»17пјҪWANG Y, WANG L, ZHANG J, et al. Preparation of colloidal gold immunochromatographic strip for detection of Paragonimiasis skrjabini пј»JпјҪ. PLoS One, 2014, 9(3): e92034.
пј»18пјҪеҫҗеү‘е®ҸпјҢзҘӯиҠіпјҢйҷҶзҗјеЁҙпјҢзӯү. и°·зү©зңҹиҸҢжҜ’зҙ зҡ„жҺ§еҲ¶зӯ–з•Ҙпј»JпјҪ. жұҹиӢҸеҶңдёҡеӯҰжҠҘпјҢ2007пјҢ 23пјҲ6пјүпјҡ 642-646.
пј»2пјҪ马еҫ·е®Ҹ, е‘Ёе…ғеҶӣ. йҘІж–ҷдёӯй»„жӣІйңүжҜ’зҙ зҡ„еҚұе®іеҸҠе…¶жҺ§еҲ¶жҺӘж–Ҫпј»JпјҪ. дёҠжө·з•ңзү§е…ҪеҢ»йҖҡи®Ҝ, 2007пјҲ1пјү: 80-81.
пј»3пјҪMURATA H, SULTANA , SHIMADA N ,et al. Structure-activity relationships among zearalenone and its derivatives based on bovine neutrophil chemiluminescenceпј»JпјҪ. Vet Hum Toxico, 2003, 45(1): 18-20.
пј»4пјҪIKUNAGA Y, SATO I, GROND S, et al. Nocardioides sp. strain WSN05-2, isolated from a wheat field, degrades deoxynivalenol, producing the novel intermediate 3-epi-deoxynivalenolпј»JпјҪ. Applied Microbiology and Biotechnology, 2011, 89(2):419-427.
пј»5пјҪдёӯеҚҺдәәж°‘е…ұе’ҢеӣҪеҚ«з”ҹйғЁ. йЈҹе“Ғе®үе…ЁеӣҪ家ж ҮеҮҶ йЈҹе“ҒдёӯзңҹиҸҢжҜ’зҙ йҷҗйҮҸ:GB 2761вҖ”2011пј»SпјҪ. еҢ—дә¬пјҡдёӯеӣҪж ҮеҮҶеҮәзүҲзӨҫпјҢ2011.
пј»6пјҪзҶҠйҪҗиҚЈ, йҮ‘ж¶Ң, йӮўд»•жӯҢ, зӯү. иғ¶дҪ“йҮ‘иҜ•зәёжқЎжі•еҝ«йҖҹзӯӣжҹҘе°ҸйәҰе’ҢзҺүзұідёӯи„ұж°§йӣӘи…җй•°еҲҖиҸҢзғҜйҶҮзҡ„з ”з©¶пј»JпјҪ. йЈҹе“Ғ科жҠҖ, 2014, 39(2): 292-296.
пј»7пјҪжқҺзҝҳ, жЎ‘дёҪйӣ…, йҷҲ笑笑, зӯү. зҺүзұіиөӨйңүзғҜй…®иғ¶дҪ“йҮ‘еҝ«йҖҹжЈҖжөӢиҜ•еүӮжқҝзҡ„з ”еҲ¶пј»JпјҪ. йЈҹе“Ғе®үе…ЁиҙЁйҮҸжЈҖжөӢеӯҰжҠҘ, 2013, 4(2): 457-462.
пј»8пјҪеҗҙж–Үжҷ”, еҫҗзӮң, жқҺиүі, зӯү. еҗҢж—¶жЈҖжөӢдёӨз§ҚзңҹиҸҢжҜ’зҙ зҡ„иғ¶дҪ“йҮ‘иҜ•зәёжқЎзҡ„з ”еҲ¶пј»JпјҪ. йЈҹе“Ғе·ҘзЁӢ, 2011пјҲ4пјү: 46-49.
пј»9пјҪSUN Q, ZHU Z, DENG Q M, et al. A вҖңgreenвҖқ method to detect aflatoxin B1 residue in plant oil based on a colloidal gold immunochromatographic assayпј»JпјҪ. Analytical Methods, 2015, 8(3): 564-569.
пј»10пјҪBELOGLAZOVA N V, SPERANSKAYA E S, WU A, et al. Novel multiplex fluorescent immunoassays based on quantum dot nanolabels for mycotoxins determinationпј»JпјҪ. Biosensors and Bioelectronics, 2014, 62(6): 59-65.
пј»11пјҪROMANO E L, ROMANO M. Staphylococcal protein a bound to colloidal gold: a useful reagent to label antigen-antibody sites in electron microscopyпј»JпјҪ. Molecular Immunology, 1977, 14(9/10): 711-715.
пј»12пјҪйғ‘иҚЈ, жҜӣдё№, еј йҒ“е№ҝ, зӯү. HPLCжі•жөӢе®ҡеёёз”ЁйЈҹе“ҒдёӯзҺүзұіиөӨйңүзғҜй…®пј»JпјҪ. дёӯеӣҪеҚ«з”ҹжЈҖйӘҢжқӮеҝ—, 2008, 18(11):2266-2267.
пј»13пјҪжҜӣдё№, и®ёеӢҮ, еј йҒ“е№ҝ, зӯү. HPLCжі•жөӢе®ҡзІ®и°·дёӯзҡ„е‘•еҗҗжҜ’зҙ пј»JпјҪ. дёӯеӣҪеҚ«з”ҹжЈҖйӘҢжқӮеҝ—, 2007, 17(12):2207-2208.
пј»14пјҪжқҺиҝҺжў…, еӯҷжҷ“зәў, еҲҳеҪӨ, зӯү. й«ҳж•Ҳж¶Ізӣёжі•жЈҖжөӢйЈҹе“Ғдёӯй»„жӣІйңүжҜ’зҙ еҗ«йҮҸпј»JпјҪ. дёӯеӣҪеҚ«з”ҹж ҮеҮҶз®ЎзҗҶ, 2014, 5(1):93-94.
пј»15пјҪдҪҷдј йң–. зҺ°д»ЈеҢ»еӯҰе…Қз–«еӯҰпј»MпјҪ. дёҠжө·пјҡдёҠжө·еҢ»з§‘еӨ§еӯҰеҮәзүҲзӨҫ, 1998: 725-726.
пј»16пјҪVERHEIJEN R, OSSWALD I K, DIETRICH R, et al. Development of a one step strip test for the detection of (dihydro) streptomycin residues in raw milkпј»JпјҪ. Food and Agricultural Immunology, 2000, 12(1): 31-40.
пј»17пјҪWANG Y, WANG L, ZHANG J, et al. Preparation of colloidal gold immunochromatographic strip for detection of Paragonimiasis skrjabini пј»JпјҪ. PLoS One, 2014, 9(3): e92034.
пј»18пјҪеҫҗеү‘е®ҸпјҢзҘӯиҠіпјҢйҷҶзҗјеЁҙпјҢзӯү. и°·зү©зңҹиҸҢжҜ’зҙ зҡ„жҺ§еҲ¶зӯ–з•Ҙпј»JпјҪ. жұҹиӢҸеҶңдёҡеӯҰжҠҘпјҢ2007пјҢ 23пјҲ6пјүпјҡ 642-646.
 жӣ№еҫ·еә·,иӢҸе»әеҝ ,еј з‘ӣ,з§Ұз’җ,иӢ—银иҗҚ,еҗҙжҷәеқҡ,еј жқ°,иөөжһ—иҗҚ.иғ¶дҪ“йҮ‘е…Қз–«еұӮжһҗжҠҖжңҜеҝ«йҖҹжЈҖжөӢи°·зү©дёӯ3з§ҚзңҹиҸҢжҜ’зҙ зҡ„з ”з©¶[J].дёӯеӣҪйЈҹе“ҒеҚ«з”ҹжқӮеҝ—,2017,29(3):306-312.
жӣ№еҫ·еә·,иӢҸе»әеҝ ,еј з‘ӣ,з§Ұз’җ,иӢ—银иҗҚ,еҗҙжҷәеқҡ,еј жқ°,иөөжһ—иҗҚ.иғ¶дҪ“йҮ‘е…Қз–«еұӮжһҗжҠҖжңҜеҝ«йҖҹжЈҖжөӢи°·зү©дёӯ3з§ҚзңҹиҸҢжҜ’зҙ зҡ„з ”з©¶[J].дёӯеӣҪйЈҹе“ҒеҚ«з”ҹжқӮеҝ—,2017,29(3):306-312.