DOi:10.13590/j.cjfh.2017.03.010
磁性荧光纳米颗粒标记免疫层析技术检测副溶血性弧菌热稳定直接溶血素的试验研究
(1.广州市天河区疾病预防控制中心,广东 广州510655; 2.深圳市易瑞生物技术有限公司,广东 深圳518102)
作者简介: 向辉男副主任技师研究方向为卫生微生物检验与质量控制管理E-mail:tianhecdc@126.com
收稿日期: 2017-02-21
基金项目: 广东省医学科研基金项目(A2013561)
摘要:目的 通过抗体与标记的磁性荧光纳米颗粒相结合的免疫层析技术,建立一种快速检测产热稳定直接溶血素(TDH)副溶血性弧菌的方法。方法 构建产TDH副溶血性弧菌基因片段并进行扩增,扩增产物与质粒载体(pET-28a)连接,并在大肠埃希菌中表达,制备抗体。抗体与标记的磁性荧光纳米颗粒偶联后,制成免疫层析检测试纸条。将混有不同浓度标准菌株样品和阴性对照样品分别与荧光纳米颗粒-单抗偶联物和试纸条共同反应5 min,紫外光下肉眼观察结果。对试验的敏感性、特异性、重复性进行测试并进行样品模拟试验。结果重组质粒载体在大肠埃希菌BL21(DE3)可稳定高效地表达分子量为26 kD的可溶形式的目的蛋白,并实现了单克隆抗体与磁性荧光颗粒很好的偶联,所得偶联物与最低浓度10 CFU/ml阳性菌株反应,阴性对照菌株无反应。结论试验制备的产TDH副溶血性弧菌毒力基因表达产物与磁性荧光纳米颗粒有机结合,检测操作过程简单,具有灵敏度高、特异性强、重复性好和检测时间短等特点。
关键词:
副溶血性弧菌;热稳定直接溶血素;荧光纳米颗粒标记技术;免疫层析;检测
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)03-0302-05
Experimental study of fluorescent magnetic nanoparticles
labeled immunological assay for Vibrio parahaemolyticus thermostable direct heamolysin
labeled immunological assay for Vibrio parahaemolyticus thermostable direct heamolysin
(1.Guangzhou Tianhe Center for Disease Prevention and Control,Guangdong Guangzhou 510655,China; 2.Shenzhen Yirui Biological Technology Company Limited,Guangdong Shenzhen 518102,China)
Abstract:Objective To establish a method for rapid detection of Vibrio parahaemolyticus producing thermostable direct haemolysin (TDH) by immunochromatography technology of the labeled magnetic fluorescent nanoparticles combined with antibody. Methods The gene fragment of Vibrio parahaemolyticus producing TDH was constructed and amplified. The product was ligated with plasmid vector (pET-28a) and expressed in Escherichia coli to prepare antibody. The antibody was conjugated with the labeled magnetic fluorescent nanoparticles to prepare an immunochromatographic test strip. The samples were mixed with different concentrations of standard strain and negative control samples respectively with the fluorescent nanoparticle-monoclonal antibody conjugate, incubated on the strip for 5 min, and observed with naked eyes under UV light.Experimental test was conducted for sensitivity, specificity, reproducibility and sample simulation. Results The recombinant plasmid vector could efficiently and efficiently express the soluble protein with molecular weight of 26 kD in Escherichia coli BL21 (DE3). The monoclonal antibody and the magnetic fluorescent particles were well coupled. The resulting conjugate was reacted with the lowest concentration at 10 CFU/ml positive strain, and the negative control strains had no reaction. Conclusion The magnetic fluorescent nanoparticles coupled with the TDH virulence gene expression product of Vibrio parahaemolyticus was prepared in the experiment.Testing process was simple with high sensitivity, strong specificity, good repeatability and short detection time.
Key words:
Vibrio parahemolyticus; thermostable direct haemolysin; fluorescent nanoparticles labeling technology; immunochromatography; test
副溶血性弧菌(Vibrio parahaemolyticus,VP)是导致食源性疾病的主要病原菌之一,主要分布于水产品尤其是海产品中,是沿海地区引起食物中毒的主要病原菌。其致病因子主要是该菌代谢过程中能分泌多种溶血毒素,如热稳定直接溶血素(thermostable direct hemolysin,TDH)、热不稳定溶血素(thermolabile hemolysin,TLH)和相对热稳定直接溶血素(TDH-related hemolysin,TRH)。研究[1]表明TDH是该菌主要的致病因子。从该菌引起的食源性疾病标本中分离的绝大多数副溶血性弧菌都产TDH。流行病学资料[2]分析该菌可能会成为流行菌株。本试验采用聚合酶链式反应(PCR)扩增TDH基因并克隆至pET-28a-TDH表达载体,使其在大肠埃希菌BL21中高效表达[2],并与磁性荧光纳米颗粒偶联,为建立一种快速检测TDH免疫层析标记技术奠定基础。
异丙基硫代半乳糖苷(IPTG,10902ES60,上海翊圣生物科技有限公司)、蛋白Marker(SM0671,加拿大Fermentas)、Ni2+琼脂糖凝胶(QY-0110-109,上海乔羽)、pET-28a(69864-3,德国EMD Biosdences)、羊抗兔IgG(A9169,美国Sigma),GK2043-50型凝胶回收试剂盒、GK1043型细菌基因组DNA提取试剂盒均购自上海捷瑞生物工程有限公司。
经过诱导的目的菌体蛋白含量明显增加。试验同时还对志贺菌重组质粒载体pET-28a-ipaH经诱导后表达目的蛋白含量进行了比较。试验结果证实相同的质粒载体,经诱导表达后可得到预期的表达目的蛋白,见图1。
由于实际检测样品含有多种干扰物质及杂菌,为了证实此方法的特异性,试验采用神奈川试验阴性的副溶血性弧菌菌株和神奈川试验阳性的菌株以及同一菌属的其他致病性弧菌。金黄色葡萄球菌、O139群霍乱弧菌、非O1群霍乱弧菌、奇异变形杆菌、肠炎沙门菌、单核细胞增生李斯特菌、蜡样芽胞杆菌和志贺菌作为干扰菌进行检测,检测结果表明在杂菌浓度(106~108 CFU/ml)比靶细菌高出许多倍的情况下,阴性对照菌株均无交叉反应。
本课题组采用反相微乳液法,已成功制备同时具有磁性和荧光信号的双功能纳米颗粒,此磁性荧光双功能纳米颗粒由内核的磁性纳米粒子、中间的稀土高分子以及外层的二氧化硅层构成。外面的二氧化硅层极易进一步修饰,可引入各种功能团,连接抗体。通过偶联剂戊二醛和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)连接单克隆抗体,制成具有磁性荧光的免疫纳米复合微球。目前制备的磁性荧光纳米颗粒粒径范围为15~20 nm,颗粒的分散性较好。为了减少联检试纸条不同检测信号间的相互干扰,用铕(III)、铽(III)等不同稀土离子,制备不同发射波长的多色壳核型磁性荧光纳米颗粒。同时,结合时间分辨检测技术,减小背景信号的干扰,大幅度提高信噪比、检测灵敏度和准确性。
到目前为止,国内外针对副溶血性弧菌TDH的检测应用研究,大多数采用的是分子生物学技术,多重PCR、实时PCR、核酸杂交和斑点ELISA等方法[8],利用免疫层析技术的研究不多,鲜有应用分子克隆技术再结合磁性荧光纳米颗粒标记技术用于副溶血性弧菌TDH检测报道。本研究选取副溶血性弧菌特异性的TDH作为检测靶基因,利用PCR技术对TDH基因进行扩增,通过基因克隆技术,再结合磁性荧光纳米颗粒标记技术,灵敏度可达到10 CFU/ml。通过与其他非靶细菌试验验证,结果显示所建立的方法特异性较高,可以从食物中毒样品或标本中分离出致病副溶血性弧菌,同时也检测出产TDH副溶血性弧菌,未检测到不产TDH的副溶血性弧菌或其他致病菌,说明试验具有高度特异性。
此外,还对该方法进行了敏感性试验。对不同种类样品进行敏感性试验,样品中加入产THD的副溶血性弧菌,浓度范围为1~105 CFU/ml,灵敏度比事先研究的食品污染物中产葡萄球菌肠毒素B(SEB)的金黄色葡萄球菌试纸条灵敏度提高了100倍[4]。该技术具有高效、高通量、低成本和速度快等优点。
1材料与方法
1.1材料
1.1.1实验动物
雌性SPF级Balb/c健康小白鼠20只,5~6周龄,雌性健康新西兰大白兔6只,均由南方医科大学实验动物中心提供[许可证号:SCXK(粤)2016-0041]。
1.1.2菌株来源
副溶血性弧菌阳性对照菌(ATCC 17802,广东省疾病预防控制中心),副溶血性弧菌标准菌株(ATCC 17802)、大肠埃希菌(DH5a、BL21)、阴性对照菌株金黄色葡萄球菌(ATCC 25923)、志贺菌(ATCC 12022)、O139群霍乱弧菌(93006)、非O1群霍乱弧菌(CMCCB 17106)、创伤弧菌(ATCC 27562)、河弧菌(ATCC 33809)、溶藻弧菌(ATCC 17749)、奇异变形杆菌(ATCC 29906)、肠炎沙门菌(ATCC 13076)、单核细胞增生李斯特菌(ATCC 19111)、蜡样芽胞杆菌(ATCC 14579)均由广东省微生物菌种保藏中心提供。
1.1.3主要仪器与试剂
Mini Protean 3 Cell型蛋白电泳仪(美国BioRad)、Biophotometer plus核酸蛋白测定仪(德国Eppendorf)、细胞培养箱。异丙基硫代半乳糖苷(IPTG,10902ES60,上海翊圣生物科技有限公司)、蛋白Marker(SM0671,加拿大Fermentas)、Ni2+琼脂糖凝胶(QY-0110-109,上海乔羽)、pET-28a(69864-3,德国EMD Biosdences)、羊抗兔IgG(A9169,美国Sigma),GK2043-50型凝胶回收试剂盒、GK1043型细菌基因组DNA提取试剂盒均购自上海捷瑞生物工程有限公司。
1.2方法
1.2.1TDH引物的设计、目的基因扩增及表达质粒的构建
以5’-ATTGGATCC ATGAAACACCAATATTTTG CA-3’,5’-ATTCTCGAG TTGTTGATGTTTATATTCA AAAAAC-3’,副溶血性弧菌基因组DNA为模板,回收扩增产物。目的基因产物长度为567 bp。通过T4连接酶,将目的基因与表达质粒载体pET-28a连接,在大肠埃希菌BL21中进行表达,并对表达产物进行验证。具体操作步骤按参考文献[3]进行。
1.2.2TDH基因的诱导表达
当重组菌株在LB培养基中生长至吸光度(600 nm)为0.6时,加入IPTG(0.1 mmol/L)诱导,20 ℃诱导2~5 h后收集菌体。加入溶菌酶,冰上放置30 min后,超声破碎制作菌悬液,1 200 r/min离心10 min,12%聚丙烯酰胺凝胶电泳(SDS-PAGE)分析蛋白表达水平,以确定最佳诱导时间。具体操作步骤按参考文献[4]进行。
1.2.3表达蛋白的SDS-PAGE分析
收集重组质粒表达蛋白质上清液,层析柱过滤,收集穿透液,用SDS-PAGE分析蛋白质的结合情况。目的蛋白抗原用Bradford蛋白质测定试剂盒测定蛋白质的浓度。
1.2.4多克隆抗体制备
兔抗血清的制备及抗体效价的测定:将目的表达蛋白加入等体积完全弗氏佐剂(CFA)或不完全弗氏佐剂(IFA),以1.5~2 mg/只免疫剂量多点免疫2只雌性新西兰大白免背部皮下或四只足垫。分别于2、4、8、10周再次加强免疫。另取2只雌性新西兰大白兔,用生理盐水及正常兔血清作对照免疫。取免疫后的兔耳静脉血。酶联免疫吸附测定(ELISA)试剂盒检测其抗体效价。最高稀释倍数(1∶64 000)血清光密度(OD)为0.28。血清抗体的纯化:将ELISA检测的抗体(1∶64 000稀释OD值为0.262),分别用33%和55%硫酸铵沉淀,在ProteinA柱上用0.1 mol/L甘氨酸洗脱透析。抗体于-20 ℃保存备用。
1.2.5单克隆抗体制备及纯化
取小白鼠10只,分成2组,分别于左耳、右耳、左腿、右腿、背中免疫。免疫次数共4次,时间间隔分别为1、10、25和40 d。免疫剂量分别为50和100 μg/只,试验中以磷酸盐缓冲液(PBS)及正常鼠血清作空白对照。采用ELISA测定血清抗体效价。取经聚乙二醇-400(PEG-400)融合后杂交瘤小白鼠脾细胞,HAT培养液培养8 d,将杂交瘤细胞用HT培养液多倍稀释,接种到培养板中,每孔含1~2个细胞,培养8 d,反复筛选阳性克隆细胞。具体操作步骤按参考文献[4]进行。将小白鼠腹水上清液采用50%饱和硫酸铵溶液沉淀。10 000倍稀释测得OD值为0.312。
1.2.6荧光纳米颗粒的研制及TDH免疫层析试纸条的制备
荧光纳米颗粒的制备、磁性纳米颗粒珠功能团的表面修饰和磁性荧光纳米免疫复合微球的制备均由深圳市易瑞生物技术有限公司研制并提供。TDH免疫层析试纸条由聚氯乙烯衬板、样品垫、硝酸纤维素膜和吸收垫组成。用点膜仪在硝酸纤维素膜上按照1 μl/cm的量喷涂由TDH重组质粒表达的多克隆抗体和兔抗鼠IgG,分别作为检测线(T线)和质控线(C线)。另外,双功能磁性纳米颗粒与TDH重组质粒表达的单克隆抗体于反应杯中制备二联复合物,再制作成5 mm宽的荧光免疫层析试纸条。4 ℃干燥保存。具体操作步骤按参考文献[4]进行。
1.2.7样品测试
取1~5 g样品加入生理盐水或PBS缓冲液制成匀浆均质,然后加入不同浓度的产TDH副溶血性弧菌(10~105 CFU/ml)。再加入3 ml含0.5% Tween20的PBS缓冲液,取上清液200 μl再加入适量荧光纳米颗粒-单抗偶联物、40 ℃孵育3 min;插入免疫层析试纸条,继续反应5 min,在自制的小型荧光检测仪紫外光(280~320 nm)下肉眼观察结果。具体操作步骤按参考文献[4]进行。
2结果
2.1重组表达蛋白质浓度测定
选用6个不同浓度(50、100、200、300、400、500 μg/ml)的蛋白质进行测定,对应的平均OD值分别为:0.198、0.425、0.737、1.338、1.578、1.989。以横坐标为蛋白质浓度(x,μg/ml),纵坐标为OD值(y)绘制标准曲线(y=0.004x+0.0106、r2=0.990 4)。测得样品蛋白质OD值为0.478,样品浓度为116.85 μg/ml,由于测前样品采用50倍稀释,最终样品蛋白浓度为5.84 mg/ml。
2.2重组表达蛋白分子量测定
将37 ℃诱导表达的菌体超声破碎后取可溶性表达蛋白(上清)和沉淀。经纯化浓缩后进行SDS-PAGE检测,上清液样品出现一条明显的可溶性特异性蛋白带(分子量26 kD),说明TDH表达蛋白主要存在于上清液中,且蛋白质分子量与预期相符。经过诱导的目的菌体蛋白含量明显增加。试验同时还对志贺菌重组质粒载体pET-28a-ipaH经诱导后表达目的蛋白含量进行了比较。试验结果证实相同的质粒载体,经诱导表达后可得到预期的表达目的蛋白,见图1。
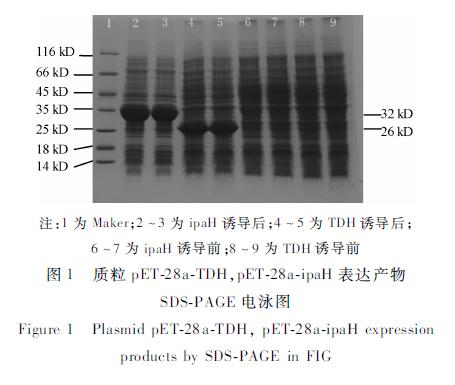
|
注:1为Maker;2~3为ipaH诱导后;4~5为TDH诱导后; 6~7为ipaH诱导前;8~9为TDH诱导前 图1质粒pET-28a-TDH,pET-28a-ipaH表达产物 SDS-PAGE电泳图 Figure 1Plasmid pET-28a-TDH, pET-28a-ipaH expression products by SDS-PAGE in FIG |
2.3双功能磁性纳米标记结果分析
2.3.1特异性试验
由于在纳米颗粒微球表面接入了一个含有6个碳链长的6-氨基正已酸活性基因,纳米颗粒在最合适pH值(7.0~8.0)条件下不需要表面修饰而直接与制备的产TDH副溶血液性弧菌单克隆抗体相结合,制成纳米复合微球。试验使用不同浓度的产TDH阳性的副溶血性弧菌与免疫层析试纸条进行测定并对磁性荧光纳米复合微球所发射的荧光强度与菌体浓度进行测试,结果显示,副溶血性弧菌菌体浓度在10~105 CFU/ml范围内,荧光强度与菌体浓度呈良好的正相关性。具体操作步骤按参考文献[4]进行。由于实际检测样品含有多种干扰物质及杂菌,为了证实此方法的特异性,试验采用神奈川试验阴性的副溶血性弧菌菌株和神奈川试验阳性的菌株以及同一菌属的其他致病性弧菌。金黄色葡萄球菌、O139群霍乱弧菌、非O1群霍乱弧菌、奇异变形杆菌、肠炎沙门菌、单核细胞增生李斯特菌、蜡样芽胞杆菌和志贺菌作为干扰菌进行检测,检测结果表明在杂菌浓度(106~108 CFU/ml)比靶细菌高出许多倍的情况下,阴性对照菌株均无交叉反应。
2.3.2荧光试纸条灵敏度测试
用PBS倍比稀释同一份已知浓度的产TDH副溶血性弧菌阳性样品,菌液浓度分别为1、10、102、103、104、105 CFU/ml,同时用神奈川试验阴性的副溶血性弧菌菌株、金黄色葡萄球菌、志贺菌作阴性对照,阴性对照菌浓度为105~106 CFU/ml,用荧光试纸条进行检测(见表1)。另外,在进行5次重复性试验的过程试验中曾观察到在含1 CFU/ml的阳性菌株管中显示出弱阳性或阴性。非副溶血性弧菌的质控对照检测结果为阴性。156份样品中3份样品为阳性结果,1份来自鱼类,2份来自食物中毒样品。而17份样品检出副溶血性弧菌。
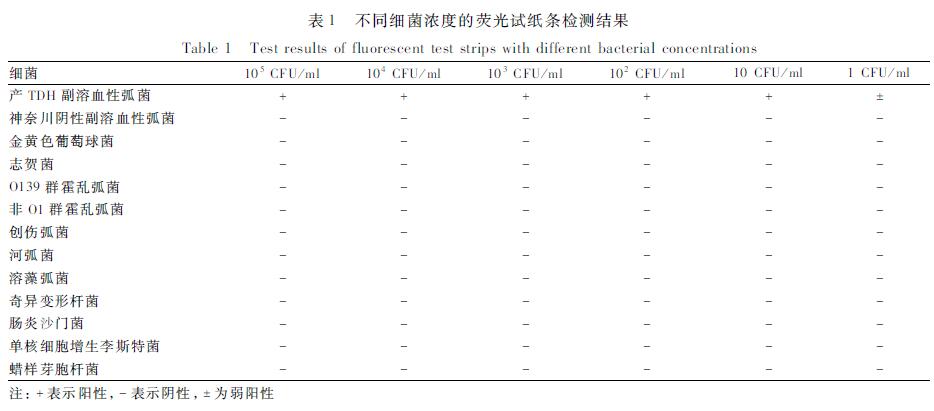
|
表1不同细菌浓度的荧光试纸条检测结果 Table 1Test results of fluorescent test strips with different bacterial concentrations |
2.3.3稳定性试验
将免疫层析试纸条放在室温1、7、14 d存放和2~8 ℃环境条件下保存1、2、3、6、9、12个月,再与不同浓度的阳性样品进行检测,观察其稳定性。试验结果证实,免疫层析试纸条在室温下放置7 d灵敏性没有明显降低,14 d灵敏度下降比较明显;而低温2~8 ℃保存的免疫层析试剂条在12个月内检测灵敏度均没有明显的下降。
3讨论
目前研究[5]认为,副溶血性弧菌的致病因子有溶血毒素(TDH和TRH)、尿素酶、黏附因子和侵袭力,而主要致病因子是该菌产生的TDH。毒力基因检测不仅能判定待检菌株是否为副溶血性弧菌,而且还能判定其是否携带毒力基因而具有致病性,能够为食源性疾病的流行病学调查提供有力的支持。文献[6]显示,从海产品中检出副溶血性弧菌的比例较高,但并不是所有的副溶血性弧菌都携带TDH基因。在所有致病性临床分离株都检测到TDH基因而检测到TRH基因的比例不高,提示TDH毒素基因编码的直接耐热溶血素与该菌的致病性存在高度的相关性。试验从不同来源的156份样品中,检出3份样品产TDH,检出率为1.92%(3/156),而副溶血性弧菌检出率为10.9%(17/156)。BHOOPONG等[7]于2000—2002年证实在海产品中检出的副溶血性弧菌中产毒株仅占5.3%,提示要确定导致发病的菌株和流行株,还应确认患者和食品中分离到的细菌是否具有同样产毒基因型。本课题组采用反相微乳液法,已成功制备同时具有磁性和荧光信号的双功能纳米颗粒,此磁性荧光双功能纳米颗粒由内核的磁性纳米粒子、中间的稀土高分子以及外层的二氧化硅层构成。外面的二氧化硅层极易进一步修饰,可引入各种功能团,连接抗体。通过偶联剂戊二醛和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)连接单克隆抗体,制成具有磁性荧光的免疫纳米复合微球。目前制备的磁性荧光纳米颗粒粒径范围为15~20 nm,颗粒的分散性较好。为了减少联检试纸条不同检测信号间的相互干扰,用铕(III)、铽(III)等不同稀土离子,制备不同发射波长的多色壳核型磁性荧光纳米颗粒。同时,结合时间分辨检测技术,减小背景信号的干扰,大幅度提高信噪比、检测灵敏度和准确性。
到目前为止,国内外针对副溶血性弧菌TDH的检测应用研究,大多数采用的是分子生物学技术,多重PCR、实时PCR、核酸杂交和斑点ELISA等方法[8],利用免疫层析技术的研究不多,鲜有应用分子克隆技术再结合磁性荧光纳米颗粒标记技术用于副溶血性弧菌TDH检测报道。本研究选取副溶血性弧菌特异性的TDH作为检测靶基因,利用PCR技术对TDH基因进行扩增,通过基因克隆技术,再结合磁性荧光纳米颗粒标记技术,灵敏度可达到10 CFU/ml。通过与其他非靶细菌试验验证,结果显示所建立的方法特异性较高,可以从食物中毒样品或标本中分离出致病副溶血性弧菌,同时也检测出产TDH副溶血性弧菌,未检测到不产TDH的副溶血性弧菌或其他致病菌,说明试验具有高度特异性。
此外,还对该方法进行了敏感性试验。对不同种类样品进行敏感性试验,样品中加入产THD的副溶血性弧菌,浓度范围为1~105 CFU/ml,灵敏度比事先研究的食品污染物中产葡萄球菌肠毒素B(SEB)的金黄色葡萄球菌试纸条灵敏度提高了100倍[4]。该技术具有高效、高通量、低成本和速度快等优点。
参考文献
[1]陈洪友,陈敏,盛跃颖,等.副溶血性弧菌食源性疾病暴发分离株的血清型、核糖型及毒力基因研究[J] .中国食品卫生杂志, 2011, 23(2):114-119.
[2]黄培堂.分子克隆实验指南[M].3版.北京:科学出版社,2002:871-942.
[3]向辉,朱海,刘钢,等. 5种食源性致病微生物毒力基因重组质粒的构建、克隆表达与表达产物的研究[J] .华南预防医学, 2014, 40(5):409-415.
[4]向辉,朱海,孙世宏,等.荧光纳米颗粒标记技术在快速检测产enterotoxin B金黄色葡萄球菌方面的应用研究[J] .中国卫生检验杂志, 2015, 25(9):1359-1362.
[5]代敏,王大鹏,陈万义,等.副溶血弧菌临床分离株的血清分型及毒力基因分析[J] .中国食品学报, 2013, 13(2):159-164.
[6]NISHIBUCHI M, KAPER J B. Termostable direct hemolysin gene of Vibrio parahaemolyticus: a virulence gene acquired by a marine bacterium [J].Infect Immun, 1995, 63(6):2093-2099.
[7]BHOOPONG P, PALITTAPONGARNPIM P, POMWISED R, et al. Variability of properties of Vibrio parahaemolyticus strains isolated from individual patients [J].J Clin Microbiol, 2007, 45(5):1544-1550.
[8]李毅,朱心强.副溶血性弧菌及其溶血毒素研究进展[J] .中国卫生检验杂志, 2008, 18(12):2835-2839.
[2]黄培堂.分子克隆实验指南[M].3版.北京:科学出版社,2002:871-942.
[3]向辉,朱海,刘钢,等. 5种食源性致病微生物毒力基因重组质粒的构建、克隆表达与表达产物的研究[J] .华南预防医学, 2014, 40(5):409-415.
[4]向辉,朱海,孙世宏,等.荧光纳米颗粒标记技术在快速检测产enterotoxin B金黄色葡萄球菌方面的应用研究[J] .中国卫生检验杂志, 2015, 25(9):1359-1362.
[5]代敏,王大鹏,陈万义,等.副溶血弧菌临床分离株的血清分型及毒力基因分析[J] .中国食品学报, 2013, 13(2):159-164.
[6]NISHIBUCHI M, KAPER J B. Termostable direct hemolysin gene of Vibrio parahaemolyticus: a virulence gene acquired by a marine bacterium [J].Infect Immun, 1995, 63(6):2093-2099.
[7]BHOOPONG P, PALITTAPONGARNPIM P, POMWISED R, et al. Variability of properties of Vibrio parahaemolyticus strains isolated from individual patients [J].J Clin Microbiol, 2007, 45(5):1544-1550.
[8]李毅,朱心强.副溶血性弧菌及其溶血毒素研究进展[J] .中国卫生检验杂志, 2008, 18(12):2835-2839.
 向辉,朱海,孙世宏,李颖,王西丽,张汉斌,柳勤.磁性荧光纳米颗粒标记免疫层析技术检测副溶血性弧菌热稳定直接溶血素的试验研究[J].中国食品卫生杂志,2017,29(3):302-306.
向辉,朱海,孙世宏,李颖,王西丽,张汉斌,柳勤.磁性荧光纳米颗粒标记免疫层析技术检测副溶血性弧菌热稳定直接溶血素的试验研究[J].中国食品卫生杂志,2017,29(3):302-306.