DOi:10.13590/j.cjfh.2017.03.018
6种食源性致病菌质控考核结果分析
(国家食品安全风险评估中心 卫生部食品安全风险评估重点实验室,北京100021)
作者简介: 韩海红女助理研究员研究方向为食品微生物学和食源性疾病监测E-mail:hanhaihong@cfsa.net.cn
通信作者: 郭云昌男研究员研究方向为食品微生物学和食源性疾病监测E-mail:gych@cfsa.net.cn
收稿日期: 2017-03-01
基金项目: 国家食品安全风险评估中心高层次人才发展“523”项目、公益性行业科研专项(201302005)
摘要:目的 对承担食品安全风险监测任务的全国各级疾病预防控制中心开展微生物质量控制考核,以评价其对6种食源性致病菌的检验能力。方法6种质控考核菌株包括单核细胞增生李斯特菌、蜡样芽胞杆菌、阪崎肠杆菌、大肠埃希菌、沙门菌以及金黄色葡萄球菌。按照2011和2012年设计的组合,将新鲜培养的致病菌增菌液混合后滴加于灭菌奶粉载体中制成样品。2011年考核制备了6种样品(I~VI),2012年为10种样品(A~J)。运用点分数法对两年结果分别进行满意率评价,率的比较用Pearson 2检验或对数似然比 2检验。结果2011和2012年考核总体满意率分别为86.5%(268/310)和84.3%(375/445),2011年样品满意率最低的是空白样品VI(68.0%,17/25),2012年满意率最低的是G样品(0.0%,0/8)。2011和2012年考核结果主要漏检的是大肠埃希菌,其中2012年大肠埃希菌漏检率占漏检总数的85.7%(60/70)。2011年非考核菌中漏检最多的是金黄色葡萄球菌和蜡样芽胞杆菌。2012年考核结果主要多检的是金黄色葡萄球菌,占多检总数的36.8%(7/19)。两年的结果均显示大肠埃希菌和阪崎肠杆菌组合样品中,大肠埃希菌的漏检率明显增高。沙门菌和大肠埃希菌的血清分型正确率较低,分别为41.5%(95/229)和45.1%(105/233)。单核细胞增生李斯特菌易错误鉴别成英诺克李斯特菌,蜡样芽胞杆菌易错误鉴别成蕈状芽胞杆菌,阪崎肠杆菌易错误鉴别成河生肠杆菌。结论80%以上的疾病预防控制中心对6种致病菌的定性检验能力较好,可以满足食品安全风险监测的需求。其中对沙门菌的检验能力最高;金黄色葡萄球菌漏检率较低但易出现多检;大肠埃希菌的检验能力有待提高;阪崎肠杆菌的检验水平较2010年结果有明显提升。
关键词:
单核细胞增生李斯特菌 ,蜡样芽胞杆菌, 阪崎肠杆菌, 大肠埃希菌, 沙门菌, 金黄色葡萄球菌 ,食源性致病菌, 质量控制 ,检测
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)03-0345-06
Analysis on quality control results of six foodborne pathogenic bacteria
(Key Laboratory of Food Safety Risk Assessment of Ministry of Health, China National Center for Food Safety Risk Assessment,Beijing 100021,China)
Abstract: Objective The microbiological quality control test for the centers for disease control and prevention was conducted at the provincial, municipal and county level, and the detection capability against six foodborne pathogenic bacteria was evaluate. MethodsSix bacteria under test were Listeria monocytogenes, Bacillus cereus, Enterobacter sakazakii, Escherichia coli, Salmonella and Staphylococcus aureus. According to the bacterium combination designed in 2011 and 2012, the samples were prepared by adding the fresh blended culture of pathogenic bacteria into radiation-sterilized milk powder carrier. Six samples of I-VI were prepared in 2011 while ten sample of A-J in 2012. The results of qualification were evaluated using the point-score method. The rate of detection was analyzed with Pearson 2 or likelihood ratio 2. ResultsThe overall qualification rate of 2011 and 2012 were 86.5%(268/310)and 84.3%(375/445), respectively. The lowest qualification rate in 2011 was blank sample VI(68.0%,17/25), while the lowest in 2012 was sample G(0.0%,0/8). In both 2011 and 2012, Escherichia coli was the main false negative bacteriumand accounted for 85.7%(60/70)of total false negatives in 2012. The most frequent false positive results among in 2011 were Staphylococcus aureus and Bacillus cereus which were not accounted for the evaluation. In 2012, the highest false positive result was Staphylococcus aureus which accounted for 36.8%(7/19)of the total. In Enterobacter sakazakii and Escherichia coli composite samples of the two years both showed that the false negative rate of Escherichia coli increased significantly. The serotyping accuracy of Salmonella and Escherichia coli were as low as 41.5%(95/229)and 45.1%(105/233), respectively. The false identification occurred on Listeria monocytogenes versus Listeria innocua, Bacillus cereus versus Bacillus mycoides, and Enterobacter sakazakii versus Enterobacter amnigenus. ConclusionMore than 80% of the centers possessed qualified detection capability against six foodborne pathogenic bacteria, which satisfied the requirements of food safety risk surveillance. The highest detection capability was toward Salmonella. Staphylococcus aureus had lower false negative results but was easy to produce false positives. The detection capability of Enterobacter sakazakii had improved significantly comparing with the results of 2010.
Key words:
Listeria monocytogenes; Bacillus cereus; Enterobacter sakazakii; Escherichia coli; Salmonella; Staphylococcus aureus; foodborne pathogens; quality control; detection
《中华人民共和国食品安全法》规定了国家建立食品安全风险监测制度,由国家卫生和计划生育委员会同国务院食品药品监督管理、质量监督等部门,制定和实施国家食品安全风险监测计划[1]。旨在了解我国食品中主要污染物及有害因素的污染水平和趋势,确定危害因素的分布和可能来源,发现食品安全风险隐患,以利于及时采取相应的风险管控和监管措施[2]。国家食品安全风险监测网络覆盖了全国31个省(自治区、直辖市)和新疆生产建设兵团的省级、地(市)级和县(区)级疾病预防控制中心(CDC),细菌检验项目包括单核细胞增生李斯特菌(Listeria monocytogenes,以下简称单增)、蜡样芽胞杆菌(Bacillus cereus,以下简称蜡样)、阪崎肠杆菌(Enterobacter sakazakii,以下简称阪崎)、大肠埃希菌(Escherichia coli,以下简称大肠)、沙门菌(Salmonella,以下简称沙门)、金黄色葡萄球菌(Staphylococcus aureus,以下简称金葡)等6种重要食源性致病菌及其他指示菌和致病菌指标。食品安全风险监测每年通过对各类食品的污染监测,产生数以万计的数据,来反映中国食品安全的现状。对承担国家食品安全风险监测任务的全国31个省(区、市)和新疆生产建设兵团的各级CDC进行检测能力的考核,是督促各级风险监测技术机构提高监测水平的重要方式。2010年的质控考核数据[3]显示,沙门、金葡、大肠和阪崎均有不同程度的漏检现象,本研究在此基础上增加了单增和蜡样两个项目,于2011年和2012年针对全国CDC开展了6种致病菌的质控考核,并对结果进行分析。
2011年考核样为6种。I:单增和阪崎;II:单增和蜡样;III:单增、蜡样和大肠;IV:单增、阪崎和大肠;V:单增、蜡样、阪崎和大肠;VI:空白。
2012年考核样为10种。A:沙门和阪崎;B:阪崎和大肠;C:沙门和金葡;D:沙门和大肠;E:金葡和阪崎;F:金葡和大肠;G:沙门、阪崎和大肠;H:金葡、阪崎和大肠;I:沙门、金葡和大肠;J:沙门、金葡和阪崎。
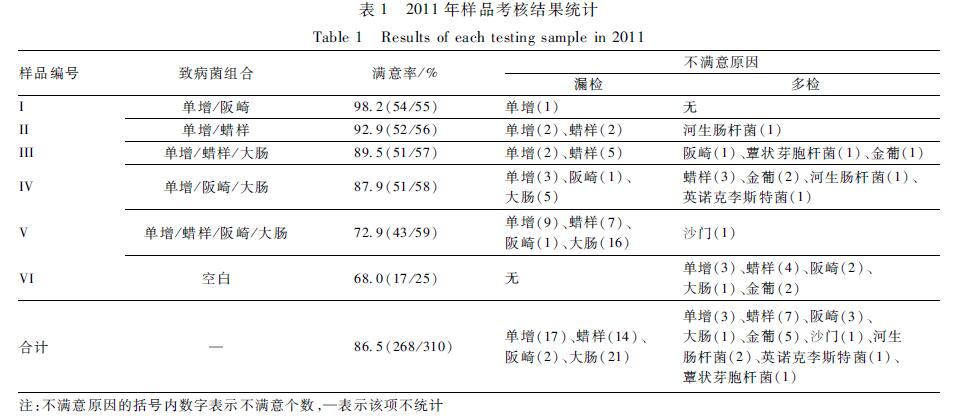
2011年上报检验结果的310个CDC中有257个结果评价为满分。另有53个CDC存在漏检或多检情况,利用点分数法评价,得到11个满意结果,42个不满意结果(数据未显示)。综上,2011年考核共得到268个满意(包括满分)结果,总体满意率为86.5%(268/310)。6个样品的满意率为68.0%~98.2%,其中I样品满意率最高为98.2%(54/55),VI样品满意率最低为68.0%(17/25),见表1。经对数似然比 2检验各个样品的满意率不全相同,差异有统计学意义(P<0.05)。
不满意原因包括漏检和多检。I~V样品不满意的主要原因均是漏检,VI空白样品则是多检。2011年考核样品中有4种漏检情况,由高至低依次为漏检大肠、单增、蜡样和阪崎,其中漏检大肠占漏检总数的38.9%(21/54);有9种多检情况,分别是多检单增、蜡样、阪崎、大肠、金葡、沙门、河生肠杆菌、英诺克李斯特菌和蕈状芽胞杆菌,其中多检蜡样和金葡最多,分别为7和5个,共占多检总数的50.0%(12/24),见表1。
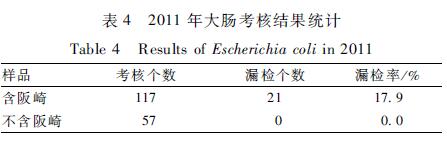
经Pearson 2检验,是否包含阪崎两种情况的大肠漏检率差异有统计学意义(P<0.05)。
2012年上报检验结果的445个CDC中有358个结果评价为满分。另有87个CDC存在漏检或多检情况,利用点分数法评价后,得到17个满意结果,70个不满意结果(数据未显示)。综上,2012年考核共得到375个满意(包括满分)结果,总体满意率为84.3%(375/445)。10个样品的满意率为0.0%~100.0%。其中,2种致病菌组合的样品中,D、F样品的满意率分别为81.5%和81.7%,B样品的满意率最低为60.3%;3种致病菌组合的样品中,I、J样品的满意率最高,均为100.0%,G样品满意率最低为0.0%(见表5),经对数似然比 2检验,各个样品的满意率差异有统计学意义(P<0.05)。
不满意原因包括漏检和多检,2012年考核中的70个不满意结果的主要原因均是漏检。其中,漏检
单增的漏检率为6.0%(17/285),它与英诺克李斯特菌(Listeria innocua)同为李斯特菌属,主要生化反应均相同,所以存在误将单增鉴定为英诺克李斯特菌的情况。英诺克李斯特菌广泛的分布于自然界,如土壤、污水、植被以及粪便,对人和动物均不致病。比较基因组的结果[12]证实,单增和英诺克李斯特菌在遗传学上密切相关。两者的生化特征差别主要表现为单增的β溶血试验为阳性,英诺克李斯特菌为阴性,在和金葡的协同溶血试验(christie-atkins-munch-petersen, CAMP)中,单增为阳性,英诺克李斯特菌为阴性[13]。
蜡样的漏检率为8.1%(14/172),部分漏检原因是将其鉴定为蕈状芽胞杆菌。蜡样有动力,菌落形态表现为不规则、呈波浪形、圆锯齿状的边缘,表面粗糙似毛玻璃状或融蜡状,根据H抗原可以将其分为42个血清型[14]。1998—2008年美国19%的食源性疾病暴发是由蜡样引起的[15]。蕈状芽胞杆菌(Bacillus mycoides)无动力,根状生长试验阳性,其菌落形态表现为典型的根状或发丝状,易蔓延生长覆盖整个琼脂表面[8]。此外,在蜡样考核中还易出现多检,2年共有10个多检结果。
阪崎2011和2012年的漏检率(1.2%和2.2%)明显低于2010年(8.7%)[3]。部分漏检原因是不能和河生肠杆菌(Enterobacter amnigenus)鉴别。阪崎分布在环境或食物中,可能会污染奶粉导致新生儿败血症和脑膜炎[16]。河生肠杆菌主要分布在水体中,也会从呼吸道、伤口或粪便等临床标本中分离到。阪崎于营养琼脂上25 ℃培养时,形成明黄色菌落;37 ℃培养时,形成直径为1~3 mm的淡黄色菌落。河生肠杆菌则为直径2~3 mm的圆形菌落,扁平且边缘不规则[13]。两者的差异还表现为河生肠杆菌对乙酸的利用为阴性,而96%的阪崎为阳性[10]。
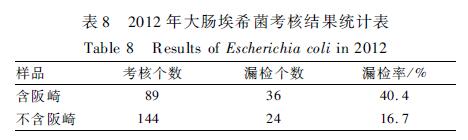
两年数据均显示,大肠的漏检率最高(12.1%和25.8%),尤其是和阪崎组合考核时会大大提高其漏检率(17.9%和40.4%)。大肠与阪崎相比,生化试验的主要区别在于:Voges-Proskauer(V-P)试验、西蒙氏柠檬酸盐、氰化钾(KCN)生长试验、黄色素、纤维二糖、α-甲基-D-葡萄糖胺均为阴性。
大肠也可能被误检为志贺菌,因为两者很难通过生化反应来鉴别,有产气的志贺菌,也有乳糖阴性、不产气、无动力的大肠,志贺菌也可以被认为是新陈代谢不活跃的大肠生物群[13]。大肠O血清分型的正确率也较低(45.1%)。
金葡较易出现多检,2年共有12个多检结果。多检的原因可能是其他考核菌的干扰、检验过程中的外来污染或仿造检验结果等。沙门血清分型正确率(41.5%)较低,这可能是因为部分市县级CDC尚存在血清学试剂配置不到位、血清分型能力欠缺等情况,需加强人员培训。
质控考核或者能力验证是国际的普遍做法,主要用于保证检验活动的有效性和结果的准确性。2013年的世界卫生组织全球食源性感染网络外部质量保证系统(External Quality Assurance System,EQAS)项目包括了8株沙门的血清分型和抗微生物敏感性试验,以及1株未知食源性致病菌鉴定[17]。2013年EQAS结果[17]显示,64%的实验室对7株及以上沙门菌株进行了正确的血清分型,82%的实验室将未知食源性致病菌正确鉴定为不产毒素大肠O157:H16。从2000年开展至今,EQAS考核重点不在于简单的致病菌菌种鉴定,而在于更加深入的血清学分型、抗微生物敏感性,甚至毒素的检测。EQAS无论在考核菌株数量或者考核难度上均大于本次考核,而正确率高于本次考核的结果说明了我国实验室的致病菌检验能力与国际先进实验室间尚存在较大差距。
1材料与方法
1.1材料
1.1.1考核对象
承担2011和2012年全国食源性致病菌风险监测任务的全国31个省(区、市)和新疆生产建设兵团的各级CDC。
1.1.2考核用菌株
2011年考核用菌株:单增(CMCC 54004)、蜡样(6331-17)、阪崎(ATCC 29544)和大肠(EHEC 03820)。2012年考核用菌株:沙门(H9812)、金葡(ATCC 26071)、阪崎(ATCC 29544)和大肠(CMCC 44824)。所有菌株均为卫生部食品安全风险评估重点实验室保藏菌株。
1.2方法
1.2.1无菌食品载体制备
将某品牌幼儿奶粉分装于15 ml无菌离心管中,每管约8 g,共分装500管。用40 kGy辐照灭菌后,随机多点抽样进行无菌试验,经验证可以用做无菌食品载体。
1.2.2样品制备
按照下列设计的组合,将新鲜培养的致病菌增菌液混合,滴加于灭菌食品载体中,制成考核样品,放置于4 ℃冰箱中冷藏保存。2011年考核样为6种。I:单增和阪崎;II:单增和蜡样;III:单增、蜡样和大肠;IV:单增、阪崎和大肠;V:单增、蜡样、阪崎和大肠;VI:空白。
2012年考核样为10种。A:沙门和阪崎;B:阪崎和大肠;C:沙门和金葡;D:沙门和大肠;E:金葡和阪崎;F:金葡和大肠;G:沙门、阪崎和大肠;H:金葡、阪崎和大肠;I:沙门、金葡和大肠;J:沙门、金葡和阪崎。
1.2.3稳定性测试
每种样品随机抽取5份常温放置1个月,用来模拟常温运输和保存的稳定性测试。每种样品分别于制备后抽取3次(样品制备后0 d、1个月和2个月)且随机抽取5份,按照GB 4789.1—2010《食品安全国家标准 食品微生物学检验 总则》[4]、GB 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》[5]、GB/T 4789.6—2003《食品卫生微生物学检验 致泻大肠埃希氏菌检验》[6]、GB 4789.10—2010《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》[7]、GB/T 4789.14—2003《食品卫生微生物学检验 蜡样芽胞杆菌检验》[8]、GB 4789.30—2010《食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验》[9]、GB 4789.40—2010《食品安全国家标准 食品微生物学检验 阪崎肠杆菌检验》[10]等标准方法,对抽取的样品进行检验,以确认其细菌组成。
1.2.4样品的发放
将样品发放至各省级CDC,要求省级CDC于10 d内分发至相应市县级CDC。根据省级和市县级CDC检验能力的差异,2012年采用含3种致病菌组合的G~J样品考核省级CDC,采用含2种致病菌组合的A~F样品考核市县级CDC。2011年和2012年的考核样品在省内CDC均为无序排列,以保证各省间的样品和致病菌均衡分布。
1.2.5检验要求
各级CDC收到样品后应及时放置于4 ℃冰箱保存,并于1个月内检验。样品检验应按照GB 4789系列标准方法进行[4-10]。检验过程中应注意生物安全防护,检验完成后应对样品进行无害化处理。2012年考核样品中的沙门和大肠的血清学分型为选做项目。
1.2.6结果评价
运用点分数法[11]进行满意率评价,即实得点分数大于满分点分数的2/3即判定为满意。其原理是:针对定性分析的4种可能结果分别赋予不同分值,即正确检出赋2分,漏检赋0分,多检1~2种致病菌赋-1分,多检>2种赋-2分。2011年考核的VI样品为空白,设定其满分初始值为2分。率的比较用Pearson 2检验或对数似然比 2检验(Likelihood Ratio),P<0.05为差异有统计学意义。
2结果与分析
2.12011年考核结果
2.1.1总体概况
2011年的考核对象包括31个省级和新疆生产建设兵团的CDC、280个市县级CDC,共计312个。其中310个CDC上报了结果,上报率为99.4%,未上报结果的为1个省级和1个县级CDC。2011年上报检验结果的310个CDC中有257个结果评价为满分。另有53个CDC存在漏检或多检情况,利用点分数法评价,得到11个满意结果,42个不满意结果(数据未显示)。综上,2011年考核共得到268个满意(包括满分)结果,总体满意率为86.5%(268/310)。6个样品的满意率为68.0%~98.2%,其中I样品满意率最高为98.2%(54/55),VI样品满意率最低为68.0%(17/25),见表1。经对数似然比 2检验各个样品的满意率不全相同,差异有统计学意义(P<0.05)。
不满意原因包括漏检和多检。I~V样品不满意的主要原因均是漏检,VI空白样品则是多检。2011年考核样品中有4种漏检情况,由高至低依次为漏检大肠、单增、蜡样和阪崎,其中漏检大肠占漏检总数的38.9%(21/54);有9种多检情况,分别是多检单增、蜡样、阪崎、大肠、金葡、沙门、河生肠杆菌、英诺克李斯特菌和蕈状芽胞杆菌,其中多检蜡样和金葡最多,分别为7和5个,共占多检总数的50.0%(12/24),见表1。
2.1.2各级CDC考核结果的满意率
2011年31个省级CDC的考核结果满意率为96.8%,279个市县级CDC为85.3%,经对数似然比 2检验,两者满意率差异有统计学意义(P<0.05),见表2。
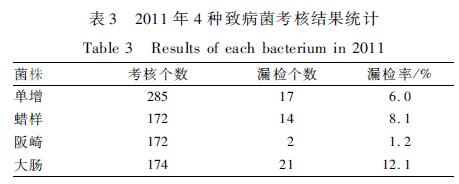
2.1.3考核菌株的漏检率
2011年4种致病菌的漏检率最高的是大肠,为12.1%,其次为蜡样8.1%、单增6.0%,阪崎漏检率最低为1.2%,见表3。经Pearson 2检验,4种致病菌的漏检率差异有统计学意义(P<0.05)。2011年大肠的漏检率按照样品中是否含阪崎分别统计,见表4,可以看出大肠和阪崎组合的样品中,大肠的漏检率明显增高。经Pearson 2检验,是否包含阪崎两种情况的大肠漏检率差异有统计学意义(P<0.05)。
2.22012年考核结果
2.2.1总体概况
2012年的考核对象包括31个省级和新疆生产建设兵团的CDC,424个市县级CDC,共计456个。其中445个CDC上报了结果,上报率为97.6%。省级CDC的上报率为100.0%(31/31),市县级CDC为97.4%(413/424),11个市县级CDC未上报结果。2012年上报检验结果的445个CDC中有358个结果评价为满分。另有87个CDC存在漏检或多检情况,利用点分数法评价后,得到17个满意结果,70个不满意结果(数据未显示)。综上,2012年考核共得到375个满意(包括满分)结果,总体满意率为84.3%(375/445)。10个样品的满意率为0.0%~100.0%。其中,2种致病菌组合的样品中,D、F样品的满意率分别为81.5%和81.7%,B样品的满意率最低为60.3%;3种致病菌组合的样品中,I、J样品的满意率最高,均为100.0%,G样品满意率最低为0.0%(见表5),经对数似然比 2检验,各个样品的满意率差异有统计学意义(P<0.05)。
不满意原因包括漏检和多检,2012年考核中的70个不满意结果的主要原因均是漏检。其中,漏检
|
表12011年样品考核结果统计 Table 1Results of each testing sample in 2011 |

|
表22011年省级和市县级CDC考核结果统计 Table 2Results of provincial versus municipal and prefecture CDC in 2011 |
|
表32011年4种致病菌考核结果统计 Table 3Results of each bacterium in 2011 |
|
表42011年大肠考核结果统计 Table 4Results of Escherichia coli in 2011 |
2.2.2各级CDC的考核结果满意率
2012年按照省级和市县级CDC分类的满意率结果见表6,31个省级CDC满意率为74.2%,413个市县级CDC满意率为85.2%,经Pearson 2检验两者满意率差异有统计学意义(P<0.05),省级CDC的满意率低于市县级CDC。
2.2.3考核菌株的漏检率
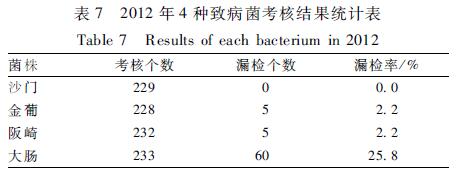
2012年4种致病菌的漏检率最高的也是大肠,为25.8%,其次为阪崎和金葡,漏检率均为2.2%,沙门菌无漏检(见表7)。经Pearson 2检验,4种致病菌的漏检率差异有统计学意义(P<0.05)。

|
表52012年样品考核结果统计表 Table 5Results of each testing sample in 2012 |

|
表62012年省级和市县级CDC考核结果统计表 Table 6Results of provincial versus municipal and prefecture CDC in 2012 |
|
表72012年4种致病菌考核结果统计表 Table 7Results of each bacterium in 2012 |
|
表82012年大肠埃希菌考核结果统计表 Table 8Results of Escherichia coli in 2012 |
2.2.4血清学选做项目
2012年,229个CDC考核沙门,其中95个CDC上报了正确的沙门血清分型,正确率为41.5%(95/229);233个CDC考核大肠,其中105个CDC正确鉴定为肠产毒性大肠O15,O血清分型的正确率为45.1%(105/233)。
3讨论
2011和2012年质控考核总体满意率分别为86.5%(268/310)和84.3%(375/445)。由于参加质控考核的部分CDC在国家食品安全风险监测任务中仅承担采样,不承担致病菌检验工作,本次考核采用一种食品载体添加多种致病菌,相较于单一致病菌检验,考核难度较大,综上,两次考核的满意率(86.5%和84.3%)结果表明多数CDC的6种致病菌定性检验能力良好,可以满足风险监测的需求。2011年满意率最低的是空白样品VI,原因可能是空白样品超出考核预期,部分CDC误以为菌株在运输中死亡或者因操作失误而导致样品无法复苏,而仿照其他实验室结果。2011年省级CDC的满意率(96.8%)高于市县级CDC(85.3%),反映了两级CDC实际检验能力的差别;2012年省级CDC的满意率(74.2%)低于市县级CDC(85.2%),可能是由于考核难度的差异,省级CDC考核3种致病菌组合,而市县级CDC考核2种致病菌组合。单增的漏检率为6.0%(17/285),它与英诺克李斯特菌(Listeria innocua)同为李斯特菌属,主要生化反应均相同,所以存在误将单增鉴定为英诺克李斯特菌的情况。英诺克李斯特菌广泛的分布于自然界,如土壤、污水、植被以及粪便,对人和动物均不致病。比较基因组的结果[12]证实,单增和英诺克李斯特菌在遗传学上密切相关。两者的生化特征差别主要表现为单增的β溶血试验为阳性,英诺克李斯特菌为阴性,在和金葡的协同溶血试验(christie-atkins-munch-petersen, CAMP)中,单增为阳性,英诺克李斯特菌为阴性[13]。
蜡样的漏检率为8.1%(14/172),部分漏检原因是将其鉴定为蕈状芽胞杆菌。蜡样有动力,菌落形态表现为不规则、呈波浪形、圆锯齿状的边缘,表面粗糙似毛玻璃状或融蜡状,根据H抗原可以将其分为42个血清型[14]。1998—2008年美国19%的食源性疾病暴发是由蜡样引起的[15]。蕈状芽胞杆菌(Bacillus mycoides)无动力,根状生长试验阳性,其菌落形态表现为典型的根状或发丝状,易蔓延生长覆盖整个琼脂表面[8]。此外,在蜡样考核中还易出现多检,2年共有10个多检结果。
阪崎2011和2012年的漏检率(1.2%和2.2%)明显低于2010年(8.7%)[3]。部分漏检原因是不能和河生肠杆菌(Enterobacter amnigenus)鉴别。阪崎分布在环境或食物中,可能会污染奶粉导致新生儿败血症和脑膜炎[16]。河生肠杆菌主要分布在水体中,也会从呼吸道、伤口或粪便等临床标本中分离到。阪崎于营养琼脂上25 ℃培养时,形成明黄色菌落;37 ℃培养时,形成直径为1~3 mm的淡黄色菌落。河生肠杆菌则为直径2~3 mm的圆形菌落,扁平且边缘不规则[13]。两者的差异还表现为河生肠杆菌对乙酸的利用为阴性,而96%的阪崎为阳性[10]。
两年数据均显示,大肠的漏检率最高(12.1%和25.8%),尤其是和阪崎组合考核时会大大提高其漏检率(17.9%和40.4%)。大肠与阪崎相比,生化试验的主要区别在于:Voges-Proskauer(V-P)试验、西蒙氏柠檬酸盐、氰化钾(KCN)生长试验、黄色素、纤维二糖、α-甲基-D-葡萄糖胺均为阴性。
大肠也可能被误检为志贺菌,因为两者很难通过生化反应来鉴别,有产气的志贺菌,也有乳糖阴性、不产气、无动力的大肠,志贺菌也可以被认为是新陈代谢不活跃的大肠生物群[13]。大肠O血清分型的正确率也较低(45.1%)。
金葡较易出现多检,2年共有12个多检结果。多检的原因可能是其他考核菌的干扰、检验过程中的外来污染或仿造检验结果等。沙门血清分型正确率(41.5%)较低,这可能是因为部分市县级CDC尚存在血清学试剂配置不到位、血清分型能力欠缺等情况,需加强人员培训。
质控考核或者能力验证是国际的普遍做法,主要用于保证检验活动的有效性和结果的准确性。2013年的世界卫生组织全球食源性感染网络外部质量保证系统(External Quality Assurance System,EQAS)项目包括了8株沙门的血清分型和抗微生物敏感性试验,以及1株未知食源性致病菌鉴定[17]。2013年EQAS结果[17]显示,64%的实验室对7株及以上沙门菌株进行了正确的血清分型,82%的实验室将未知食源性致病菌正确鉴定为不产毒素大肠O157:H16。从2000年开展至今,EQAS考核重点不在于简单的致病菌菌种鉴定,而在于更加深入的血清学分型、抗微生物敏感性,甚至毒素的检测。EQAS无论在考核菌株数量或者考核难度上均大于本次考核,而正确率高于本次考核的结果说明了我国实验室的致病菌检验能力与国际先进实验室间尚存在较大差距。
参考文献
[1]全国人民代表大会常务委员会.中华人民共和国食品安全法[A].2015-04-24.
[2]中华人民共和国国家卫生和计划生育委员会,中华人民共和国工业和信息化部,中华人民共和国商务部,等.关于印发2016年国家食品安全风险监测计划的通知:国卫食品发〔2015〕98号[A].2015-12-30.
[3]韩海红,郭云昌,李宁,等.2010年全国监测网食源性致病菌实验室检验质控考核的结果分析[J].中国食品卫生杂志,2015,27(3):277-282.
[4]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 总则:GB 4789.1—2010[S].北京:中国标准出版社,2010.
[5]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 沙门氏菌检验:GB 4789.4—2010[S].北京:中国标准出版社,2010.
[6]中华人民共和国卫生部,中国国家标准化管理委员会.食品卫生微生物学检验 致泻大肠埃希氏菌检验:GB/T 4789.6—2003[S].北京:中国标准出版社,2003.
[7]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验:GB 4789.10—2010[S].北京:中国标准出版社,2010.
[8]中华人民共和国卫生部,中国国家标准化管理委员会.食品卫生微生物学检验 蜡样芽胞杆菌检验:GB/T 4789.14—2003[S].北京:中国标准出版社,2003.
[9]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验:GB 4789.30—2010[S].北京:中国标准出版社,2010.
[10]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 阪崎肠杆菌检验:GB 4789.40—2010[S].北京:中国标准出版社,2010.
[11]STOYKE M, RADECK W, GOWIK P. Anthelmintics in bovine milk and muscle: interlaboratory studies among EU National Reference Laboratories[J]. Accreditation and Quality Assurance, 2012, 17(4):405-412.
[12]SCHMID M W, NG E Y, LAMPIDIS R, et al. Evolutionary history of the genus Listeria and its virulence genes [J]. Systematic and Applied Microbiology, 2005, 28(1):1-18.
[13]The Bergeys Manual Trust. Bergeys manual of systematic bacteriology [M]. Springer, 2011.
[14]RIPABELLI G, MCLAUCHLIN J, MITHANI V, et al. Epidemiological typing of Bacillus cereus by amplified fragment length polymorphism[J]. Letters in Applied Microbiology, 2000, 30(5):358-363.
[15]BENNETT S D, WALSH K A, GOULD L H. Foodborne disease outbreaks caused by Bacillus cereus, Clostridium perfringens, and Staphylococcus aureus-United States, 1998-2008[J]. Clinical Infectious Diseases, 2013, 57(3):425-433.
[16]IVERSEN C, FORSYTHE S. Risk profile of Enterobacter sakazakii, an emergent pathogen associated with infant milk formula[J]. Trends in Food Science and Technology, 2003, 14(11):443-454.
[17]HENDRIKSEN R S,KARLSMOSE S,JENSEN A B,et al. The external quality assurance system of the who global foodborne infections network year 2013[M].1 edition. National Food Institute, Technical University of Denmark,2014.
[2]中华人民共和国国家卫生和计划生育委员会,中华人民共和国工业和信息化部,中华人民共和国商务部,等.关于印发2016年国家食品安全风险监测计划的通知:国卫食品发〔2015〕98号[A].2015-12-30.
[3]韩海红,郭云昌,李宁,等.2010年全国监测网食源性致病菌实验室检验质控考核的结果分析[J].中国食品卫生杂志,2015,27(3):277-282.
[4]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 总则:GB 4789.1—2010[S].北京:中国标准出版社,2010.
[5]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 沙门氏菌检验:GB 4789.4—2010[S].北京:中国标准出版社,2010.
[6]中华人民共和国卫生部,中国国家标准化管理委员会.食品卫生微生物学检验 致泻大肠埃希氏菌检验:GB/T 4789.6—2003[S].北京:中国标准出版社,2003.
[7]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验:GB 4789.10—2010[S].北京:中国标准出版社,2010.
[8]中华人民共和国卫生部,中国国家标准化管理委员会.食品卫生微生物学检验 蜡样芽胞杆菌检验:GB/T 4789.14—2003[S].北京:中国标准出版社,2003.
[9]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验:GB 4789.30—2010[S].北京:中国标准出版社,2010.
[10]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 阪崎肠杆菌检验:GB 4789.40—2010[S].北京:中国标准出版社,2010.
[11]STOYKE M, RADECK W, GOWIK P. Anthelmintics in bovine milk and muscle: interlaboratory studies among EU National Reference Laboratories[J]. Accreditation and Quality Assurance, 2012, 17(4):405-412.
[12]SCHMID M W, NG E Y, LAMPIDIS R, et al. Evolutionary history of the genus Listeria and its virulence genes [J]. Systematic and Applied Microbiology, 2005, 28(1):1-18.
[13]The Bergeys Manual Trust. Bergeys manual of systematic bacteriology [M]. Springer, 2011.
[14]RIPABELLI G, MCLAUCHLIN J, MITHANI V, et al. Epidemiological typing of Bacillus cereus by amplified fragment length polymorphism[J]. Letters in Applied Microbiology, 2000, 30(5):358-363.
[15]BENNETT S D, WALSH K A, GOULD L H. Foodborne disease outbreaks caused by Bacillus cereus, Clostridium perfringens, and Staphylococcus aureus-United States, 1998-2008[J]. Clinical Infectious Diseases, 2013, 57(3):425-433.
[16]IVERSEN C, FORSYTHE S. Risk profile of Enterobacter sakazakii, an emergent pathogen associated with infant milk formula[J]. Trends in Food Science and Technology, 2003, 14(11):443-454.
[17]HENDRIKSEN R S,KARLSMOSE S,JENSEN A B,et al. The external quality assurance system of the who global foodborne infections network year 2013[M].1 edition. National Food Institute, Technical University of Denmark,2014.
