(1.广东省农业科学院农产品公共监测中心 农业部农产品质量安全检测与评价重点实验室, 广东 广州510640; 2.广州中医药大学临床药理研究所,广东 广州510405; 3.广东省农业科学院 农业部农产品质量安全风险评估实验室(广州),广东 广州510640)
作者简介: 王旭女副研究员研究方向为农产品质量安全风险评估E-mail:wangxuguangzhou@126.com
通信作者: 王富华男研究员研究方向为农产品质量安全与农业标准化E-mail:wfhwqs@163.com
收稿日期: 2017-04-14
基金项目: 广东省科技计划项目(2013B091604005);广东省农业科学院院长基金项目(201318)
(1.Key Laboratory of Testing and Evaluation for Agro-product Safety and Quality, Ministry of Agriculture, Public Monitoring Center for Agro-Product, Guangdong Academy of Agricultural Sciences, Guangdong Guangzhou 510640, China; 2.Department of Immunology, Institute of Clinical Pharmacology, Guangzhou University of Chinese Medicine, Guangdong Guangzhou 510405, China; 3.Laboratory of Quality and Safety Risk Assessment for Agro-products (Guangzhou),Ministry of Agriculture, Guangdong Academy of Agricultural Sciences, Guangdong Guangzhou 510640, China)
为了初步探明有机砷在动物体内的代谢并与无机砷比较,本研究通过大鼠的动物代谢试验,获得大鼠排泄物(粪和尿)、血液、心脏、脑、肝、肺、脾、肾、肌肉等的4种砷含量4 050个数据,以及28 d给药后的肝脏和肾脏的病理分析,比较研究了As(V)、As(III)、MMAV和DMAV在大鼠中的分布、代谢及亚急性毒性效应。
As(V)(Na2HAsO4·7H2O)、DMAV[(CH3)2AsO2Na]均购自美国Sigma,As(III)(NaAsO2)、MMAV(CH3AsO3HNa·1.5H2O)均购自美国Chem Service,总砷参考物质(GBW07602,中国标准物质中心),苏木素染色剂(福建迈新生物公司),丙氨酸氨基转移酶(GPT)、天门冬氨酸氨基转移酶(GOT)、尿素氮(BUN)和肌酐(Gr)、N-乙酰-β-D-氨基葡萄糖苷酶(NAG)试剂盒均购自南京建成生物工程研究所,甲醇(优级纯),氩气、氮气(N2)纯度均≥99.99%。
分别在灌胃1、14、28 d时采集尿、粪、血液,采样当天灌胃后断食8 h,用代谢笼收集尿和粪标本,断食12 h后在内眦静脉丛取血。测定排泄物及血液的4种不同形态的砷和总砷,血清用于测定GPT、GOT、BUN和Gr,尿液用于测定NAG。灌胃28 d后,经过24 h代谢,将大鼠处死,取心脏、脑、肝、肺、脾、肾、肌肉,称重,测定4种不同形态的砷和总砷的含量。肝脏和肾脏做病理切片[24-25]。
GPT、GOT、BUN、Gr、NAG采用试剂盒测定。肝脏和肾脏用蒸馏水洗后吸干水分,用4%的多聚甲醛固定,酒精脱水,包埋,切片,烤片,苏木素染色,脱色,在400倍显微镜下拍照。
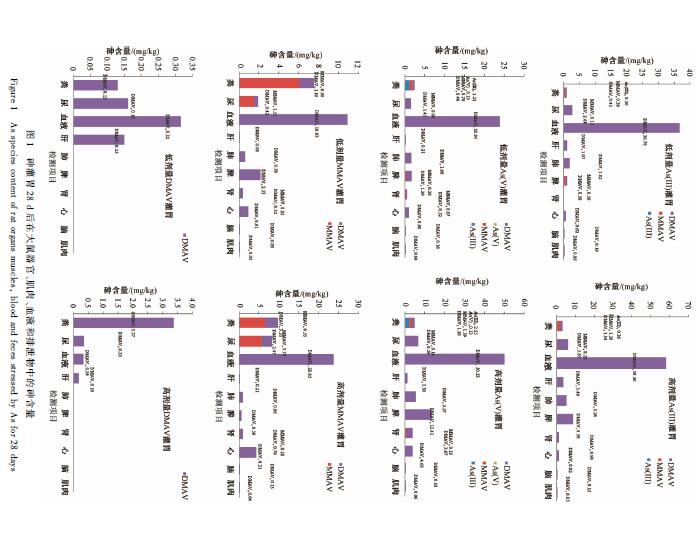
图1。经As(III)、As(V)和MMAV处理的大鼠器官和肌肉中均能检测到DMAV[除低剂量As(III)处理的肾以外],砷主要转化为DMAV保留在大鼠体内。采用As(III)、As(V)和MMAV灌胃处理后的尿液和粪便中均能检测到DMAV和MMAV,不管是保留在体内还是排泄出来,砷在大鼠体内均是甲基化为有机的形态。As(III)处理的大鼠粪便中有As(III),As(V)处理的粪便中有As(III)和As(V),在粪便
|
图1砷灌胃28 d后在大鼠器官、肌肉、血液和排泄物中的砷含量 Figure 1As species content of rat organs muscles, blood and feces stressed by As for 28 days |
|
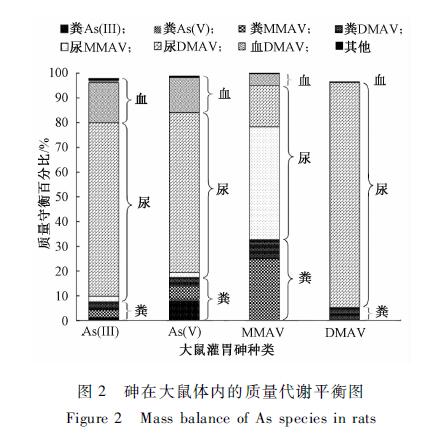
图2砷在大鼠体内的质量代谢平衡图 Figure 2Mass balance of As species in rats |
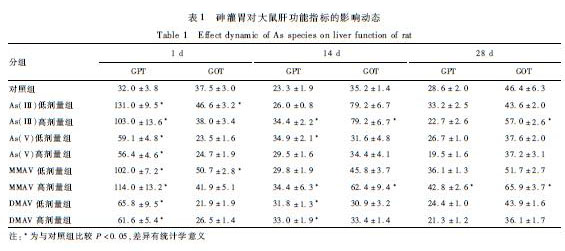
表2为砷的4种形态对大鼠肾脏功能指标的影响。给药1 d后,无论是高剂量还是低剂量的砷处理,BUN、Cr和NAG与对照组比较均差异无统计学意义(P>0.05),均未表现出明显的砷毒性作用。给药14 d后,与对照组比较,As(III)各剂量组、MMAV各剂量组及As(V)低剂量组Cr含量升高,差异有统计学意义(P<0.05),As(III)、As(V)和MMAV均已经不同程度地出现毒性作用,而DMAV没有表现出肾毒性。给药28 d后,与对照组比较,除MMAV高剂量组外,其他形态砷剂量组BUN含量升高差异有统计学意义(P<0.05)。砷的4种形态对大鼠肾脏均表现出积累效应,但是不同形态的砷毒性效应不同,As(III)最先表现出毒性效应且持续积累,其次为MMAV、As(V),DMAV肾毒性最小。
|
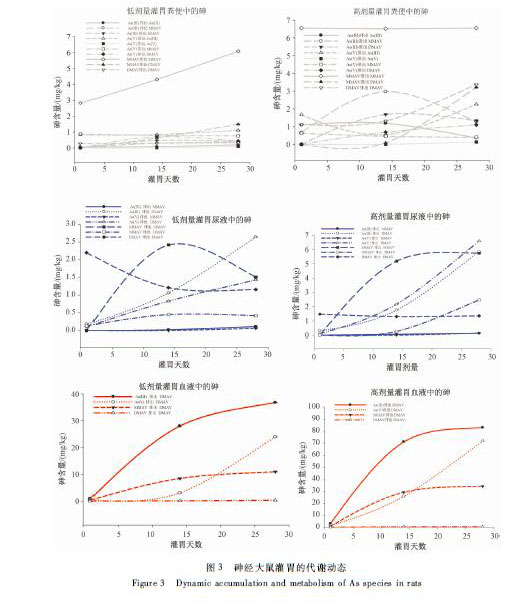
图3砷经大鼠灌胃的代谢动态 Figure 3Dynamic accumulation and metabolism of As species in rats |
|
表1砷灌胃对大鼠肝功能指标的影响动态 Table 1Effect dynamic of As species on liver function of rat 注:*为与对照组比较P<0.05,差异有统计学意义 |

|
表2砷灌胃对大鼠肾功能指标的影响动态 Table 2Effect dynamic of As species on kidney function of rat 注:*为与对照比较P<0.05,差异有统计学意义 |
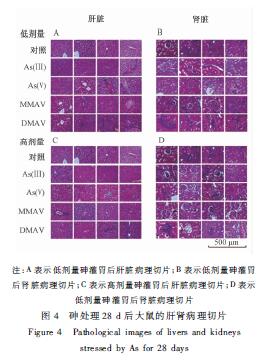
|
注:A表示低剂量砷灌胃后肝脏病理切片;B表示低剂量砷灌胃 后肾脏病理切片;C表示高剂量砷灌胃后肝脏病理切片;D表示 低剂量砷灌胃后肾脏病理切片 图4砷处理28 d后大鼠的肝肾病理切片 Figure 4Pathological images of livers and kidneys stressed by As for 28 days |
[2]MEHARG A A. Arsenic in rice-understanding a new disaster for South-East Asia[J]. Trends In Plant Science, 2004, 9(9): 415-417.
[3]MA L Q, KOMAR K M, TU C, et al. A fern that hyperaccumulates arsenic-A hardy, versatile, fast-growing plant helps to remove arsenic from contamination of soils[J]. Nature, 2001, 409(6820): 579.
[4]NACHMAN K E, BARON P A, RABER G, et al. Roxarsone, inorganic arsenic, and other arsenic species in chicken: a U.S.-based market basket sample[J]. Environmental Health Perspectives, 2013, 121(7): 818-824.
[5]HERNNDEZ-ZAVALA A, VALENZUELA O L, MATOU SEK T, et al. Speciation of arsenic in exfoliated urinary bladder epithelial cells from individuals exposed to arsenic in drinking water[J]. Environmental Health Perspectives, 2008, 116(12): 1656-1660.
[6]BIENERT G P, THORSEN M, SCHUSSLER M D, et al. A subgroup of plant aquaporins facilitate the bi-directional diffusion of As(OH)3 and Sb(OH)3 across membranes[J]. BMC Biology, 2008, 6(1): 26.
[7]WHO. Evaluation of certain food additives and contaminants. Thiry-third report of the joint faoiwho expert committee on food additives. (technical report seriess, No 776)[Z]. Geneva:World Health Organization.
[8]ENGSTROM K S, VAHTER M, FLETCHER T, et al. Genetic variation in arsenic (+3 oxidation state) methyltransferase (AS3MT), arsenic metabolism and risk of basal cell carcinoma in a European population[J]. Environmental and Molecular Mutagenesis, 2015, 56(1):60-69.
[9]PIERCE B L, TONG L, ARGOS M, et al. Arsenic metabolism efficiency has a causal role in arsenic toxicity: mendelian randomization and gene-environment interaction[J]. International Journal of Epidemiology, 2013, 42(6): 1862-1871.
[10]MARTIN E,GONZALEZ-HORTA C, RAGER J, et al. Metabolomic characteristics of arsenic-associated diabetes in a prospective cohort in Chihuahua, Mexico[J]. Toxicological Sciences: an Official Journal of the Society of Toxicology, 2015, 144(2): 338-346.
[11]CURRIER J M, ISHIDA M C, GONZLEZ-HORTA C, et al. Associations between arsenic species in exfoliated urothelial cells and prevalence of diabetes among residents of Chihuahua, Mexico[J]. Environmental Health Perspectives, 2014, 122(10): 1088-1094.
[12]BENBRAHIM-TALLAA L, WAALKES M P. Inorganic arsenic and human prostate cancer[J]. Environmental Health Perspectives, 2008, 116(2): 158-164.
[13]LU K, ABO R P, SCHLIEPER K A, et al. Arsenic exposure perturbs the gut microbiome and its metabolic profile in mice: an integrated metagenomics and metabolomics analysis[J]. Environmental Health Perspectives, 2014, 122(3): 284-291.
[14]VAHTER M. Mechanisms of arsenic biotransformation[J]. Toxicology, 2002, 181-182: 211-217.
[15]MELAK D, FERRECCIO C, KALMAN D, et al. Arsenic methylation and lung and bladder cancer in a case-control study in northern Chile[J]. Toxicology and Applied Pharmacology, 2014, 274(2): 225-231.
[16]SCHLEBUSCH C M, LEWIS JR C M, VAHTER M, et al. Possible positive selection for an arsenic-protective haplotype in humans[J]. Environmental Health Perspectives, 2013, 121(1): 53-58.
[17]KOZUL C D, ELY K H, ENELOW R I, et al. Low-dose arsenic compromises the immune response to influenza A infection in vivo[J]. Environmental Health Perspectives,2009, 117(9):1441-1447.
[18]YU Z M, DUMMER T J, ADAMS A, et al. Relationship between drinking water and toenail arsenic concentrations among a cohort of Nova Scotians[J]. Journal of Exposure Science and Environmental Epidemiology, 2014, 24(2):135-144.
[19]KALMAN D A,DILLS R L,STEINMAUS C,et al. Occurrence of trivalent monomethyl arsenic and other urinary arsenic species in a highly exposed juvenile population in Bangladesh[J]. Journal of Exposure Science and Environmental Epidemiology, 2014, 24(2): 113-120.
[20]APOSHIAN H V. Enzymatic methylation of arsenic species and other new approaches to arsenic toxicity[J]. Annual Review of Pharmacology and Toxicology, 1997, 37: 397-419.
[21]SHEARER J J, WOLD E A, UMBAUGH C S, et al. Inorganic arsenic related changes in the stromal tumor microenvironment in a prostate cancer cell-conditioned media model[J]. Environmental Health Perspectives, 2015, 124(7):1009-1015.
[22]MARSIT C J. Influence of environmental exposure on human epigenetic regulation[J]. The Journal of Experimental Biology, 2015, 218(1): 71-79.
[23]钟格梅,唐振柱. 我国环境中镉、铅、砷污染及其对暴露人群健康影响的研究进展[J]. 环境与健康杂志, 2006, 23(6): 562-565.
[24]张娟,刘启德,汤毅珊. 雄黄中砷对大鼠肝肾功能的影响[J]. 广州中医药大学学报, 2010, 27(4): 375-383.
[25]汤毅珊,王宁生, 宓穗卿, 等. 雄黄中的砷及其代谢物在大鼠体内的排泄动力学研究[J]. 中药药理与临床, 2009, 25(3): 39-42.
[26]ABEDIN M J, FELDMANN J, MEHARG A A. Uptake kinetics of arsenic species in rice plants[J]. Plant Physiology, 2002, 128(3): 1120-1128.
[27]吕超,刘丽萍,董慧茹,等. 高效液相色谱-电感耦合等离子体质谱联用技术测定水产类膳食中5种砷形态的方法研究[J]. 分析测试学报,2010, 29(5):465-468.
[28]王旭,李娜,耿安静,等. 高效液相色谱-电感耦合等离子体质谱联用技术测定海产品中5种形态砷[J]. 南方水产科学,2013, 9(2):50-56.
[29]DAVIS M A,LI Z,GILBERT-DIAMOND D,et al. Infant toenails as a biomarker of in utero arsenic exposure[J]. Journal of Exposure Science and Environmental Epidemiology, 2014, 24(5): 467-473.
[30]SHEN S, LI X F, CULLEN W R, et al. Arsenic binding to proteins[J]. Chemical Reviews, 2013, 113(10), 7769-7792.
 王旭,董燕,耿安静,易浪,文典,李汉敏,赵亚荣,王富华.4种形态砷在大鼠体内的药物动力学及亚急性毒性比较研究[J].中国食品卫生杂志,2017,29(4):400-406.
王旭,董燕,耿安静,易浪,文典,李汉敏,赵亚荣,王富华.4种形态砷在大鼠体内的药物动力学及亚急性毒性比较研究[J].中国食品卫生杂志,2017,29(4):400-406.