DOi:DOI:10.13590/j.cjfh.2017.05.004
2011—2016年石家庄市40株食物中毒沙门菌的耐药特征及分子分型结果分析
(1.白求恩国际和平医院传染肝病科,河北 石家庄 050082; 2.石家庄市疾病预防控制中心微生物检验所,河北 石家庄 050011)
通信作者:牛莉娅 女 主治医师 研究方向为感染性疾病的临床诊治 E-mail:83040073@qq.com
郭玉梅 女 主管技师 研究方向为病原菌分子分型与耐药 E-mail:guokexin2199@163.com
收稿日期:2017-05-15
基金项目:河北省卫生计生委2017年度医学科学研究重点课题(20170964)
摘要:目的 研究食物中毒沙门菌分离株的分子生物学特征,结合耐药表型,分析菌株间的同源性及耐药关系,为预防控制食源性疾病发生和临床治疗提供科学依据。方法 对分离自2011—2016年石家庄市食物中毒食品或标本的40株沙门菌进行药敏检测,并采用脉冲场凝胶电泳(PFGE)进行分子分型,运用BioNumeries软件分析菌株之间的流行病学关系。结果 40株食源性沙门菌经Xba I酶切可分为11种带型,药敏结果呈现多重耐药趋势。结论 石家庄市食源性沙门菌呈高度散发、多重耐药的特点,特别是优势血清型肠炎沙门菌耐药性较明显,提示应加强沙门菌耐药性监测。
关键词:
食物中毒; 沙门菌; 血清型; 耐药; 脉冲场凝胶电泳; 石家庄
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)05-0539-05
Characterization of antimicrobial resistances and molecular characteristics of 40 strains of
Salmonella from food poisoning in Shijiazhuang in 2011-2016
Salmonella from food poisoning in Shijiazhuang in 2011-2016
(1.Department of Infectious and Liver Disease, Bethune International Peace Hospital,Hebei Shijiazhuang 050082,China; 2.Shijiazhuang Center for Disease Control and Prevention,Hebei Shijiazhuang 050011,China)
Abstract:Abstract: Objective To study the molecular biological characteristics of food poisoning Salmonella isolates, and analyze the homology and resistance relationship between strains, which could provide scientific basis for prevention and control of foodborne disease and clinical treatment. Methods Totally 40 strains of Salmonella isolates were tested for susceptibility and molecular typing by pulsed field electrophoresis (PFGE). BioNumeries software was used to analyze the epidemiological relationships between strains. Results All the strains could be divided into 11 types by Xba I enzyme digestion, and drug sensitivity showed multiple drug resistance. Conclusion Foodborne Salmonella was highly sporadic and multidrug resistant was found in this region. The resistance of Salmonella was obvious, especially predominance serum enteritis, which suggested that it was necessary to strengthen the surveillance of Salmonella resistance.
Key words:
Key words: Food poisoning; Salmonella; serotype; drug resistance; pulsed field electrophoresis; Shijiazhuang
沙门菌是世界范围内最重要的食源致病菌之一[1-2],也是我国食源性疾病的主要病原体之一[3]。据统计,石家庄地区细菌性食物中毒事件中,沙门菌占第三位[4],且自2010年来有增多的趋势,呈聚集性暴发[5]。沙门菌感染至今尚无可靠有效的疫苗可以预防,对重症患者的治疗主要依靠抗菌药物。但近年来由于抗菌药物的不合理使用,沙门菌出现了多重耐药现象。有监测数据[6]显示,沙门菌属的多重耐药率已从20世纪90年代的20%增加到本世纪初的70%,并出现对喹诺酮类[7-10]及三代头孢[8,10-11]耐药的现象,致使临床治疗中抗生素的用药量和种类增多、疗程增加,增加了病人的经济负担,因此掌握和分析沙门菌的流行病学特征和耐药性规律,对临床抗感染治疗及公共卫生监控有重要意义。本研究对2011—2016年石家庄市引起感染性腹泻病例的沙门菌,进行抗菌药物敏感性分析以及脉冲场凝胶电泳(PFGE)分型研究。
注:耐药结果中黑色表示耐药,灰色表示中介;
1 材料与方法
1.1 材料
1.1.1 菌株来源
收集2011—2016年石家庄市辖区内13起食物中毒食品样品或标本中检测到的40株沙门菌,其中12株来源于中毒食品,28株来源于中毒患者吐泻物。采集菌株时已进行了血清分型,经统计,40株沙门菌共分7个血清型,其中肠炎沙门菌17株、胥瓦增格隆沙门菌10株、都柏林沙门菌4株、乙型副伤寒沙门菌3株、圣保罗沙门菌3株、鼠伤寒沙门菌2株、依麦克沙门菌1株。PFGE试验用分子量标准对照菌株为沙门菌H9812,由中国疾病预防控制中心传染病预防控制所提供。
1.1.2 主要仪器与试剂
BD phoenix 100全自动细菌鉴定/药敏系统(美国BD),旋转式恒温振荡器,CHEF MAPPER脉冲场凝胶电泳仪、GELXR凝胶成像仪均购自美国Bio-Rad。SeaKem Gold琼脂糖(美国Cambrex),Xba I核酸内切酶、蛋白酶K均购自日本Takara。
1.2 方法
1.2.1 PFGE
参考国际食源性监测网(PulseNet)的标准PFGE方法[12],用限制性内切酶Xba I酶切细菌基因组。 挑取脑心浸液琼脂平板纯培养后的新鲜单个菌落,无菌操作悬浮于2 ml细胞悬浊液(CSB)中,调整比浊值为4.0~4.5个麦氏单位,取200 μl细菌悬浊液加入10 μl蛋白酶K(20 mg/ml)混匀,加入200 μl提前预热好的1% SeaKem Gold琼脂糖和1%十二烷基硫酸钠溶液,混匀后取200 μl加入模具。胶块凝固后,放入5 ml含有25 μl蛋白酶K(20 mg/ml)的细胞裂解液(CLB)中,54 ℃水浴摇床,160 r/min孵育2 h。用15 ml提前预热至50 ℃的灭菌纯水洗胶块2次,每次10 min,再用15 ml提前预热至50 ℃的TE缓冲液洗胶块3次,每次15 min。用刀片将琼脂模块切成3 mm左右的胶块,浸入200 μl Xba I酶切缓冲液中,37 ℃缓冲10 min,吸出酶切缓冲液,加入200 μl 40 U的Xba I 酶切液,37 ℃酶切3 h。将酶切后的胶块粘在梳子上制胶,放入PFGE仪上电泳。电泳参数为:初始脉冲时间2.16 s,最终脉冲时间63.8 s,电压6.0 V/cm,电场夹角120°,电泳时间18 h,温度14 ℃。电泳结束后,将胶块放入1 μg/ml溴化乙啶中染色30 min,用纯水脱色1 h,在凝胶成像分析系统中读胶成像。获得的PFGE图像应用BioNumerics (Version7.6) 数据库软件处理,识别图像条带。根据每两个图像之间的相似系数,用非加权配对算数平均法(UPGMA)进行聚类,条带位置差异容许度(position tolerance)选择0.85%,优化值(optimization)选择1.50%,对分型图谱进行分析,绘出聚类分析图。
1.2.2 药敏试验
应用细菌鉴定/药敏系统进行药敏试验,20种抗生素包括阿米卡星(AMK)、庆大霉素(GEN)、亚胺培南(IPM)、美罗培南(MEM)、头孢唑林(CFZ)、头孢他啶(CAZ)、头孢噻肟(CTX)、头孢吡肟(FEP)、氨曲南(ATM)、氨苄西林(AMP)、哌拉西林(PRL)、阿莫西林-克拉维酸(AMC)、氨苄西林-舒巴坦(SAM)、哌拉西林-他唑巴坦(TZP)、多粘菌素(CT)、复方新诺明(SXT)、氯霉素(C)、环丙沙星(CIP)、左氧氟沙星(LEV)、四环素(TE)。
2 结果
2.1 PFGE结果
聚类分析结果显示,40株沙门菌分为6个簇共11个带型,菌株间相似性100%视为同一PFGE带型,见图1。同一血清型可出现不同的PFGE带型:肠炎沙门菌、都柏林沙门菌均有不同的PFGE带型。而不同血清型可出现相同的PFGE带型:2株肠炎沙门菌和1株都柏林沙门菌PFGE带型相同,1株依麦克沙门菌和3株乙型副伤寒沙门菌PFGE带型相同,8株肠炎沙门菌和2株鼠伤寒沙门菌PFGE带型相同。 根据聚类结果发现,其中4起分别由胥瓦增格隆沙门菌、乙型副伤寒沙门菌、肠炎沙门菌和圣保罗沙门菌引起的食物中毒资料分析显示,1个月内出现3株以上PFGE带型和血清型均相同的沙门菌,符合同一起暴发的一般规律。同一起食物中毒事件中,分别从患者标本及食品中分离出相同PFGE带型的菌株,例如2012年4月和2012年5月的肠炎沙门菌、2011年9月的鼠伤寒沙门菌、2012年5月的圣保罗沙门菌、2011年4月的都柏林沙门菌,提示该次食物中毒事件的传染源可确定。发生在不同行政区、不同时间段的3起食物中毒事件,分离出不同血清型的菌株,分别为2012年4月和2012年5月的肠炎沙门菌以及2011年9月的鼠伤寒沙门菌,但3株菌株出现了相同的PFGE带型,提示这些菌株的来源很有可能是相同的,流行病学调查研究应高度重视。注:耐药结果中黑色表示耐药,灰色表示中介;
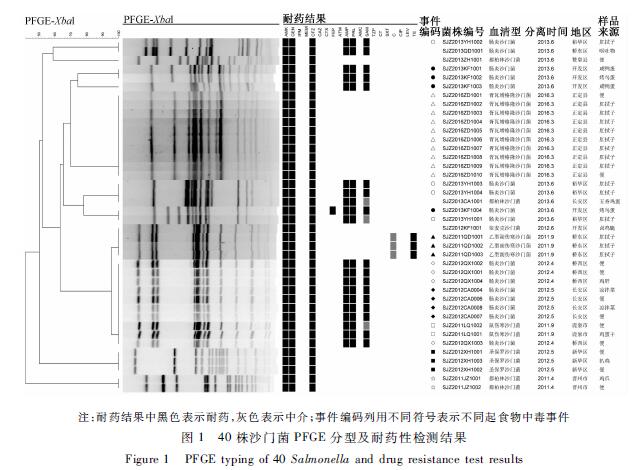
|
图1 40株沙门菌PFGE分型及耐药性检测结果 Figure 1 PFGE typing of 40 Salmonella and drug resistance test results |
2.2 药敏结果分析
2.2.1 各抗生素耐药率
事件编码列用不同符号表示不同起食物中毒事件本研究中的40株致病沙门菌药敏试验中,AMK、GEN、CFZ的耐药率均高达100.0%(40/40);其次为AMP和PRL,耐药率均为50.0%(20/40);其他抗生素耐药率依次为SAM(42.5%,17/40)、TE(7.5%,3/40)、FEP(2.5%,1/40);其中IPM、MEM、CAZ、CTX、ATM、AMC、TZP、CT、SXT、C、CIP、LEV均为未见耐药菌株,见图1。
2.2.2 不同血清型药敏结果
本研究中,所有食源性沙门菌均为多重耐药菌株,即对3类及3类以上抗生素耐药,均对AMK、GEN和CFZ耐药。其中优势血清型肠炎沙门菌耐药情况尤为严重,还对AMP、PRL和SAM这3种抗生素耐药;乙型副伤寒沙门菌还对TE耐药,对C为中介;胥瓦增格隆沙门菌、圣保罗沙门菌、依麦克沙门菌均只对AMK、GEN和CFZ耐药。本研究发现,同一起食物中毒事件的相同血清型中,也会出现不同的耐药谱型,如2013年6月在开发区检测到的4株肠炎沙门菌,其中菌株SJZ2013KF1004与其他菌株耐药谱存在差异。
2.3 沙门菌PFGE及耐药谱型结果比较
40株沙门菌分为6个簇,从上至下依次标记为A~F簇,将PFGE型别与耐药谱进行比较,所有菌株均呈多重耐药,见图1。除E簇和F簇外,其余分子簇间菌株的耐药表型谱均不相同。40株沙门菌耐药检测结果共分为5种耐药谱型,其中相同耐药谱的菌株,聚类结果可显示为多种不同来源。相同的PFGE带型菌株中也可以出现不同的耐药谱,例如依麦克沙门菌SJZ2012KF1001与相同PFGE带型其他菌株间耐药谱不同,同一PFGE带型的肠炎沙门菌SJZ2013KF1004与SJZ2013YH1001耐药谱不同。
3 讨论
根据《中华人民共和国传染病防治法》[13]的规定,由沙门菌引发的感染性腹泻属于丙类传染病管理,单纯胃肠炎型一般不需应用抗生素治疗,因为应用抗菌药物不能改变病程,反而易促使肠道耐药菌株产生,使排菌时间延长。但重症患者、老人、婴幼儿、营养不良患者或类伤寒型、败血症型、局部化脓感染型或伴有并发症者,则必须应用抗生素治疗。临床治疗沙门菌的主要药物包括喹诺酮类、三代头孢、C以及SXT等。 药敏结果显示,石家庄市致病沙门菌多重耐药现象普遍,AMK、GEN、CFZ的耐药率均为100.0%(40/40)。优势血清型肠炎沙门菌呈现出更高耐药和多重耐药趋势,除上述3种抗生素外,还对AMP、PRL、SAM耐药,并出现了1株FEP耐药株,提示石家庄市沙门菌的耐药形势严峻,抗生素的规范应用刻不容缓。不同的血清型耐药谱不同,耐药谱与血清型相关,但有时也存在差异,临床医师应做到逢泻必检,及早发现病原菌,根据药敏结果选用抗菌药物,减少耐药菌株的产生。与既往石家庄市沙门菌耐药监测结果[14]不同,本研究中喹诺酮类(CIP、LEV)和SXT尚无耐药菌株出现,可能与其使用率的下降有关。建议进一步加强对沙门菌临床主动监测及耐药性研究,掌握其变迁趋势,选择敏感药物,为控制沙门菌病暴发和流行及临床用药提供科学依据。 经查阅文献[11,15-20]发现,沙门菌的血清型分布有明显的地域差别。本研究显示,2011—2016年石家庄市引起食物中毒的沙门菌血清型仍以肠炎沙门菌为主,与以往石家庄市报道[5,21]一致,并未发生改变。本次调查研究还发现,2016年出现了胥瓦增格隆沙门菌的小范围暴发事件,该血清型在石家庄市首次检出,提示石家庄市食源性致病沙门菌有多样化趋势。另外,胥瓦增格隆沙门菌为沙门菌的少见血清型,仅在食品[19]及屠宰场[22]中偶有检出,未发现该血清型出现在患者标本中,但本次研究从多个患者粪便标本中分离出该血清型,在国内尚属首次报道,经PFGE分型显示,该血清型与某些肠炎沙门菌同属B簇,亲缘关系较近,值得引起关注。 PFGE对沙门菌分型的强大分辨能力,使其作为沙门菌分型的金标准,被广泛应用于公共卫生健康领域[23]。与诸多学者的报道结果[19,24-25]一致,本研究中PFGE分型与血清型并非精确吻合。据娄静等[25]调查报道,PFGE预测血清型的准确率为93.4%,不同血清型其准确率有所不同,可能的原因是血清分型识别的抗原决定基因在遗传关系远的沙门菌菌株间水平转移,导致血清型相同而两者基因组进化上区别明显;因此,PFGE分型技术在对食源性疾病事件的溯源及探明传播途径方面显示了独特的优势[9,26]。 本研究中,2011—2016年石家庄市分离的40株沙门菌,可分成11种PFGE带型,反映了石家庄市致病性沙门菌的PFGE型别呈现多样性,提示近年来石家庄市并没有出现沙门菌大规模流行,而是高度散发,或潜在一些没有识别的小范围暴发,这与广东省[17]和上海市[16]的同类研究结果相似。不同食物中毒事件、不同年份及食品来源的分离株也有聚集,提示菌株可能为同一来源,与白莉等[22]报道一致。这些PFGE带型相同的散在患者之间是否存在流行病学联系,需要进一步追踪和调查,如果能够做到对所有患者分离的菌株实时进行PFGE分型,对于同一克隆的菌株进行跟踪调查,追溯致病食品的共同来源,可以从根本上控制食源性疾病的传播,最大限度地减少对消费者健康的损害。本研究还发现,同一地区不同年份分离的相同血清型菌株PFGE型存在变异,但常具有相关性,与林茂锐等[27]报道一致。不同PFGE带型沙门菌在不同时间段散发出现,应在监测中密切关注这几种带型沙门菌的流行与分布,以指导沙门菌病的防控。通过PFGE分型及耐药谱型比较发现,二者未发现明显相关性,与以往报道[8,15,27]一致。 近年来石家庄市沙门菌引起腹泻呈现多种血清型的高度散发状态,出现了新的致病血清型胥瓦增格隆沙门菌,但并未出现个别优势株引发的大规模暴发。石家庄市沙门菌多重耐药率以及对四代头孢耐药性有日益升高的趋势,提示抗生素的规范使用已经刻不容缓。利用分子流行病学技术研究菌株之间的亲缘关系,对识别传染性疾病暴发流行和溯源具有非常重要的意义。
参考文献
[1] OFW Group. Monitoring the incidence and causes of diseases potentially transmitted by food in Australia: annual report of the OzFoodNet Network, 2011[J]. Communicable Diseases Intelligence Quarterly Report,2015,39(2):213-241.
[2] ADAMS D A, GALLAGHER K M, JAJOSKY R A, et al. Summary of notifiable diseases-United States, 2011[J]. Morbidity and Mortality Weekly Report,2013,60(53):1-117.
[3] 范旭, 王宏飞. 家禽沙门氏菌防控与食品安全[J]. 兽医导刊,2008 (11):14-16.
[4] 高恒波, 王慰. 石家庄市市售食品食源性致病菌调查结果分析[J]. 中国病原生物学杂志,2015,10(10):928-930.
[5] 郭玉梅, 秦丽云, 徐保红, 等. 2003至2012年石家庄地区细菌性食物中毒病原菌特征研究[J]. 微生物学杂志,2013,33(5):73-77.
[6] 李杨, 鞠玉琳, 王晓波, 等. 中药“连黄”对耐药沙门氏菌抑制作用的研究[J]. 吉林畜牧兽医,2007,28(9):9-11.
[7] 魏琼, 刘翔, 张燕飞, 等. 宁夏地区食源性与人源沙门菌耐药性与血清型对比研究[J]. 中国抗生素杂志,2016,41(9):707-709.
[8] 梁达炜, 卢解红, 江凌晓, 等. 广州市136株沙门菌耐药表型与分子分型研究[J]. 现代预防医学,2016,43(4):696-699.
[9] 张巍巍, 于兆阳, 冯宝立, 等. 北京市密云地区沙门菌喹诺酮耐药分子机制及同源性分析[J]. 中国卫生检验杂志,2016,26(7):1050-1053.
[10] 白莉, 张秀丽, 甘辛, 等. 肉鸡养殖场中环丙沙星和头孢噻肟双重耐药沙门菌耐药机制的研究[J]. 中国食品卫生杂志,2015,27(5):487-494.
[11] 王红梅, 王和平, 雷旻, 等. 深圳市儿童医院儿童粪便分离的459株沙门菌分布特征及耐药性[J]. 中国感染控制杂志,2016,15(11):817-820.
[12] LIEBANA E, CLOUTING C, GARCIA-MIGURA L, et al. Multiple genetic typing of Salmonella enteritidis phage-types 4,6,7,8 and 13 a isolates from animals and humans in the UK [J]. Vet Microbiol, 2004,100(3/4):189-195.
[13] 全国人民代表大会常务委员会.中华人民共和国传染病防治法[A].2004.
[14] 李丽婕, 李秀娟, 赵冬. 石家庄市2006年—2008年食源性疾病监测中沙门菌的耐药性分析[J]. 中国卫生检验杂志,2010,20(9):2262-2263.
[15] 侯水平, 伍业健, 周勇, 等. 广州市2012年腹泻病人沙门菌血清学、耐药及PFGE分型分析[J]. 现代预防医学,2014,41(15):2689-2692.
[16] 沈福杰, 宿飞, 王宇, 等. 上海市黄浦区沙门氏菌感染特征及主要血清型分析[J]. 中华疾病控制杂志,2012,16(11):958-961.
[17] 刘谢, 柯碧霞, 何冬梅, 等. 2007—2013年广东省肠炎沙门菌耐药情况分析[J]. 中华疾病控制杂志,2015,19(3):269-272.
[18] 沈玄艺, 宋启发, 高红, 等. 宁波市河水环境中沙门菌分布特征和耐药性[J]. 中国食品卫生杂志,2016,28(6):709-713.
[19] 陈玉贞, 邵坤, 关冰, 等. 2003—2010年山东省食源性沙门菌血清分型及药敏分析[J]. 中国食品卫生杂志,2012,24(1):9-13.
[20] 沈伟伟, 裘丹红, 盛莹, 等. 台州市食源性沙门菌耐药性、毒力因子及分子分型研究[J]. 中国食品卫生杂志,2013,25(4):315-323.
[21] 秦丽云, 郭玉梅, 吕国平, 等. 2011至2012年石家庄地区沙门菌食物中毒分离株分子流行病学特征[J]. 微生物学杂志,2014,34(1):84-87.
[22] 白莉, 李薇薇, 王岗, 等. 我国4省肉鸡屠宰场沙门氏菌脉冲场凝胶电泳分子分型[J]. 中国食品卫生杂志,2013,25(4):303-308.
[23] WATTIAU P, BOLAND C, BERTRAND S. Methodologies for Salmonella enterica subsp. enterica subtyping: gold standards and alternatives[J]. Applied and Environmental Microbiology,2011,77(22):7877-7885.
[24] 梅玲玲, 罗芸, 叶菊莲,等. 浙江省209株沙门菌PFGE指纹图谱研究[J]. 中国卫生检验杂志, 2009,19(11):2478-2481.
[25] 娄静, 刁保卫, 李杰,等. 沙门菌脉冲场凝胶电泳分型与血清型的对应关系[J]. 中华流行病学杂志, 2013, 34(6):618-621.
[26] 王炳发, 曹春远, 陈前进, 等. 两起肠炎沙门菌所致食物中毒的病原学研究及溯源分析[J]. 中国食品卫生杂志,2016,28(1):32-36.
[27] 林茂锐, 周旋, 李明友, 等. 84株沙门菌耐药特征及分子分型结果分析[J]. 中国人兽共患病学报,2016,32(6):553-557.
[2] ADAMS D A, GALLAGHER K M, JAJOSKY R A, et al. Summary of notifiable diseases-United States, 2011[J]. Morbidity and Mortality Weekly Report,2013,60(53):1-117.
[3] 范旭, 王宏飞. 家禽沙门氏菌防控与食品安全[J]. 兽医导刊,2008 (11):14-16.
[4] 高恒波, 王慰. 石家庄市市售食品食源性致病菌调查结果分析[J]. 中国病原生物学杂志,2015,10(10):928-930.
[5] 郭玉梅, 秦丽云, 徐保红, 等. 2003至2012年石家庄地区细菌性食物中毒病原菌特征研究[J]. 微生物学杂志,2013,33(5):73-77.
[6] 李杨, 鞠玉琳, 王晓波, 等. 中药“连黄”对耐药沙门氏菌抑制作用的研究[J]. 吉林畜牧兽医,2007,28(9):9-11.
[7] 魏琼, 刘翔, 张燕飞, 等. 宁夏地区食源性与人源沙门菌耐药性与血清型对比研究[J]. 中国抗生素杂志,2016,41(9):707-709.
[8] 梁达炜, 卢解红, 江凌晓, 等. 广州市136株沙门菌耐药表型与分子分型研究[J]. 现代预防医学,2016,43(4):696-699.
[9] 张巍巍, 于兆阳, 冯宝立, 等. 北京市密云地区沙门菌喹诺酮耐药分子机制及同源性分析[J]. 中国卫生检验杂志,2016,26(7):1050-1053.
[10] 白莉, 张秀丽, 甘辛, 等. 肉鸡养殖场中环丙沙星和头孢噻肟双重耐药沙门菌耐药机制的研究[J]. 中国食品卫生杂志,2015,27(5):487-494.
[11] 王红梅, 王和平, 雷旻, 等. 深圳市儿童医院儿童粪便分离的459株沙门菌分布特征及耐药性[J]. 中国感染控制杂志,2016,15(11):817-820.
[12] LIEBANA E, CLOUTING C, GARCIA-MIGURA L, et al. Multiple genetic typing of Salmonella enteritidis phage-types 4,6,7,8 and 13 a isolates from animals and humans in the UK [J]. Vet Microbiol, 2004,100(3/4):189-195.
[13] 全国人民代表大会常务委员会.中华人民共和国传染病防治法[A].2004.
[14] 李丽婕, 李秀娟, 赵冬. 石家庄市2006年—2008年食源性疾病监测中沙门菌的耐药性分析[J]. 中国卫生检验杂志,2010,20(9):2262-2263.
[15] 侯水平, 伍业健, 周勇, 等. 广州市2012年腹泻病人沙门菌血清学、耐药及PFGE分型分析[J]. 现代预防医学,2014,41(15):2689-2692.
[16] 沈福杰, 宿飞, 王宇, 等. 上海市黄浦区沙门氏菌感染特征及主要血清型分析[J]. 中华疾病控制杂志,2012,16(11):958-961.
[17] 刘谢, 柯碧霞, 何冬梅, 等. 2007—2013年广东省肠炎沙门菌耐药情况分析[J]. 中华疾病控制杂志,2015,19(3):269-272.
[18] 沈玄艺, 宋启发, 高红, 等. 宁波市河水环境中沙门菌分布特征和耐药性[J]. 中国食品卫生杂志,2016,28(6):709-713.
[19] 陈玉贞, 邵坤, 关冰, 等. 2003—2010年山东省食源性沙门菌血清分型及药敏分析[J]. 中国食品卫生杂志,2012,24(1):9-13.
[20] 沈伟伟, 裘丹红, 盛莹, 等. 台州市食源性沙门菌耐药性、毒力因子及分子分型研究[J]. 中国食品卫生杂志,2013,25(4):315-323.
[21] 秦丽云, 郭玉梅, 吕国平, 等. 2011至2012年石家庄地区沙门菌食物中毒分离株分子流行病学特征[J]. 微生物学杂志,2014,34(1):84-87.
[22] 白莉, 李薇薇, 王岗, 等. 我国4省肉鸡屠宰场沙门氏菌脉冲场凝胶电泳分子分型[J]. 中国食品卫生杂志,2013,25(4):303-308.
[23] WATTIAU P, BOLAND C, BERTRAND S. Methodologies for Salmonella enterica subsp. enterica subtyping: gold standards and alternatives[J]. Applied and Environmental Microbiology,2011,77(22):7877-7885.
[24] 梅玲玲, 罗芸, 叶菊莲,等. 浙江省209株沙门菌PFGE指纹图谱研究[J]. 中国卫生检验杂志, 2009,19(11):2478-2481.
[25] 娄静, 刁保卫, 李杰,等. 沙门菌脉冲场凝胶电泳分型与血清型的对应关系[J]. 中华流行病学杂志, 2013, 34(6):618-621.
[26] 王炳发, 曹春远, 陈前进, 等. 两起肠炎沙门菌所致食物中毒的病原学研究及溯源分析[J]. 中国食品卫生杂志,2016,28(1):32-36.
[27] 林茂锐, 周旋, 李明友, 等. 84株沙门菌耐药特征及分子分型结果分析[J]. 中国人兽共患病学报,2016,32(6):553-557.
 牛莉娅,秦丽云,徐保红,王燕,杨新英,孙殿兴,郭玉梅.2011—2016年石家庄市40株食物中毒沙门菌的耐药特征及分子分型结果分析[J].中国食品卫生杂志,2017,29(5):539-543.
牛莉娅,秦丽云,徐保红,王燕,杨新英,孙殿兴,郭玉梅.2011—2016年石家庄市40株食物中毒沙门菌的耐药特征及分子分型结果分析[J].中国食品卫生杂志,2017,29(5):539-543.