DOi:10.13590/j.cjfh.2017.05.010
高效液相色谱-串联质谱法测定双壳类水产品麻痹性贝类毒素
(深圳市罗湖区疾病预防控制中心,广东 深圳 518020)
作者简介:岳亚军 男 副主任技师 研究方向为环境监测及食品卫生、生物毒素检测 E-mail:yueyajun1978@126.com
收稿日期:2017-05-25
摘要: 目的 采用Supelco ENVI-Carb柱净化双壳类水产品中的麻痹性贝类毒素(PSP),建立高效液相色谱-串联质谱(HPLC-MS/MS)法检测双壳类水产品中的PSP,为水产品中的PSP检测提供方法依据。方法 选用色谱柱TSK-GEL Amide-80(2.0 mm×250 mm,5 μm),以2 mmol/L甲酸铵-50 mmol/L甲酸水和95%乙腈水(含2 mmol/L甲酸铵-50 mmol/L甲酸)为流动相,采用梯度洗脱进行分离。样品用1%乙酸溶液进行提取,上清液加入氨水后(pH=4.0)经Supelco ENVI-Carb柱净化,将洗脱液抽干收集,上机测定。多重反应监测(MRM)模式检测。结果 PSP的线性范围为8.1~705.0 μg/kg,检出限为10~35 μg/kg,回收率在47.0%~91.3%之间。结论 本方法提取效果好、基质效应小,适用于双壳类水产品中麻痹性贝类毒素的痕量检测。
关键词:
双壳类; 麻痹性贝类毒素; 生物毒素; 高效液相色谱-串联质谱; 固相萃取; 基质效应; 检测; 食品安全
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)05-0571-06
Determination of paralytic shellfish poisoning in bivalves aquatic products by high
performance liquid chromatography-mass spectrometry
performance liquid chromatography-mass spectrometry
(Luohu Center for Disease Control and Prevention,Guangdong Shenzhen 518020,China)
Abstract:Objective To extract paralytic shellfish poisoning (PSP) with Supelco ENVI-Carb cartridge, develop a high performance liquid chromatography-mass spectrometry (HPLC-MS/MS) method for determination of PSP in bivalves aquatic products, and provide proof for the detection of PSP in aquatic products. Methods PSP was extracted by 1% acetic acid solution, supernatant added with ammonia (pH=4.0) was loaded on Supelco ENVI-Carb cartridge, and the eluent was dried up. Then the sample was separated on a TSK-GEL Amide column (2.0 mm×250 mm, 5 μm) with water contained 2 mmol/L ammonium formate-50 mmol/L formic acid and 95% acetonitrile contained 2 mmol/L ammonium formate-50 mmol/L formic acid was mobile phase for gradient elution. Detection was carried out by multiple reaction monitoring. Results PSP had a good linear result in the range of 8.1-705.0 μg/kg with detection limit of 10-35 μg/kg in bivalves aquatic products. The recovery was 47.0%-91.3%. Conclusion This method had good performance of extraction and with low matrix inhibition effect. The assay was suitable for trace detection of paralytic shellfish poisoning in bivalves aquatic products.
Key words:
Bivalves; paralytic shellfish poisoning; biotoxin; high performance liquid chromatography-mass spectrometry; solid phase extraction; matrix effect; test; food safety
贝类毒素是海洋毒素中对人类健康影响最大的一大类毒素的总称,其主要是由水体中产毒藻类或微生物通过食物链的传递,富集在双壳类、鱼、虾、蟹等水产中,食用这些水产对人体健康有潜在的危害风险。贝类毒素按照中毒症状可分为麻痹性贝类毒素(paralytic shellfish poisoning,PSP)、腹泻性贝类毒素(diarrheticshellfish poisoning,DSP)、记忆缺失性贝类毒素(amnesic shellfish poisoning,ASP)、神经性贝类毒素(neurotoxic shellfish poisoning,NSP),其中PSP的危害最大、分布范围最广、事故发生频率最高[1]。食入少量PSP即可引起神经系统的疾病,严重时会导致呼吸系统麻痹甚至死亡,由其引发的死亡事件每年超过2 000起,死亡率达到15%,且呈逐年上升趋势(未发表)。目前已分离出20多种PSP,分为石房蛤毒素(STX)、新石房蛤毒素(neo-STX)、膝沟藻毒素(GTX)3大类。PSP是一类神经性毒素,为二代盐,分子量低,白色固体粉末,极性比较高,不挥发,易溶于水、微溶于甲醇和乙醇,不溶于非极性溶剂。在酸性条件下稳定,在碱性条件下可发生氧化,导致毒性降低甚至消失。遇热稳定,不能被人体中的消化酶所破坏[2]。 目前国内外检测PSP的方法主要有生物小鼠法[3-4]、酶联免疫法[5-6]、高效液相色谱-串联质谱(HPLC-MS/MS)法。生物小鼠法是针对毒素功能而不是毒素结构,只能检测毒素的有无和强弱,且由于小鼠个体差异导致试验重复性差、操作过程繁琐、结果不可靠[3];酶联免疫方法只能根据待测物结构表位进行测定,而非针对其结构,由于贝类毒素种类繁多,因此其类似物有干扰作用,导致检测结果假阳性多和对毒素含量测定不准确;HPLC-MS/MS法由于其检测限低、稳定性好、抗干扰能力强,定性定量结果准确等特点,已逐步应用到贝类毒素检测领域[7-10]。 目前检测水产品中PSP的液相色谱-质谱联用法中仍存在样品提取回收率较低、基质抑制效应大、同分异构体之间难以单独定性定量等问题,本试验针对以上存在的问题,通过优化样品前处理方法和仪器条件,采用高效液相色谱-串联质谱技术建立一套灵敏度好、准确可靠的双壳类水产品中PSP的检测方法。
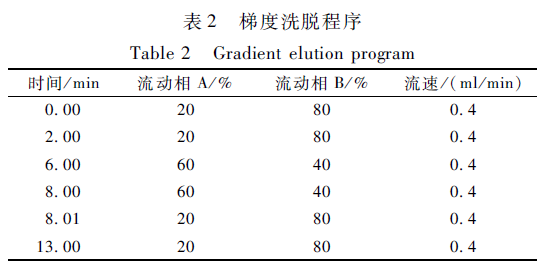
色谱:色谱柱为TSK-GEL Amide-80(2.0 mm×250 mm,5 μm)。流动相:A为2 mmol/L甲酸铵-50 mmol/L甲酸水,B为95%乙腈水(含2 mmol/L甲酸铵-50 mmol/L甲酸),流动相流速0.4 ml/min、柱温40 ℃、进样量20 μl,梯度洗脱程序见表2。
1 材料与方法
1.1 材料
1.1.1 样品来源
样品采自深圳市罗湖区某水产市场,包括扇贝、贻贝、牡蛎、带子、花甲、沙白、生蚝、马刀贝、青蛤9种双壳类水产,共111份样品,于-20 ℃下保存于冰箱。
1.1.2 主要仪器与试剂
6410BTriple Quad 高效液相色谱-质谱联用仪[配备1200高效液相色谱仪和电喷雾离子源(ESI),美国Agilent]、TSK-GEL Amide-80色谱柱(2.0 mm×250 mm,5 μm,日本TOSOH)、Envi-Carb SPE小柱(250 mg/3 ml,美国Supelco)、高速低温离心机、GDX-271型全自动固相萃取仪(法国吉尔森)。 超纯水(美国Millipore Q),乙腈、甲醇、甲酸、甲酸铵均为色谱纯,冰乙酸、氨水均为分析纯,PSP标准品:STX(CAS:35554-08-06)、脱氨甲酰基石房蛤毒素(CAS:58911-04-9,dcSTX)、neo-STX(CAS:64296-20-4)、脱氨甲酰基新石房蛤毒素(CAS:68683-58-9,dcneo-STX)、膝沟藻毒素1(CAS:60748-39-2,GTX1)、膝沟藻毒素2(CAS:60508-89-6,GTX2)、膝沟藻毒素3(CAS:60537-65-7,GTX3)、膝沟藻毒素4(CAS:64296-26-0,GTX4)、N-磺酰氨甲酰基类毒素5(CAS:64296-25-9,GTX5)、脱氨甲酰基膝沟藻毒素2(CAS:86996-87-4,dcGTX2)、脱氨甲酰基膝沟藻毒素3(CAS:87038-53-7,dcGTX3),纯度均>99.0%,均购自加拿大CRMs。
1.2 方法
1.2.1 标准溶液的配制
标准储备液:由于购买的PSP标准品均为液体且仅有0.5 ml,且浓度低,用超纯水按一定比例进行稀释,浓度范围为1.0~4.5 μg/ml,0~4 ℃保存。 标准工作使用液:将样品空白基质与标准储备液按一定比例进行稀释,得到浓度范围在1.0~705.0 ng/ml的标准工作使用液。
1.2.2 样品前处理
用超纯水冲洗净样品上的泥沙,用纸巾吸干表面的水分,称取5 g(精确到0.001 g)样品于50 ml试管中,加入5 ml的1%乙酸水,均质,沸水加热5 min,流水冷却至室温,4 ℃ 4 500 r/min离心10 min,取上清1 ml,加入5 μl氨水,混匀,取500 μl上清液过Supelco ENVI-Carb萃取柱。Supelco ENVI-Carb萃取柱依次用2 ml乙腈、2 ml 20%乙腈水(含0.1%乙酸)、2 ml 0.1%氨水活化,用700 μl超纯水淋洗,抽干,用1 ml 75%乙腈水(含0.25%甲酸)洗脱,过0.22 μm滤膜,上机测定。
1.2.3 仪器条件
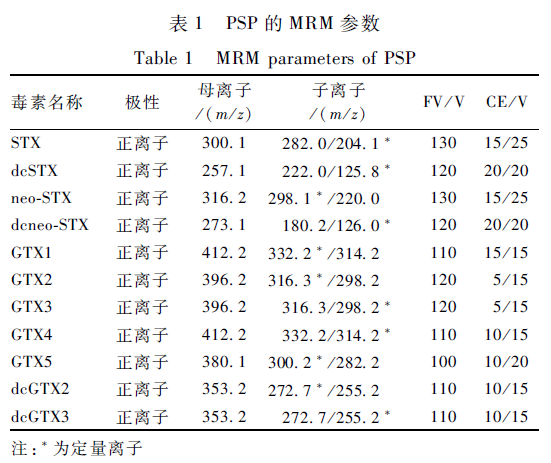
质谱:正电喷雾离子源(ESI+)、干燥气温度350 ℃、干燥气流量10.0 L/min、雾化压力38 psi(262 kPa),毛细管电压4 000 V,多重反应监测(MRM)模式,母离子、子离子、碎片电压(FV)、碰撞能量(CE)参数见表1。
|
表1 PSP的MRM参数 Table 1 MRM parameters of PSP 注:*为定量离子 |
|
表2 梯度洗脱程序 Table 2 Gradient elution program |
2 结果与分析
2.1 前处理方法的优化
由于PSP易溶于弱酸性溶液,在碱性环境中易发生氧化降解,故提取溶液选用乙酸溶液,通过比较不同浓度(0.1%、0.5%、1%、2%)的乙酸溶液对加标样品的提取效果发现:以STX为例说明,乙酸浓度从0.1%上升至1%的过程中,提取回收率从30%增加至70%左右,2%乙酸溶液虽与1%乙酸溶液提取回收率相当,但样品提取液中的杂质增多,不利于消除基质效应和色谱分离,其余10种PSP的提取效果趋势相同,因此采用1%的乙酸溶液作为提取液。通过比较HLB和Supelco ENVI-Carb固相萃取柱的提取效果,发现加标样品中的PSP经HLB柱净化后无出峰且基质效应很大,这与GB/T 5009.213—2016《食品安全国家标准 贝类中麻痹性贝类毒素的测定》[11]方法中的试验结果似有相悖,可能是由于不同品牌的质谱离子源的抗干扰能力不同所致;采用Supelco ENVI-Carb柱经过PSP加标样品后各个毒素都有出峰,该净化柱可有效吸附目标化合物并去除盐分,降低液相色谱-质谱分析时基质的抑制效应。为了降低基质的抑制效应,同时满足检出限的要求且防止上样量过载,适当减少样品上柱体积,控制在0.5 ml左右;针对PSP中dcneo-STX通过Supelco ENVI-Carb柱净化回收率较低的情况,过柱前样品提取液中加入适量的氨水进行中和(pH=4.0左右),dcneo-STX的回收率由30%提高至50%左右,而对其余10种PSP的回收率影响不大,可能是因为dcneo-STX在弱酸环境中更容易被净化柱所保留;在洗脱液中添加甲酸可明显提高PSP在质谱上的响应值,且能优化峰型。
2.2 色谱条件优化
PSP是强极性化合物,在弱极性C18色谱柱上没有保留,难以进行分离检测,而且在11种PSP化合物中GTX1和GTX4、GTX2和GTX3、dcGTX2和dcGTX3之间互为同分异构体,它们的质谱特征碎片几乎一致,如果在色谱上其基线不能分离,将无法单独准确定量。本试验选用亲水性色谱柱并比较了MerckZic-Hilic(150 mm×2.1 mm,5 μm)和TSK-GEL Amide-80(2.0 mm×250 mm,5 μm)两款色谱柱,结果PSP在TSK-GEL Amide-80色谱柱上分离效果较好,且3组同分异构体的基线基本能够分离,能够单独进行定性定量。流动相中加入适当的甲酸铵能够改善峰型,加入甲酸可以提高PSP在质谱上的离子化效率从而提高检测的灵敏度。
2.3 定性和定量结果
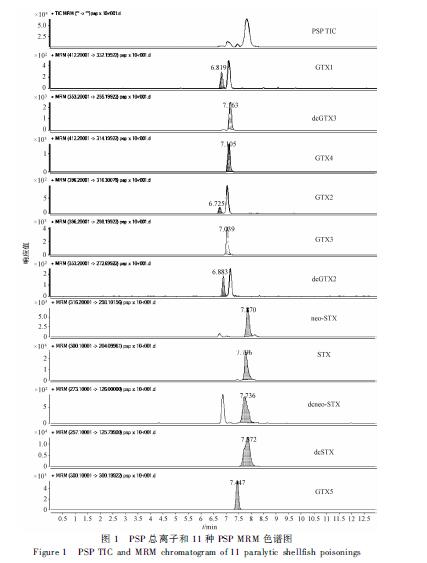
11种PSP化合物在ESI+电离形成[M+H]+,经过能量碰撞形成特征碎片,选取两组离子对,其中信号响应较强的子离子作为定量离子,信号响应相对较弱的子离子作为辅助定性离子,PSP混合标准溶液总离子(TIC)色谱图及各毒素定量离子MRM色谱图见图1。
2.4 方法特异性
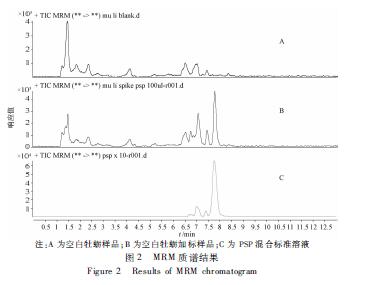
取牡蛎样品按1.2.2方法处理后,空白样品与空白基质加标样品进行分析,结果空白牡蛎基质中在PSP出峰位置上无目标化合物母离子出峰(图2),说明空白基质无干扰,方法特异性较好。
2.5 方法的线性方程、检出限和定量限结果
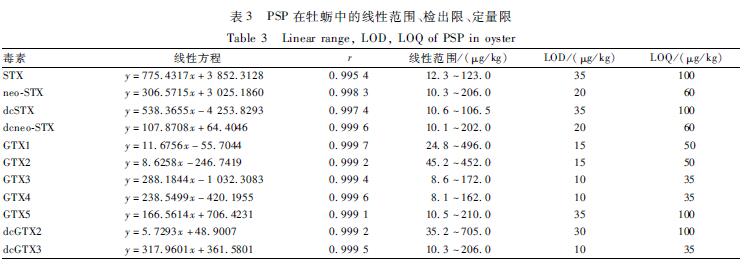
用牡蛎空白基质将PSP标准储备液进行稀释,得到浓度范围为8.1 ~705.0 μg/kg的标准工作溶液。以各个毒素的浓度为横坐标(x),峰面积为纵坐标(y)进行线性回归。以PSP在空白牡蛎基质中响应值的3倍信噪比 对应的浓度作为检出限(LOD),以10倍信噪比对应的浓度作为定量限(LOQ)。牡蛎中PSP在8.1~705.0 μg/kg范围内呈良好的线性关系,线性相关系数r>0.995,部分毒素的检出限和定量限低于GB 5009.213—2016[11]中的值,能够满足双壳类水产中PSP的痕量检测要求,见表3。
2.6 方法的回收率结果
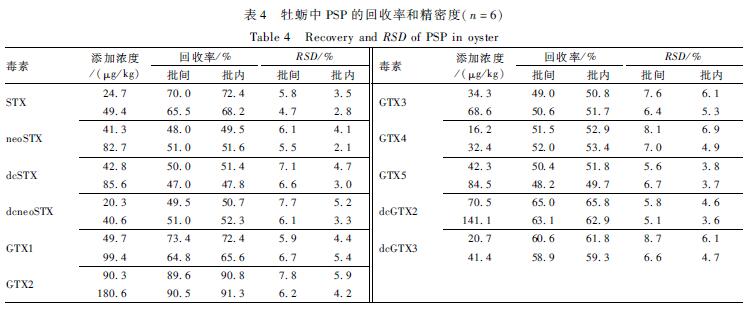
在空白牡蛎中添加适量的PSP混合标准溶液,配制成含PSP高、低2个浓度的质控样品各6份,按照1.2.2处理后进行分析。以当日工作曲线计算各样品中PSP的含量,计算6份加标样品的相对标准偏差(RSD),作为批内精密度。同法重复测定6次,计算RSD值,作为批间精密度,结果见表4。
2.7 实际样品检测
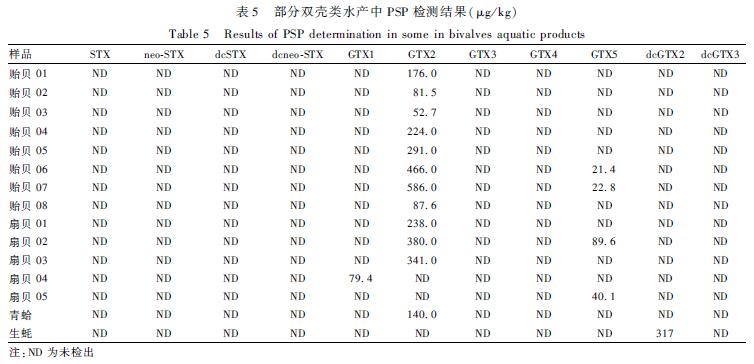
本课题组从深圳市罗湖区某水产市场中抽采共111份双壳类水产样品,其中扇贝25份、贻贝35份、牡蛎34份、生蚝8份、带子4份、青蛤2份,花甲、沙白、马刀贝各1份。采用本方法进行了PSP检测,其中GTX2有12份检出,检出样品主要为贻贝和扇贝;GTX5有4份检出,检出样品为2份贻贝和2份扇贝;GTX1和dcGTX2均有1份检出,检出样品为扇贝和生蚝,具体检测结果见表5。
|
图1 PSP总离子和11种PSP MRM色谱图 Figure 1 PSP TIC and MRM chromatogram of 11 paralytic shellfish poisonings |
|
注:A为空白牡蛎样品;B为空白牡蛎加标样品;C为PSP混合标准溶液 图2 MRM质谱结果 Figure 2 Results of MRM chromatogram |
|
表3 PSP在牡蛎中的线性范围、检出限、定量限 Table 3 Linear range, LOD, LOQ of PSP in oyster |
|
表4 牡蛎中PSP的回收率和精密度(n=6) Table 4 Recovery and RSD of PSP in oyster |
|
表5 部分双壳类水产中PSP检测结果(μg/kg) Table 5 Results of PSP determination in some in bivalves aquatic products 注:ND为未检出 |
3 小结
本试验采用Supelco ENVI-Carb石墨碳黑柱固相萃取技术对样品中PSP进行净化提取,建立了双壳类水产中PSP的HPLC-MS/MS检测方法,该方法样品前处理基质效应较小、灵敏度高,能够对PSP中各个毒素单独定性定量,为水产中PSP的食品风险监测提供可靠的技术依据。实际样品检测提示双壳类水产中存在PSP的污染状况,其中GTX2含量较多,希望有关监管部门加强监测,以保障消费者的饮食健康。
参考文献
[1] CHANG F H, KULIS D M, TILL D G, et al. Toxin production of Alexandrium minutum (Dinophyccae) from the Bay of Plenty, New Zealand[J]. Toxicon, 1997,35(3): 393-409.
[2] 李芳,李雪梅,李献刚,等. 贝类毒素检测方法研究概况[J]. 食品研究与开发, 2015, 36(23): 184-186.
[3] 付金花,沈和定,何培民,等. 温度对麻痹性贝毒含量的小鼠生物测定法的影响[J].环境与健康, 2008, 25(10): 914-916.
[4] 黄爱君,黄海燕,刘建军. 麻痹性和腹泻性贝类毒素的检测方法研究进展[J].环境与健康, 2010, 27(1): 84-86.
[5] VAN DEN TOP H J,ELLIOTT C T,HAUGHEY S A,et al.Surface plasmon resonance biosensor screening method for paralytic shellfish poisoning toxins: a pilot interlaboratory study[J].Anal Chem, 2011,83(11):4206-4213.
[6] 胡晓玲,陈剑刚,张瑰. ELISA快速测定带子中麻痹性贝类毒素含量[J].现代预防医学, 2012, 39(18): 4799-4802.
[7] 陈裕华,刘红河. 高效液相色谱-串联质谱联用测定水产中麻痹性贝类毒素[J].中国热带医学, 2012, 12(6): 656-659.
[8] 陈剑刚,朱炳辉,梁素丹,等. 固相萃取-液相色谱-串联质谱法测定贝类中的脂溶性贝类毒素[J].中国食品卫生杂志, 2015, 27(6): 624-629.
[9] 陈剑刚,朱炳辉,梁素丹,等. 固相萃取-高效液相色谱-串联质谱法测定贝类中的麻痹性贝类毒素[J].中国卫生检验杂志, 2016, 26(1): 4-8.
[10] 刘红河,杨俊,陈裕华,等. 亲水作用液相色谱-串联质谱联用法测定海产品中麻痹性贝类毒素[J].现代预防医学, 2010, 37(7): 1328-1332.
[11] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局. 食品安全国家标准 贝类中麻痹性贝类毒素的测定:GB 5009.213—2016[S]. 北京:中国标准出版社,2016.
[2] 李芳,李雪梅,李献刚,等. 贝类毒素检测方法研究概况[J]. 食品研究与开发, 2015, 36(23): 184-186.
[3] 付金花,沈和定,何培民,等. 温度对麻痹性贝毒含量的小鼠生物测定法的影响[J].环境与健康, 2008, 25(10): 914-916.
[4] 黄爱君,黄海燕,刘建军. 麻痹性和腹泻性贝类毒素的检测方法研究进展[J].环境与健康, 2010, 27(1): 84-86.
[5] VAN DEN TOP H J,ELLIOTT C T,HAUGHEY S A,et al.Surface plasmon resonance biosensor screening method for paralytic shellfish poisoning toxins: a pilot interlaboratory study[J].Anal Chem, 2011,83(11):4206-4213.
[6] 胡晓玲,陈剑刚,张瑰. ELISA快速测定带子中麻痹性贝类毒素含量[J].现代预防医学, 2012, 39(18): 4799-4802.
[7] 陈裕华,刘红河. 高效液相色谱-串联质谱联用测定水产中麻痹性贝类毒素[J].中国热带医学, 2012, 12(6): 656-659.
[8] 陈剑刚,朱炳辉,梁素丹,等. 固相萃取-液相色谱-串联质谱法测定贝类中的脂溶性贝类毒素[J].中国食品卫生杂志, 2015, 27(6): 624-629.
[9] 陈剑刚,朱炳辉,梁素丹,等. 固相萃取-高效液相色谱-串联质谱法测定贝类中的麻痹性贝类毒素[J].中国卫生检验杂志, 2016, 26(1): 4-8.
[10] 刘红河,杨俊,陈裕华,等. 亲水作用液相色谱-串联质谱联用法测定海产品中麻痹性贝类毒素[J].现代预防医学, 2010, 37(7): 1328-1332.
[11] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局. 食品安全国家标准 贝类中麻痹性贝类毒素的测定:GB 5009.213—2016[S]. 北京:中国标准出版社,2016.
 岳亚军,张律,曾丽兰.高效液相色谱-串联质谱法测定双壳类水产品麻痹性贝类毒素[J].中国食品卫生杂志,2017,29(5):571-576.
岳亚军,张律,曾丽兰.高效液相色谱-串联质谱法测定双壳类水产品麻痹性贝类毒素[J].中国食品卫生杂志,2017,29(5):571-576.