DOi:DOI:10.13590/j.cjfh.2017.05.015
贻贝中诺如病毒荧光定量反转录PCR检测及北京市污染情况调查
(1.国家食品安全风险评估中心 卫生部食品安全风险评估重点实验室,北京 100021; 2.上海浦东新区疾病预防控制中心,上海 200136)
作者简介:王佳慧 女 助理研究员 研究方向为食品微生物学 E-mail:wangjiahui@cfsa.net.cn 邹文玮 男 副主任技师 研究方向为食品微生物 E-mail:13917882247@126.com
通信作者:李凤琴 女 研究员 研究方向为食品微生物学 E-mail:
收稿日期:2017-06-07
基金项目:北京市自然科学基金(5141002)
摘要:目的 监测北京市市售贻贝中诺如病毒(NoV)的污染率及污染浓度,为贝类样品中诺如病毒的风险评估提供基础数据。方法 解剖并分离贻贝的内脏团,将内脏团研磨至均质,加入磷酸盐缓冲液振荡60 min,提取病毒颗粒。提取病毒RNA,荧光定量反转录PCR检测诺如病毒,并进行定量分析。结果 共检测293份贻贝样品,总阳性率为9.22%(27/293),其中诺如病毒基因组I(GGI)占阳性样品数的37.04%(10/27),基因组II(GGII)占阳性样品数的62.96%(17/27),未检测到同时携带GGI和GGII的样品。阳性样品中诺如病毒浓度范围在6.20×103~3.15×105基因拷贝/g(内脏)之间。结论 北京市市售贻贝中存在诺如病毒污染。
关键词:
诺如病毒; 贻贝; 水产品; RT-PCR; 食品污染物; 食品安全
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)05-0592-04
The detection of Norovirus in mussels sold in Beijing by using TaqMan-based one-step
quantitative RT-PCR assays
quantitative RT-PCR assays
(1.Key Laboratory of Food Safety Risk Assessment of Ministry of Health,China National Center for Food Safety Risk Assessment,Beijing 100021,China; 2.Shanghai Pudong New Area Center for Disease Control and Prevention,Shanghai 200136,China)
Abstract:Objective To monitor the contamination rate and concentration of Norovirus in mussels sold in Beijing seafood market and to provide basic data for risk assessment of Norovirus in mussels. Methods The visceral mass of mussels were dissected and homogenized, Norovirus were extracted from visceral mass by adding PBS buffer and shaking 60 min. The Norovirus RNA was extracted and detected using commercial kit. Results Two hundred and ninety-three mussels samples were detected. The total positive rate was 9.22%(27/293). In all the positive samples, the gene group I accounted for 37.04% (10/27) and gene group II accounted for 62.96% (17/27). The range of the quantity of Norovirus in positive mussels was 6.20×103-3.15×105 gene copies/g (visceral mass).Conclusion The mussels sold in Beijing were contaminated by Norovirus.
Key words:
Norovirus; mussel; seafood; reverse transcription polymerase chain reaction; food contaminant; food safety
诺如病毒(Norovirus,NoV),属于杯状病毒科(Calicivirida)诺如病毒属,为单股正链无包膜RNA病毒,病毒全长约7.5 kb,含有3个开放阅读框(open reading frame,ORFs),其中ORF1编码非结构蛋白,ORF2和ORF3编码衣壳蛋白。目前由于缺乏相应的细胞模型和动物模型,无法对该病毒进行有效的体外培养。根据病毒基因组特征,诺如病毒可分为6个基因组(genogroup GGI~GGVI),其中GGI和GGII是引起人类急性胃肠炎的两个主要基因组。根据衣壳蛋白编码区的遗传变异,诺如病毒GGI和GGII又进一步被分为9和22个基因型,除GGII.11、GGII.18和GGII.19基因型外,其他均可感染人类[1-2]。 诺如病毒是引起人类急性胃肠炎暴发的主要病原体之一。研究[3]表明,诺如病毒是成年人散发腹泻常见的病因,也是儿童散发腹泻的第二大病因。2002年以来,诺如病毒引起的腹泻已占我国非细菌性感染性腹泻病例的60%~96%,特别是2014年冬季起,诺如病毒感染暴发疫情明显增加,2015年,突发公共卫生事件管理系统报告暴发事件90起,与之前相比明显增多[1]。 诺如病毒是一种重要的食源性病毒,食物是诺如病毒传播的重要媒介。2009—2012年美国疾病预防控制中心食源性暴发监测网络数据[4]显示由诺如病毒引起的暴发事件有1 008起之多,占食源性暴发事件总数的48%,主要涉及到的食物有绿叶蔬菜、水果和贝类水产品。贝类水产品是诺如病毒传播的重要载体之一。在多起美国的胃肠炎暴发事件中,同时从患者粪便和牡蛎中检测到诺如病毒,且基因序列高度一致。2002年,意大利胃肠炎患者的粪便标本与当地水产品市场上出售的牡蛎样品中,均检测到基因型相同的诺如病毒[5]。2006—2008年日本和英国发生史上最大规模的诺如病毒暴发疫情,经研究表明,与生食诺如病毒污染的贝类有关[4],因此,双壳贝类一直被视作能引起人类诺如病毒感染和疫情暴发的重要食品,其中研究最多的就是牡蛎。除牡蛎外,其他双壳软体贝类,如贻贝等,也可以通过滤食作用,在体内富集大量的诺如病毒,消费者在食用加热不彻底的贻贝后,可感染诺如病毒而引发急性胃肠炎。贻贝是我国重要经济贝类之一,具有很高的营养价值,深受消费者喜爱。目前,我国针对贻贝中诺如病毒的污染状况及污染浓度的相关研究仍处于起步阶段。本研究对北京市市售贻贝中诺如病毒污染水平进行了监测和定量分析,初步了解了贻贝中诺如病毒的污染水平,为开展双壳贝类中诺如病毒风险评估提供依据。
5月检出阳性样品7份,均为GGI型,占总样品数的20.00%(7/35),6月检出阳性样品3份,均为GGI型,占总样品数的15.00%(3/20),8月和9月检出阳性样品数均为GGII型,结果见表1。未检测出同时携带两种基因组诺如病毒的阳性样品。
2.3 贻贝中诺如病毒污染浓度
选取诺如病毒阳性、门果病毒回收率在10%以上并且Ct值位于标准曲线的线性范围内的阳性样品进行定量分析,根据诺如病毒标准曲线计算出每克内脏团携带的诺如病毒基因拷贝数。结果见表2。由此可见,贻贝阳性样品中,诺如病毒浓度范围在6.20×103~3.15×105 copies/g内脏之间。贻贝中GGI平均污染浓度低于GGII平均污染浓度。有研究[7-8]报道,诺如病毒感染剂量为18~2 800个病毒粒子。与之相比,本次检测的贻贝阳性样品中诺如病毒RNA污染水平较高。
1 材料与方法
1.1 材料
1.1.1 样品
2016年5月至9月期间,从北京某大型海鲜批发市场购买新鲜的贻贝样品,共计293份混合贻贝样品(6~10个贻贝消化腺混合后即为一份样品)。
1.1.2
主要仪器与试剂 荧光PCR仪(美国Bio-Rad)、全温振荡器、水浴箱、低速台式离心机、高速台式离心机。 蛋白酶K(德国MERCK),Mengo Extraction Control kit、Norovirus GGI Q Standard、Norovirus GGII Q Standard均购自法国CeeramTooLs,QIAamp Viral RNA Mini kit(德国HildenQIAgen),RNA Ultrasense One-step Quantitative RT-PCR System(美国Life Technologies)。采用国际标准化组织(ISO/TS 15216-2∶2013[6])推荐的诺如病毒GGI和GGII的引物和探针,由英潍捷基(上海)贸易有限公司合成。
1.2 方法
1.2.1 采样
在海鲜批发市场购买新鲜贻贝样品,冷藏条件下运至实验室立即提取诺如病毒,或者在4 ℃条件下存放,24 h内完成诺如病毒的提取。
1.2.2 样品前处理
剖取6~10个贻贝的内脏团混在一起置于50 ml离心管中,研磨至均质。称取2 g研磨物,加入2 ml磷酸盐缓冲液、10 μl蛋白酶K(20 mg/ml)溶液和10 μl门果病毒,于37 ℃ 280~300 r/min振荡60 min。随后置于60 ℃水浴中加热15 min,冷却至室温,3 000 r/min离心5 min,取1 ml上清液置于新的离心管中,用于病毒RNA的提取。
1.2.3 病毒RNA提取
参照试剂盒说明书进行。诺如病毒RNA提取后,应立即检测,或置于-20 ℃冰箱3 d内完成检测。
1.2.4 荧光定量反转录PCR(荧光定量RT-PCR)检测
标准曲线的建立:配制诺如病毒标准系列。将含有诺如病毒GGI和GGII ORF2的质粒分别用水稀释成10倍浓度梯度的标准系列,浓度范围为1×101~1×104RNA copies/μl。 对照体系的制备:选用诺如病毒核酸阳性粪便B标本(GGI和GGII)作为阳性对照。阴性对照选择磷酸盐缓冲液。需在每份检测样品中加入门果病毒,作为过程控制对照。水作为空白对照。所有对照,均按照RNA提取试剂盒说明书,与样品同时进行病毒的提取操作 荧光定量RT-PCR体系及反应条件:按照试剂盒操作说明,每份样品检测体系为5×缓冲液 5 μl,诺如病毒上、下游引物分别为1.25和2.25 μl,探针0.625 μl,酶混合液1.25 μl,水9.625 μl,模板RNA 5 μl。反应条件:55 ℃反转录60 min,1个循环;95 ℃预变性5 min,1个循环;95 ℃变性15 s,60 ℃粘合1 min,65 ℃延伸1 min,45个循环。
2 结果
2.1 标准曲线及检测灵敏度
诺如病毒GGI和GGII标准系列荧光扩增曲线见图1。GGI和GGII的最低定量浓度均为1×101copies/μl,曲线的线性范围在1×104~1×101 copies/μl之间。GGI标准线性方程为y=35.745-3.347×log(x),R2=0.995,扩增效率为99.0%。GGII标准线性方程为y=40.589-3.262×log(x),R2=0.995,扩增效率为102.6%。其中y为循环阈值(Ct值),x为标准品拷贝数。
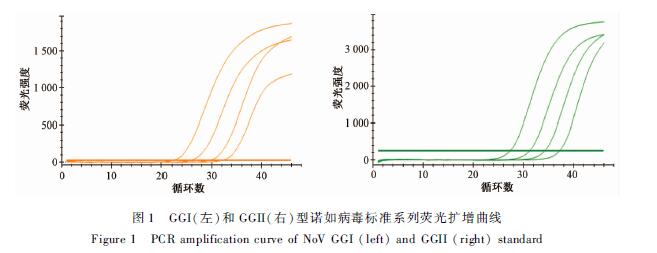
|
图1 GGI(左)和GGII(右)型诺如病毒标准系列荧光扩增曲线 Figure 1 PCR amplification curve of NoV GGI (left) and GGII (right) standard |
2.2 贻贝中诺如病毒的污染情况
共检测293份混合贻贝样品,其中27份贻贝样品检出诺如病毒,阳性率为9.22%。10份样品检出GGI型诺如病毒,占阳性样品数的37.04%(10/27);17份样品检出GGII型诺如病毒,占阳性样品数的62.96%(17/27),结果见图2。
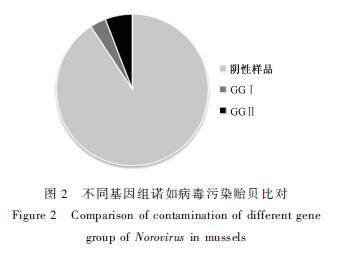
|
图2 不同基因组诺如病毒污染贻贝比对 Figure 2 Comparison of contamination of different gene group of Norovirus in mussels |
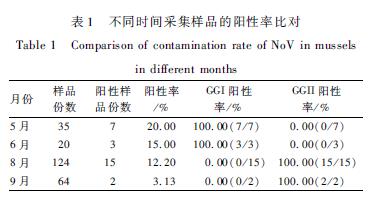
|
表1 不同时间采集样品的阳性率比对 Table 1 Comparison of contamination rate of NoV in mussels in different months |
选取诺如病毒阳性、门果病毒回收率在10%以上并且Ct值位于标准曲线的线性范围内的阳性样品进行定量分析,根据诺如病毒标准曲线计算出每克内脏团携带的诺如病毒基因拷贝数。结果见表2。由此可见,贻贝阳性样品中,诺如病毒浓度范围在6.20×103~3.15×105 copies/g内脏之间。贻贝中GGI平均污染浓度低于GGII平均污染浓度。有研究[7-8]报道,诺如病毒感染剂量为18~2 800个病毒粒子。与之相比,本次检测的贻贝阳性样品中诺如病毒RNA污染水平较高。
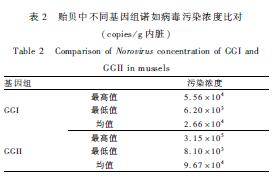
|
表2 贻贝中不同基因组诺如病毒污染浓度比对 (copies/g内脏) Table 2 Comparison of Norovirus concentration of GGI and GGII in mussels |
3 讨论
食品中诺如病毒的检测一直是诺如病毒研究的重点和难点。由于食品中诺如病毒污染水平低,且该病毒无法在食品表面繁殖,因此对检测方法的灵敏度要求高。食品本身成分复杂,含有大量影响检测的干扰因子,严重影响了检测方法的灵敏度。目前诺如病毒的检测方法主要有电镜法、免疫学方法和RT-PCR检测方法。电镜法是诺如病毒检测的经典方法,可以直接观察到病毒的形态,准确率高。但是电镜法灵敏度较低,要求每克样品中病毒浓度不低于106个病毒粒子,且需要操作者具有丰富的经验[9],因此电镜法的推广和应用受到很大的制约,不适用于食品中诺如病毒的检测。免疫学检测方便省时,特异性高,多用于临床样本检测。但检测范围窄,且无法满足诺如病毒不同基因型与亚型的分型鉴定。基于核酸检测的RT-PCR被广泛应用于诺如病毒的检测,该方法具有较好的灵敏度和特异性,且既可进行病毒基因拷贝的定量检测又可进行基因分型[10]。目前,很多实验室都建立了诺如病毒RT-PCR检测方法,但是在某些具体环节上差异较大,如病毒的提取及富集方法、食品中干扰因子去除、引物和探针的设计等方面均没有统一的标准,因此各实验室之间检测结果不具有可比性。本研究采用了ISO推荐的方法,检测北京市市售贻贝中诺如病毒的污染水平,该方法在病毒提取过程中加入了过程对照,避免由于提取过程出现问题而造成的假阴性。 本次检测中,北京市市售贻贝样品的总体污染率为9.22%,低于北京市市售牡蛎样品的平均污染率(16.0%,未发表),其原因可能与采样季节有关。本次采样主要集中在5、6、8和9月,处于诺如病毒发病的低峰期,5月的污染率达到20.00%,这可能与采样量较低有关。在贻贝解剖过程中,根据贻贝本身的大小,选择6~10个贻贝消化腺作为1份混合样品,保障每份混合样品中至少能够取出2 g消化腺用于检测。在筛选阳性样品进行定量分析时,参考了SCHAEFFER等[11]提出的回收效率>10%,并且Ct值<39的条件进行定量分析。但是,由于RT-PCR方法仅能检测病毒RNA,不能区分这些RNA是否具有可感染性,因此仅从检测结果分析,可能过高估计贻贝中诺如病毒的危害性。 本研究初步调查了北京市市售贻贝中诺如病毒的污染率及污染水平,为食品中诺如病毒的风险评估提供了基础数据,也为进一步开展贻贝中诺如病毒的连续动态污染水平监测提供了方法支撑,最终可以保障消费者食用安全及身体健康,降低由诺如病毒引起的腹泻病的疾病负担。
参考文献
[1] 廖巧红,冉陆,靳淼,等. 诺如病毒感染暴发调查和预防控制技术指南(2015版)[J].中华预防医学杂志, 2016,50(1):7-16
[2] ZHENG D P, ANDO T, FANKHAUSER R L, et al. Norovirus classification and proposed strain nomenclature[J]. Virology,2006,346(2):312-323.
[3] 刘白薇,高志勇,王全意,等. 北京市2013—2014年肠道门诊腹泻患者中诺如病毒感染的流行病学及临床特征分析[J]. 中华流行病学杂志,2015,36(4):383-386.
[4] 孔翔翔,靳淼,段招军. 诺如病毒与食源性疾病[J]. 中国临床医学杂志,2015,43(7):21-23.
[5] 柳淑芳,苏来金,周德庆. 牡蛎中诺如病毒的分子流行病学研究进展[J].海洋科学,2008,32(8):82-86.
[6] International Organization for Standardization. Microbiology of food and animal feed-Horizontal method for determination of hepatitis A virus and Norovirus in food using real-time RT-PCR:ISO/TS 15216-2:2013[S]. 2013.
[7] TEUNIS P F, MOE C L, LIU P, et al. Norwalk virus: how infectious is it?[J]. J Med Virol, 2008, 80(8): 1468-1476.
[8] ATMAR R L, OPEKUN A R, GILGER M A, et al. Determination of the 50% human infectious dose for Norwalk virus[J]. J Infect Dis,2014, 209(7): 1016-1022.
[9] 寇晓霞,吴清平,薛亮,等. 贝类中诺如病毒的研究进展[J].中国食品卫生杂志,2014,26(2):200-204.
[10] 王佳慧,李凤琴,李楠,等. GII.3型诺如病毒重组衣壳蛋白的表达和纯化鉴定[J].中国食品卫生杂志,2017,29(1): 9-13.
[11] SCHAEFFER J, LE SAUX J C, LORA M, et al. Norovirus contamination on French marked oysters[J]. NIH Public Access,2013,166(2):1-13.
[2] ZHENG D P, ANDO T, FANKHAUSER R L, et al. Norovirus classification and proposed strain nomenclature[J]. Virology,2006,346(2):312-323.
[3] 刘白薇,高志勇,王全意,等. 北京市2013—2014年肠道门诊腹泻患者中诺如病毒感染的流行病学及临床特征分析[J]. 中华流行病学杂志,2015,36(4):383-386.
[4] 孔翔翔,靳淼,段招军. 诺如病毒与食源性疾病[J]. 中国临床医学杂志,2015,43(7):21-23.
[5] 柳淑芳,苏来金,周德庆. 牡蛎中诺如病毒的分子流行病学研究进展[J].海洋科学,2008,32(8):82-86.
[6] International Organization for Standardization. Microbiology of food and animal feed-Horizontal method for determination of hepatitis A virus and Norovirus in food using real-time RT-PCR:ISO/TS 15216-2:2013[S]. 2013.
[7] TEUNIS P F, MOE C L, LIU P, et al. Norwalk virus: how infectious is it?[J]. J Med Virol, 2008, 80(8): 1468-1476.
[8] ATMAR R L, OPEKUN A R, GILGER M A, et al. Determination of the 50% human infectious dose for Norwalk virus[J]. J Infect Dis,2014, 209(7): 1016-1022.
[9] 寇晓霞,吴清平,薛亮,等. 贝类中诺如病毒的研究进展[J].中国食品卫生杂志,2014,26(2):200-204.
[10] 王佳慧,李凤琴,李楠,等. GII.3型诺如病毒重组衣壳蛋白的表达和纯化鉴定[J].中国食品卫生杂志,2017,29(1): 9-13.
[11] SCHAEFFER J, LE SAUX J C, LORA M, et al. Norovirus contamination on French marked oysters[J]. NIH Public Access,2013,166(2):1-13.
 王佳慧,邹文玮,李楠,江涛,韩春卉,张宏元,张靖,胡静,李凤琴.贻贝中诺如病毒荧光定量反转录PCR检测及北京市污染情况调查[J].中国食品卫生杂志,2017,29(5):592-595.
王佳慧,邹文玮,李楠,江涛,韩春卉,张宏元,张靖,胡静,李凤琴.贻贝中诺如病毒荧光定量反转录PCR检测及北京市污染情况调查[J].中国食品卫生杂志,2017,29(5):592-595.