DOi:10.13590/j.cjfh.2017.06.004
2004—2012年分离自北京口岸进出口食品的沙门菌耐药性分析
(北京出入境检验检疫局检验检疫技术中心,北京100026)
收稿日期:2017-09-06
作者简介:刘莉女工程师研究方向为食品微生物 E-mail:603520938@qq.com
通信作者:曾静女研究员研究方向为食品微生物 E-mail:zengj@bjciq.gov.cn
基金项目:“十三五”国家重点研发计划(2016YFD0401102)
摘要:目的了解北京口岸进出口食品中分离沙门菌的耐药状况及耐药谱情况,分析耐药趋势,为制定食品安全监管措施和抗生素的使用提供依据。方法对65株本实验室分离的沙门菌以及17株参比菌株,共82株沙门菌采用Kindy-Bauer(KB)法检测其对15种抗生素的敏感性,根据美国临床实验室标准化研究所(CLSI)标准进行判断,并对药敏试验结果进行数据分析。结果65株沙门菌分离株除对头孢吡肟、头孢曲松、阿米卡星、头孢噻肟全部敏感外,对其余11种抗生素均有不同程度的耐药,其中氨苄西林耐药率最高为16.9%(11/65),其次为哌拉西林(13.8%,9/65)、四环素(13.8%,9/65)、卡那霉素(9.2%,6/65)和链霉素(7.7%,5/65)。在所有65株沙门菌分离株中,对1种抗生素耐药的菌株共11株,占16.9%(11/65),对2种抗生素耐药的菌株为1株,占1.5%(1/65),对3种及以上抗生素耐药的多重耐药株为7株,多重耐药率为10.8%(7/65)。结论北京口岸进出口食品中分离的沙门菌对多种抗生素耐药。
关键词:
沙门菌; 耐药性; 食品安全; 进出口食品; 北京口岸; 食源性致病菌
文章编号:1004-8456(2017)06-0653-05
中图分类号:R155
文献标志码:A
Analysis of antimicrobial resistance of isolated Salmonella spp. from import and export food in Beijing,2004-2012
(Beijing Inspection Quarantine Testing Center,Beijing 100026, China)
Abstract:ObjectiveTo determine the antibiotic susceptibility of isolated Salmonella spp. from import and export food and evaluate the spectrum of their multiple antimicrobial resistance,so as to provide the basis for food safety and rational clinical drug usage. MethodsThe Salmonella spp. of 65 isolated strains and 17 reference strains were tested for their antimicrobial susceptibility against 15 kinds of antibiotics by Kirby-Bauer method. The susceptibility was determined by the standard of Clinical and Laboratory Standards Institute (CLSI). ResultsAll of the isolates were sensitive to cefepime, ceftriaxone, amikacin and cefotaxime. The highest drug resistance rate was for ampicillin (16.9%,11/65) and piperacillin (13.8%,9/65). Many isolates were resistant to tetracycline (13.8%,9/65), kanamycin (9.2%,6/65) and streptomycin (7.7%,5/65). Among 65 isolates,eleven strains (16.9%,11/65)were resistant to one antibiotic,one strain(1.5%,1/65) was resistant to two antibiotics, and 7(10.8%, 7/65) strains of multidrug resistance were detected which were resistant to three to six antibiotics. ConclusionIsolates of Salmonella spp. from import and export food in Beijing showed multiple drug resistance and the monitoring should be strengthened to ensure food safety.
Key words:
Salmonella; antimicrobial-resistance; food safety; import and export food; Beijing port; foodborne pathogens
2015年来,我国进出口食品总量超过15万吨/年,国家质量监督检验检疫总局发布的《2010—2014年中国进口食品质量安全状况》[1]中指出,微生物污染导致的食品安全问题最为突出。进出口食品中微生物污染状况显示,沙门菌的检出率为1.19%,位列致病菌检出率的第二位[2]。现如今,细菌耐药性问题已成为全球关注的焦点,2015年在中国发现的对粘菌素具有耐药性的“超级细菌”引起了人们对于未来自身健康的担忧[3],细菌的耐药性基因不仅能跨越不同物种传播,还能通过染色体接触遗传[4]。细菌耐药性一旦通过食物链传播到人群,将对公共卫生安全构成严重危害,因此监测进出口食品中沙门菌的耐药性,对人类健康和公共卫生具有重大意义。
沙门菌(Salmonella)是肠杆菌科的重要菌属,是引起人类感染性腹泻和食物中毒的重要致病菌,在目前已发现的2 500多种血清型中,有20多种可以引起人兽共患病,其中危害较大的有阿贡纳沙门菌、甲型副伤寒沙门菌、鼠伤寒沙门菌、乙型副伤寒沙门菌、肯塔基沙门菌、肠炎沙门菌、猪霍乱沙门菌等,而彻斯特沙门菌、金斯敦沙门菌等也可引起一些食源性疾病[5-8]。在全球范围内,每年有9 380万人因感染沙门菌而患上胃肠炎等疾病,最终导致15.5万人死亡[9]。
人类主要通过食用被污染的食品而导致沙门菌感染,如奶、蛋、肉等[10]。此外,接触了携带沙门菌的家养禽畜、野生动物也有可能导致感染[11]。感染沙门菌的患者如果不能得到及时治疗,往往会引发肠穿孔、败血症,最终导致死亡,临床治疗常需要使用抗生素[12]。有证据[13]表明,引起细菌耐药性增加的原因主要与抗生素的广泛使用、患者流动性增大、治疗策略存在诸多问题等因素相关。
为了解进出口食品中沙门菌的耐药状况,现将本实验室在2004—2012年间从北京口岸进出口食品中分离的65株已知血清型的沙门菌,以及17株参比菌株的耐药性进行分析,为疾病防治和食品安全保障提供科学依据。
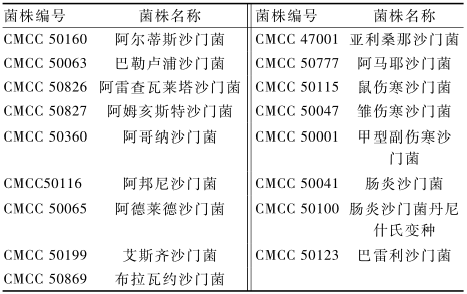
17株沙门菌参比菌株购自中国医学微生物菌种保藏管理中心(CMCC),沙门菌的耐药机制显示其获得性耐药主要针对β-内酰胺酶类的抗生素[15],因此参比菌株的耐药性可在一定程度上作为分离株耐药性的比较对象[16]。参比菌株具体信息见表2。药敏试验的质控菌株大肠埃希菌(ATCC 25922)、金黄色葡萄球菌(ATCC 25923)、铜绿假单胞菌(ATCC 27853)均购自美国菌种保藏中心(ATCC)。
胰蛋白胨大豆琼脂(TSA)培养基、脑心浸液肉汤(BHI)培养基、MH(Mueller-Hinton)琼脂培养基均购自北京陆桥技术股份有限公司。根据美国临床实验室标准化研究所(CLSI)选择用于耐药性试验的抗生素[17],15种药敏纸片均购自英国Oxoid,包括哌拉西林(PIP,20 μg)、氨苄西林(AMP,10 μg)、头孢吡肟(FEP,30 μg)、阿莫西林(AMC,30 μg)、头孢噻肟(CTX,30 μg)、头孢曲松(CRO,30 μg)、环丙沙星(CIP,5 μg)、诺氟沙星(NOR,10 μg)、庆大霉素(CN,10 μg)、卡那霉素(K,30 μg)、阿米卡星(AK,30 μg)、链霉素(S,10 μg)、四环素(TE,30 μg)、氯霉素(C,30 μg)、甲氧苄啶磺胺甲噁唑(SXT,25 μg)。
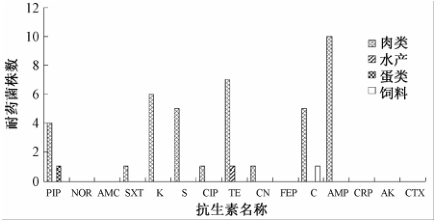
经SPSS 19.0软件计算,沙门菌分离株与参比菌株的耐药性差异有统计学意义(P<0.05)。65株沙门菌中有43株沙门菌分离自肉类、水产、蛋类以及饲料等4类样品,对其分离样品来源分析结果见图1,4类不同来源沙门菌的耐药性差异有统计学意义(P<0.05)。
为耐药外,其余菌株对15种抗生素均表现为敏感,而从北京口岸进出口食品中分离的65株沙门菌菌株对PIP、AMP、TE、C、K、S和SXT的耐药率较高(4.6%~16.9%),对剩余8种抗生素的耐药率较低(0.0%~1.5%),这说明北京口岸进出口食品中沙门菌对抗生素耐药性较高,应引起相关部门的高度重视。
本次研究发现,82株沙门菌对第三代头孢菌素(CTX、CRO)和第四代头孢菌素FEP以及AK耐药率较低。这说明此次从食品中分离的沙门菌并没有超广谱头孢菌素耐药型,这与陈玉贞等[18]研究2003—2010年间山东省食源性沙门菌常见血清型的多重耐药分布的结论一致。同时由于头孢菌素对沙门菌的敏感性,在选择药物治疗沙门菌引起的感染性腹泻等疾病时,可以考虑使用三代或四代头孢菌素,应会取得良好治疗效果,特别是在临床上用于无法适用喹诺酮类药物治疗的小儿腹泻患者[19-20]。
沙门菌对AMP、PIP和TE有着较高的耐药率,因此在临床使用时应谨慎选用。2008年美国国家抗生素耐药监测系统(NARMS)发布的年度报告[21]显示,25%的非伤寒沙门菌至少耐1种抗生素,最常见的多重耐药表型为AMP、C、S、磺胺类和四环素类耐药,本研究部分内容与其一致。NILSSON等[22]在2003年关于大肠菌群的耐药性研究表明,其耐药性与侵袭性呈现负相关性,细菌在抗生素压力下获得的耐药性,往往会使耐药细菌产生生物成本,这会导致细菌的生长速率下降、毒性降低,因此判断沙门菌的耐药性对人类的危害还需综合多方面因素共同讨论。
本研究发现血清型相同的沙门菌,其药物敏感性是相似的。8株阿贡纳沙门菌对15种抗生素均表现出敏感;4株肠炎沙门菌对除了AMP以外的14种抗生素均表现出敏感,这可能是由于编号为BJ-Sal-86的肠炎沙门菌来源于鸡肉,因而具有AMP抗性,这与韦婷[23]关于2012—2013年四川地区鸡肉中沙门菌对AMP的抗性高达90.16%的结果相一致;3株甲型副伤寒沙门菌、2株奥斯陆沙门菌和2株姆班达卡沙门菌对15种抗生素均敏感。2株婴儿沙门菌中有1株编号为BJ-Sal-32的沙门菌来源于海鲜,对PIP具有抗性,对其他抗生素均敏感。
肯塔基沙门菌的变异株因为其抗CIP而被誉为“超级沙门菌”[24],本研究显示未变异的肯塔基沙门菌虽对CIP体现出敏感,但是有关部门应继续对其监控以保证消费者的身体健康。
本研究显示从鸡肉中分离的沙门菌全部对AMP耐药,耐药率达到100.0%,这与林居纯等[10]关于2003—2010年从四川省、广东省、江苏省等地采集的动物源性产品的沙门菌耐药性检测结果相类似。AMP作为一种β-内酰胺类抗生素,为了治疗和预防禽类疾病,在养鸡业内广泛使用[25],使得沙门菌的耐药性越来越强,因此为了避免鸡肉沙门菌的耐药性通过食物链传播到人群,鸡养殖业应规范使用抗生素。
沙门菌(Salmonella)是肠杆菌科的重要菌属,是引起人类感染性腹泻和食物中毒的重要致病菌,在目前已发现的2 500多种血清型中,有20多种可以引起人兽共患病,其中危害较大的有阿贡纳沙门菌、甲型副伤寒沙门菌、鼠伤寒沙门菌、乙型副伤寒沙门菌、肯塔基沙门菌、肠炎沙门菌、猪霍乱沙门菌等,而彻斯特沙门菌、金斯敦沙门菌等也可引起一些食源性疾病[5-8]。在全球范围内,每年有9 380万人因感染沙门菌而患上胃肠炎等疾病,最终导致15.5万人死亡[9]。
人类主要通过食用被污染的食品而导致沙门菌感染,如奶、蛋、肉等[10]。此外,接触了携带沙门菌的家养禽畜、野生动物也有可能导致感染[11]。感染沙门菌的患者如果不能得到及时治疗,往往会引发肠穿孔、败血症,最终导致死亡,临床治疗常需要使用抗生素[12]。有证据[13]表明,引起细菌耐药性增加的原因主要与抗生素的广泛使用、患者流动性增大、治疗策略存在诸多问题等因素相关。
为了解进出口食品中沙门菌的耐药状况,现将本实验室在2004—2012年间从北京口岸进出口食品中分离的65株已知血清型的沙门菌,以及17株参比菌株的耐药性进行分析,为疾病防治和食品安全保障提供科学依据。
1材料与方法
1.1材料
1.1.1试验菌株
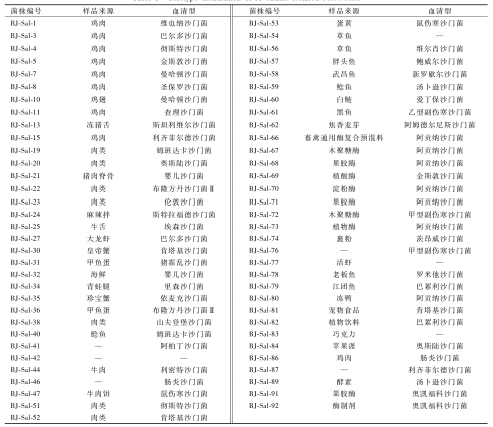
本实验室分离保存的65株沙门菌[14],具体信息见表1。
|
表165株沙门菌菌株来源与血清型 Table 1Serotype distribution of 65 strains isolated Salmonella 注:—表示该沙门菌的样品来源不明或无法确定血清型 |
|
表2参比菌株信息 Table 2Details of reference strains tested in this study |
1.1.2主要仪器与试剂
细菌浊度仪(法国梅里埃),低温培养箱,游标卡尺。胰蛋白胨大豆琼脂(TSA)培养基、脑心浸液肉汤(BHI)培养基、MH(Mueller-Hinton)琼脂培养基均购自北京陆桥技术股份有限公司。根据美国临床实验室标准化研究所(CLSI)选择用于耐药性试验的抗生素[17],15种药敏纸片均购自英国Oxoid,包括哌拉西林(PIP,20 μg)、氨苄西林(AMP,10 μg)、头孢吡肟(FEP,30 μg)、阿莫西林(AMC,30 μg)、头孢噻肟(CTX,30 μg)、头孢曲松(CRO,30 μg)、环丙沙星(CIP,5 μg)、诺氟沙星(NOR,10 μg)、庆大霉素(CN,10 μg)、卡那霉素(K,30 μg)、阿米卡星(AK,30 μg)、链霉素(S,10 μg)、四环素(TE,30 μg)、氯霉素(C,30 μg)、甲氧苄啶磺胺甲噁唑(SXT,25 μg)。
1.2方法
1.2.1耐药性检测
从营养琼脂平板上挑取经37 ℃、18 h培养的沙门菌,使用细菌浊度仪将受试菌株制成0.5麦氏浊度的菌悬液。将无菌拭子浸入菌悬液中,对着试管壁旋转按压,挤出多余液体,沿着至少3个方向涂布平板表面,在15 min内将平衡至室温的药敏纸片放到平板上,每块平板试验3张药敏纸片。将平板于37 ℃培养18 h,使用黑色背景和反射光从平板的背面测量细菌生长完全被抑制区域的直径,抑菌环的边缘应为肉眼可见的无明显微生物生长的区域,测量结果应精确到mm。同时将3株质控菌株进行同样处理。依据CLSI对抗生素敏感性结果进行判读[17]。
1.3统计学分析
利用SPSS 19.0软件分析耐药性检测结果,通过χ2检验分析不同血清型、不同来源沙门菌在耐药性与多重耐药性等方面的差异,以P<0.05为差异有统计学意义。
2结果与分析
2.1沙门菌耐药性分析
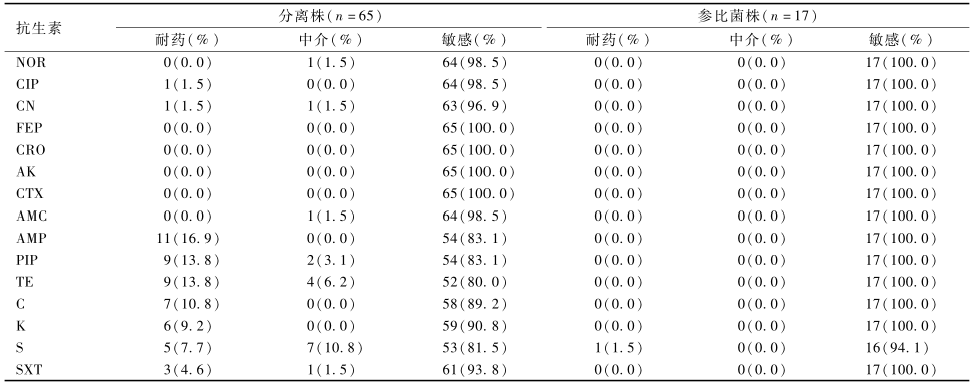
全部82株沙门菌耐药性检测结果见表3。药敏试验结果显示,北京口岸进出口食品中分离的65株沙门菌对15种抗生素中的8种较敏感,NOR、FEP、CRO、AK、CTX和AMC的耐药率均为0.0%(0/65),CIP和CN的耐药率均为1.5%(1/65);部分分离株对另外7种抗生素均有不同程度的耐药,耐药率由高到低依次为AMP(16.9%,11/65)、PIP(13.8%,9/65)、TE(13.8%,9/65)、C(10.8%,7/65)、K(9.2%,6/65)、S(7.7%,5/65)、SXT(4.6%,3/65)。而17株沙门菌参比菌株对15种抗生素的耐药性均较弱,仅有雏伤寒沙门菌对S表现出耐药性。经SPSS 19.0软件计算,沙门菌分离株与参比菌株的耐药性差异有统计学意义(P<0.05)。65株沙门菌中有43株沙门菌分离自肉类、水产、蛋类以及饲料等4类样品,对其分离样品来源分析结果见图1,4类不同来源沙门菌的耐药性差异有统计学意义(P<0.05)。
2.2耐药谱结果
65株沙门菌分离株中,耐药菌株共19株,其中耐1种抗生素的菌株有11株(16.9%),耐2种抗生素的菌株有1株(1.5%),耐3种抗生素的菌株有1株(1.5%),耐4种抗生素的菌株有3株(4.6%),耐5种抗生素的菌株有1株(1.5%),耐6种抗生素的菌株有2株(3.1%),结果见表4。17株沙门菌参比菌株中没有多重耐药菌株出现。分离株中来源为鸡肉的7株沙门菌均对AMP产生耐药性,其中有2株沙门菌(BJ-Sal-7和BJ-Sal-11)多重耐药谱完全相同,均为PIP+K+S+TE+C+AMP。
3讨论
本研究采用CLSI推荐的Kirby-Bauer纸片法测定了82株沙门菌对15种抗生素的敏感性。从试验结果可知,17株沙门菌参比菌株除1株对S表现
|
表382株沙门菌对15种抗生素耐药性试验结果 Table 3Results of drug susceptibility test about Salmonella spp. |
|
图14类不同来源沙门菌耐药菌株数 Figure 1Drug-resistance spectrum of Salmonella spp. of four different products |

|
表419株耐药沙门菌分离株的耐药谱分析 Table 4Resistance spectrum analysis of drug-resistant Salmonella spp. 注:—表示该沙门菌的样品来源不明或无法确定血清型 |
本次研究发现,82株沙门菌对第三代头孢菌素(CTX、CRO)和第四代头孢菌素FEP以及AK耐药率较低。这说明此次从食品中分离的沙门菌并没有超广谱头孢菌素耐药型,这与陈玉贞等[18]研究2003—2010年间山东省食源性沙门菌常见血清型的多重耐药分布的结论一致。同时由于头孢菌素对沙门菌的敏感性,在选择药物治疗沙门菌引起的感染性腹泻等疾病时,可以考虑使用三代或四代头孢菌素,应会取得良好治疗效果,特别是在临床上用于无法适用喹诺酮类药物治疗的小儿腹泻患者[19-20]。
沙门菌对AMP、PIP和TE有着较高的耐药率,因此在临床使用时应谨慎选用。2008年美国国家抗生素耐药监测系统(NARMS)发布的年度报告[21]显示,25%的非伤寒沙门菌至少耐1种抗生素,最常见的多重耐药表型为AMP、C、S、磺胺类和四环素类耐药,本研究部分内容与其一致。NILSSON等[22]在2003年关于大肠菌群的耐药性研究表明,其耐药性与侵袭性呈现负相关性,细菌在抗生素压力下获得的耐药性,往往会使耐药细菌产生生物成本,这会导致细菌的生长速率下降、毒性降低,因此判断沙门菌的耐药性对人类的危害还需综合多方面因素共同讨论。
本研究发现血清型相同的沙门菌,其药物敏感性是相似的。8株阿贡纳沙门菌对15种抗生素均表现出敏感;4株肠炎沙门菌对除了AMP以外的14种抗生素均表现出敏感,这可能是由于编号为BJ-Sal-86的肠炎沙门菌来源于鸡肉,因而具有AMP抗性,这与韦婷[23]关于2012—2013年四川地区鸡肉中沙门菌对AMP的抗性高达90.16%的结果相一致;3株甲型副伤寒沙门菌、2株奥斯陆沙门菌和2株姆班达卡沙门菌对15种抗生素均敏感。2株婴儿沙门菌中有1株编号为BJ-Sal-32的沙门菌来源于海鲜,对PIP具有抗性,对其他抗生素均敏感。
肯塔基沙门菌的变异株因为其抗CIP而被誉为“超级沙门菌”[24],本研究显示未变异的肯塔基沙门菌虽对CIP体现出敏感,但是有关部门应继续对其监控以保证消费者的身体健康。
本研究显示从鸡肉中分离的沙门菌全部对AMP耐药,耐药率达到100.0%,这与林居纯等[10]关于2003—2010年从四川省、广东省、江苏省等地采集的动物源性产品的沙门菌耐药性检测结果相类似。AMP作为一种β-内酰胺类抗生素,为了治疗和预防禽类疾病,在养鸡业内广泛使用[25],使得沙门菌的耐药性越来越强,因此为了避免鸡肉沙门菌的耐药性通过食物链传播到人群,鸡养殖业应规范使用抗生素。
参考文献
[1]李颖.质检总局发布《2010—2014年中国进口食品质量安全状况》白皮书[J].中国质量万里行,2015 (12): 48-51.
[2]王梦琦,曲辉,聂丹丹,等.2014—2015年吉林省出入境 8 类食品中微生物污染状况分析[J].安徽农业科学,2016,44(13):92-94.
[3]LIU Y Y,WANG Y,WALSH T R,et al.Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China:a microbiological and molecular biological study[J].The Lancet Infectious Diseases,2016,16(2):161-168.
[4]RODRGUEZ-ROJAS A,RODRGUEZ-BELTRN J,COUCE A,et al.Antibiotics and antibiotic resistance:a bitter fight against evolution [J].International Journal of Medical Microbiology,2013, 303(6/7):293-297.
[5]ZHU H,LUO L Y,HU S H,et al.Treating Alzheimer‘s disease with Yizhijiannao granules by regulating expression of multiple proteins in temporal lobe[J].Neural Regeneration Research,2014,9(13):2533-2538.
[6]曲梅,张新,王小莉,等.阿贡纳沙门菌引起的聚集性腹泻病例监测及分析[J].疾病监测,2013,28 (3):193-196.
[7]许龙岩,袁慕云,孙薇,等.基于TaqMan探针四重荧光PCR检测甲型、乙型、丙型副伤寒和伤寒沙门菌[J].卫生研究,2017,46(2):298-302.
[8]高凤玲.猪副伤寒的症状、诊断、鉴别和防治措施[J].现代畜牧科技,2017(1):67.
[9]MAJOWICZ S E,MUSTO J,SCALLAN E,et al.The global burden of non-typhoidal Salmonella gastroenteritis[J].Clinical Infectious Diseases,2010,50(6):882-889.
[10]林居纯,覃春红,赖婧,等.食品动物源沙门菌质粒介导喹诺酮类耐药基因的检测与分析[J].畜牧兽医学报,2012,43(5):803-809.
[11]张新,曲梅,黄瑛,等.北京市21株鼠伤寒沙门菌多重耐药和分子分型研究[J].中华临床医师杂志(电子版),2012,6(15):4477-4479.
[12]纪金铃,崔恩博,郭桐生,等.10年间北京地区腹泻患者沙门菌亚型分布和耐药分析[J].中国卫生检验杂志,2011,21(12):2937-2939.
[13]朱静,蒋伟,常东,等.北京市某三甲医院病原菌结构及耐药性变迁[J].国际检验医学杂志,2011,32 (7):763-765.
[14]刘莉,韩笑,王紫薇,等.2004—2012年北京出入境口岸食品及饲料中沙门菌血清分型研究[J].中国食品卫生杂志,2017,29(5):534-538.
[15]胡彩光,高维凡,教郁,等.沙门氏菌耐药机制的研究进展[J].现代畜牧兽医,2013(4):53-56.
[16]宗兆婧,刘梅,陈玲,等.广泛耐药结核分枝杆菌与标准菌株H37Rv菌体差异蛋白的比较[J].贵州医药,2012,36(11):963-965.
[17]WOLFENSBERGER A,SAX H,WEBER R,et al.Change of antibiotic susceptibility testing guidelines from CLSI to EUCAST:influence on cumulative hospital antibiograms[J].PLoS One,2013,8(11):e79130.
[18]陈玉贞,邵坤,关冰,等.2003—2010年山东省食源性沙门菌血清分型及药敏分析[J].中国食品卫生杂志,2012,24(1):9-13.
[19]陈耀能,梁景涛,陈爱贞,等.佛山市食源性和人源沙门菌血清型分布于耐药性研究[J].热带医学杂志,2012,12(8):955-958.
[20]王晓泉,焦新安,刘晓文,等.江苏部分地区食源性和人源沙门菌的多重耐药性研究[J].微生物学报,2007,47(2):221-227.
[21]CRAY P. Update: the national antimicrobial resistance monitoring system enteric bacteria (NARMS): animal arm[J]. Biochemical Journal, 2011, 437(3):565-574.
[22]NILSSON A I,BERG O G,ASPEVALL O,et al.Biological costs and mechanisms of fosfomycin resistance in Escherichia coli[J].Antimicrobial Agents and Chemotherapy,2003,47(9):2850-2858.
[23]韦婷.2012—2013四川部分地区市售鸡肉中沙门菌污染及耐药性分析[D].成都:四川农业大学,2015.
[24]HELLO S L,HENDRIKSEN R S,DOUBLET B,et al.International spread of an epidemic population of Salmonella enterica serotype Kentucky ST198 resistant to ciprofloxacin[J].The Journal of Infectious Diseases,2011,204(5):675-684.
[25]李文平,阚鹿枫,马浩.微生物法测定鸡肉组织中的氨苄西林残留[J].中国兽药杂志,2004,38(9):20-22.
[2]王梦琦,曲辉,聂丹丹,等.2014—2015年吉林省出入境 8 类食品中微生物污染状况分析[J].安徽农业科学,2016,44(13):92-94.
[3]LIU Y Y,WANG Y,WALSH T R,et al.Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China:a microbiological and molecular biological study[J].The Lancet Infectious Diseases,2016,16(2):161-168.
[4]RODRGUEZ-ROJAS A,RODRGUEZ-BELTRN J,COUCE A,et al.Antibiotics and antibiotic resistance:a bitter fight against evolution [J].International Journal of Medical Microbiology,2013, 303(6/7):293-297.
[5]ZHU H,LUO L Y,HU S H,et al.Treating Alzheimer‘s disease with Yizhijiannao granules by regulating expression of multiple proteins in temporal lobe[J].Neural Regeneration Research,2014,9(13):2533-2538.
[6]曲梅,张新,王小莉,等.阿贡纳沙门菌引起的聚集性腹泻病例监测及分析[J].疾病监测,2013,28 (3):193-196.
[7]许龙岩,袁慕云,孙薇,等.基于TaqMan探针四重荧光PCR检测甲型、乙型、丙型副伤寒和伤寒沙门菌[J].卫生研究,2017,46(2):298-302.
[8]高凤玲.猪副伤寒的症状、诊断、鉴别和防治措施[J].现代畜牧科技,2017(1):67.
[9]MAJOWICZ S E,MUSTO J,SCALLAN E,et al.The global burden of non-typhoidal Salmonella gastroenteritis[J].Clinical Infectious Diseases,2010,50(6):882-889.
[10]林居纯,覃春红,赖婧,等.食品动物源沙门菌质粒介导喹诺酮类耐药基因的检测与分析[J].畜牧兽医学报,2012,43(5):803-809.
[11]张新,曲梅,黄瑛,等.北京市21株鼠伤寒沙门菌多重耐药和分子分型研究[J].中华临床医师杂志(电子版),2012,6(15):4477-4479.
[12]纪金铃,崔恩博,郭桐生,等.10年间北京地区腹泻患者沙门菌亚型分布和耐药分析[J].中国卫生检验杂志,2011,21(12):2937-2939.
[13]朱静,蒋伟,常东,等.北京市某三甲医院病原菌结构及耐药性变迁[J].国际检验医学杂志,2011,32 (7):763-765.
[14]刘莉,韩笑,王紫薇,等.2004—2012年北京出入境口岸食品及饲料中沙门菌血清分型研究[J].中国食品卫生杂志,2017,29(5):534-538.
[15]胡彩光,高维凡,教郁,等.沙门氏菌耐药机制的研究进展[J].现代畜牧兽医,2013(4):53-56.
[16]宗兆婧,刘梅,陈玲,等.广泛耐药结核分枝杆菌与标准菌株H37Rv菌体差异蛋白的比较[J].贵州医药,2012,36(11):963-965.
[17]WOLFENSBERGER A,SAX H,WEBER R,et al.Change of antibiotic susceptibility testing guidelines from CLSI to EUCAST:influence on cumulative hospital antibiograms[J].PLoS One,2013,8(11):e79130.
[18]陈玉贞,邵坤,关冰,等.2003—2010年山东省食源性沙门菌血清分型及药敏分析[J].中国食品卫生杂志,2012,24(1):9-13.
[19]陈耀能,梁景涛,陈爱贞,等.佛山市食源性和人源沙门菌血清型分布于耐药性研究[J].热带医学杂志,2012,12(8):955-958.
[20]王晓泉,焦新安,刘晓文,等.江苏部分地区食源性和人源沙门菌的多重耐药性研究[J].微生物学报,2007,47(2):221-227.
[21]CRAY P. Update: the national antimicrobial resistance monitoring system enteric bacteria (NARMS): animal arm[J]. Biochemical Journal, 2011, 437(3):565-574.
[22]NILSSON A I,BERG O G,ASPEVALL O,et al.Biological costs and mechanisms of fosfomycin resistance in Escherichia coli[J].Antimicrobial Agents and Chemotherapy,2003,47(9):2850-2858.
[23]韦婷.2012—2013四川部分地区市售鸡肉中沙门菌污染及耐药性分析[D].成都:四川农业大学,2015.
[24]HELLO S L,HENDRIKSEN R S,DOUBLET B,et al.International spread of an epidemic population of Salmonella enterica serotype Kentucky ST198 resistant to ciprofloxacin[J].The Journal of Infectious Diseases,2011,204(5):675-684.
[25]李文平,阚鹿枫,马浩.微生物法测定鸡肉组织中的氨苄西林残留[J].中国兽药杂志,2004,38(9):20-22.
