DOi:10.13590/j.cjfh.2017.06.005
建立同位素稀释-超高效液相色谱-串联质谱法 测定烘焙食品中来源于鸡蛋的3种主要致敏蛋白
(1.首都医科大学公共卫生学院,北京100069; 2.北京市疾病预防控制中心 食物中毒溯源技术北京市重点实验室,北京100013)
收稿日期:2017-09-07
作者简介:齐开伦男硕士生研究方向为食品安全检测 E-mail: qikailun123@sohu.com
通信作者:丁晓静女教授研究方向为色谱分析 E-mail: dxj_wry@yahoo.com
基金项目:北京市自然科学基金(7162088)
摘要:目的建立用于测定烘培食品中来源于鸡蛋的3种主要致敏蛋白溶菌酶、卵转铁蛋白、卵白蛋白的超高效液相色谱-串联质谱法。方法筛选溶菌酶、卵转铁蛋白、卵白蛋白的特异水解肽段,合成特异肽段及其同位素标记肽段,样品用200 mmol/L Tris-HCl(pH=8.0)匀浆提取2~3次,提取液与胰蛋白酶混匀(胰蛋白酶与蛋白质的质量比为1∶50),37 ℃振摇酶解12 h,采用电喷雾正离子模式下多反应监测(MRM),同位素内标法定量。结果9条特异水解肽段标准溶液在1~100 nmol/L范围内线性良好,相关系数(r2)均>0.995,烘培食品中3种致敏蛋白的定量限为0.4~10.0 μg/g,回收率在65.0%~108.5%之间,相对标准偏差(RSD)<15.0%。结论方法灵敏度和特异性高,适用于烘培食品中来源于鸡蛋的3种致敏蛋白的检测。
关键词:
鸡蛋; 致敏蛋白; 溶菌酶; 卵转铁蛋白; 卵白蛋白; 食品; 水解肽; 同位素稀释质谱
文章编号:1004-8456(2017)06-0658-08
中图分类号:R155
文献标志码:A
Establishment of ultra-high performance liquid chromatography tandem isotope dilution mass spectrometry for the determination of three major allergens from egg in baked food
(1.School of Public Health,Capital Medical University,Beijing 100069,China; 2.Beijing Key Laboratory of Diagnostic and Traceability Technologies for Food Poisoning,Beijing Center for Disease Prevention and Control,Beijing 100013,China)
Abstract:ObjectiveTo establish an ultra-high performance liquid chromatography tandem isotope dilution mass spectrometry method for the determination of three major allergens, such as lysozyme, egg transferrin and ovalbumin, from eggs in baked food. MethodsThe specific peptides of lysozyme, ovotransferrin and ovalbumin were first screened, and then the specific peptides and isotopic markers were synthesized. Samples were homogenized in a buffer solution of 200 mmol/L Tris-HCl (pH=8.0) for 2-3 times. The sample solution was mixed with trypsin in a proportion of 1∶ 50 (trypsin/protein ratio) and then placed on a shaking bed and hydrolyzed for 12 h at 37 ℃. The enzymatic hydrolysate was detected by the electrospray positive ion (ESI+) with multiple reaction monitoring (MRM) mode and quantified by an isotope dilution method. ResultsGood linear relationships within the ranges of 1-100 nmol/L with linear correlation coefficients (r2) above 0.995 was achieved for the calibration curves of nine specific peptides standards. The limits of quantitation(LOQ)of the three proteins in baked food were 0.4-10.0 μg/g. The recoveries of target proteins in baked food ranged from 65.0% to 108.5% with relative standard deviations (RSDs) less than 15.0%. ConclusionThe method is sensitive, specific and accurate. It is suitable for the detection of egg allergen proteins in baked food.
Key words:
Egg; allergens protein; lysozyme; egg transferrin; ovalbumin; food; hydrolyzed peptide; isotope dilution mass spectrometry
食物过敏是人们摄入致敏食物后机体对外源性物质产生的一种变态反应,轻则产生皮肤、胃肠道等过敏症状,重则休克甚至死亡,对人们的健康和生活造成不利影响[1]。全世界约有2%~3%的成人和至少8%的儿童对食物过敏[2],并且对食物过敏的人群还在逐年增加[3-4],食物致敏已成为国际上备受关注的食品安全和公共卫生问题。目前,国际公认的8大类致敏食物有牛奶、鸡蛋、鱼、甲壳类、花生、大豆、坚果类以及小麦,超过90%的食物致敏由以上8大类食物引起[5]。流行病学调查[6]显示,鸡蛋、牛奶、鱼、虾是导致我国食物过敏的主要因素,其中鸡蛋是诱发我国儿童食物过敏最主要的过敏原之一[7]。
随着食品工业的不断发展,食品配料的复杂化和多样化增加了加工食品的致敏风险,同时共用生产线增加了加工食品被其他过敏原污染的风险[8]。近年来,世界各国都相继推出了过敏原标签管理制度,以警示食物过敏患者。我国于2011年建议包装食品增加过敏原标签[9]。然而,仅靠单一的过敏原标签管理制度难以避免食物过敏事件的发生,还急需建立加工食品中致敏蛋白的精准检测方法,以加强加工食品中食物过敏原的监管。
目前,国内外用于检测食品中过敏原的方法主要有酶联免疫吸附(ELISA)法和聚合酶链式反应(PCR)法。PCR法无法实现定量分析[5],而ELISA法因存在交叉反应而易产生假阳性[10]。近年来,定量蛋白组学技术逐步应用于致敏蛋白检测。HEICK等[11]和PILOLLI等[12]建立了加工食品中牛奶、鸡蛋等致敏蛋白的液相色谱-串联质谱(LC-MS/MS)检测方法。该类方法虽然明显提高了致敏蛋白分析的准确性和灵敏性,但都只局限于鸡蛋中的单一主要致敏蛋白检测,忽略了食物加工过程中蛋白的变性和降解以及单一过敏原检测导致的假阴性结果。
本研究充分考虑加工过程中致敏蛋白的含量变化,建立了烘培食品中卵白蛋白、卵转铁蛋白和溶菌酶3种来源于鸡蛋的致敏蛋白的同位素稀释质谱检测定量方法,并用于面包、饼干共计26份实际样品的检测,获得理想结果。
溶菌酶(纯度>90%,CAS∶12650-88-3)、卵白蛋白(纯度>98%,CAS∶9006-59-1)、卵转铁蛋白(纯度>98%,CAS:1391-06-6)标准品均购自美国Sigma,二硫苏糖醇(DTT)溶液(1 mol/L),乙腈(含0.1%甲酸,LC-MS级),胰蛋白酶(蛋白组学级),RapiGest SF(1 mg,美国Waters),三羟甲基氨基甲烷-盐酸(Tris-HCl)溶液(1 mol/L,pH=8.0),盐酸(36%~38%)、碘乙酰胺(IAA,98%)、甲酸(99%)、碳酸氢铵(99%)、三氟乙酸(99%)均为分析纯,试验用水由Milli-Q Plus水净化系统制备(电阻率18.2 MΩ/cm)。
特异肽段标准品HGLDNYR(Lot. NO:GT21431-1)、FESNFNTQATNR(Lot. NO:GT21604-2)、GTDVQAWIR(Lot. NO:GT21604-3)、YFGYTGALR(Lot. NO:JT-60969)、KDSNVNWNNLK(Lot. NO:JT-60965)、IRDLLER(Lot. NO:GT21431-3)、LTEWTSS-NVMEER(Lot. NO:GT21431-6)、ISQAVHAAHAEIN-EAGR(Lot. NO:GT21431-7)、AFKDEDTQ-AMPFR(Lot. NO:JT-60961)以及同位素标记特异肽段HG[13C-15N-L]DNYR(Lot. NO:GT21431-8)、FESN[13C-15N-F]NTQATNR(Lot. NO:GT21604-26)、GTDVQAW[13C-15N-I]R(Lot. NO:GT21604-27)、KDSN[13C-15N-V]NWN-NLK(Lot. NO:JT-63615)、Y[13C-15N-F]GYTG-ALR(Lot. NO:JT-63614)、[13C-15N-I]RDLLER(Lot. NO:GT21431-10)、AFKDEDTQAMP[13C-15N-F]R(Lot. NO:JT-63616)、LTEWTSSN[13C-15N-V]MEER(Lot. NO:GT21431-13)、ISQA[13C-15N-V]HAAHAEINEAGR(Lot. NO:GT21431-14)纯度均>98%,由上海杰肽生物科技有限公司合成。
Tris-HCl溶液(200 mmol/L):准确移取1 mol/L Tris-HCl溶液20 ml置于100 ml容量瓶中,超纯水定容至100 ml;碳酸氢铵溶液(50 mmol/L):准确称取碳酸氢铵0.395 0 g置于100 ml容量瓶中,用超纯水溶解并定容至100 ml;碳酸氢铵溶液(50 mmol/L,含0.1% RapiGest):准确移取加入含有1 mg RapiGest SF试剂加入1 ml碳酸氢铵溶液(50 mmol/L)充分溶解;碘乙酰胺溶液(1 mol/L):准确称取碘代乙酰胺1.85 g于10 ml棕色容量瓶中,超纯水溶解并定容至10 ml,2~8 ℃避光保存;HCl溶液(0.1 mol/L):准确移取HCl(36%~38%)830 μl于1 000 ml容量瓶中,超纯水定容至100 ml;HCl溶液(1 mmol/L):准确移取HCl(0.1 mol/L)1 ml于100 ml容量瓶中,超纯水定容至100 ml;胰蛋白酶溶液(1 μg/μl):20 μg胰蛋白酶固体加入20 μl HCl(1 mmol/L)充分溶解,-80 ℃保存。
分别称取同位素内标标准品5.0 mg于5 ml容量瓶中,超纯水溶解并定容至刻度,分别配制成摩尔浓度为1.1 mmol/L(HG[13C-15N-L]DNYR)、0.7 mmol/L(FESN[13C-15N-F]NTQATNR)、1.0 mmol/L(GTDVQAW[13C-15N-I]R)、1.1 mmol/L([13C-15N-I]RDLLER)、0.7 mmol/L(KDSN[13C-15N-V]NWNNLK)、0.9 mmol/L(Y[13C-15N-F]GYTGALR)、0.6 mmol/L(LTEWTSSN[13C-15N-V]MEER)、0.6 mmol/L(ISQA[13C-15N-V]HAAHAE-INEAGR)、0.6 mmol/L(AFKDEDTQAMP[13C-15N-F]R)的储备液,分装后-80 ℃保存。
质谱:电喷雾离子源(ESI+);毛细管电压为3 kV;锥孔电压为30 V;离子源温度为110 ℃;脱溶剂气流速为800 L/min,温度为400 ℃;提高碰撞能量的母离子扫描(MSE)模式采集数据,低碰撞电压为6 eV,高碰撞电压为25~45 eV;采用人血纤维蛋白肽B作为校正溶液。
质谱:电喷雾离子源(ESI+);离子源接口电压为1.5 kV;雾化气为氮气,流速为2.0 L/min;加热气为空气,流速为15 L/min;干燥气为氮气,流速为5 L/min;碰撞气为氩气;离子源接口温度为300 ℃;脱溶剂管温度为150 ℃;加热模块温度为250 ℃;扫描模式为多反应监测(MRM);延迟时间为3 ms。
白中能检索到,具有很好的特异性。
运用Skyline软件预测各肽段的y、b离子碎片类型,母离子和子离子电荷数分别设置为1、2、3,将预测的离子对列表导入LabSolutions Ver. 5.85色谱工作站。通过对预四级偏转电压(Q1)、碰撞能量(CE)、预四级偏转电压(Q3)等质谱参数优化,保留各肽段响应值较高的2组离子对,结果见表3。
影响,因此,最佳酶解条件为胰蛋白酶与蛋白质的质量比为1∶50,在37 ℃振摇酶解12 h。
用上述标准曲线计算得到定量肽段的摩尔浓度(nx),再按照特异肽段与目标蛋白的摩尔比为1∶1的比例,计算目标蛋白的含量,公式为:
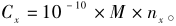
式中Cx为样品中目标蛋白的质量浓度,μg/g;
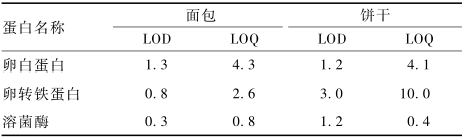
M为目标蛋白的分子量;nx为溶液中目标蛋白特异肽段的摩尔浓度,nmol/L。在面包和饼干空白基质中加入待测组分,定量肽段色谱峰信噪比(S/N)=3和S/N=10对应的蛋白浓度分别为方法的LOD和LOQ,结果见表6。
随着食品工业的不断发展,食品配料的复杂化和多样化增加了加工食品的致敏风险,同时共用生产线增加了加工食品被其他过敏原污染的风险[8]。近年来,世界各国都相继推出了过敏原标签管理制度,以警示食物过敏患者。我国于2011年建议包装食品增加过敏原标签[9]。然而,仅靠单一的过敏原标签管理制度难以避免食物过敏事件的发生,还急需建立加工食品中致敏蛋白的精准检测方法,以加强加工食品中食物过敏原的监管。
目前,国内外用于检测食品中过敏原的方法主要有酶联免疫吸附(ELISA)法和聚合酶链式反应(PCR)法。PCR法无法实现定量分析[5],而ELISA法因存在交叉反应而易产生假阳性[10]。近年来,定量蛋白组学技术逐步应用于致敏蛋白检测。HEICK等[11]和PILOLLI等[12]建立了加工食品中牛奶、鸡蛋等致敏蛋白的液相色谱-串联质谱(LC-MS/MS)检测方法。该类方法虽然明显提高了致敏蛋白分析的准确性和灵敏性,但都只局限于鸡蛋中的单一主要致敏蛋白检测,忽略了食物加工过程中蛋白的变性和降解以及单一过敏原检测导致的假阴性结果。
本研究充分考虑加工过程中致敏蛋白的含量变化,建立了烘培食品中卵白蛋白、卵转铁蛋白和溶菌酶3种来源于鸡蛋的致敏蛋白的同位素稀释质谱检测定量方法,并用于面包、饼干共计26份实际样品的检测,获得理想结果。
1材料与方法
1.1主要仪器与试剂
LC-30 A超高效液相色谱仪-串联LCMS-8060三重四极杆质谱仪(日本岛津),超高效液相色谱-飞行时间质谱仪(UPLC-Q-TOF)、ACQUITY UPLC BEH C18色谱柱(2.1 mm × 100 mm,1.7 μm)、ACQUITY UPLC Peptide CSHTM C18色谱柱(130 ,2.1 mm × 100 mm,1.7 μm)均购自美国Waters,Milli-Q超纯水机,台式微量离心机,空气浴振荡器,匀浆仪及匀浆管,酶标仪。溶菌酶(纯度>90%,CAS∶12650-88-3)、卵白蛋白(纯度>98%,CAS∶9006-59-1)、卵转铁蛋白(纯度>98%,CAS:1391-06-6)标准品均购自美国Sigma,二硫苏糖醇(DTT)溶液(1 mol/L),乙腈(含0.1%甲酸,LC-MS级),胰蛋白酶(蛋白组学级),RapiGest SF(1 mg,美国Waters),三羟甲基氨基甲烷-盐酸(Tris-HCl)溶液(1 mol/L,pH=8.0),盐酸(36%~38%)、碘乙酰胺(IAA,98%)、甲酸(99%)、碳酸氢铵(99%)、三氟乙酸(99%)均为分析纯,试验用水由Milli-Q Plus水净化系统制备(电阻率18.2 MΩ/cm)。
特异肽段标准品HGLDNYR(Lot. NO:GT21431-1)、FESNFNTQATNR(Lot. NO:GT21604-2)、GTDVQAWIR(Lot. NO:GT21604-3)、YFGYTGALR(Lot. NO:JT-60969)、KDSNVNWNNLK(Lot. NO:JT-60965)、IRDLLER(Lot. NO:GT21431-3)、LTEWTSS-NVMEER(Lot. NO:GT21431-6)、ISQAVHAAHAEIN-EAGR(Lot. NO:GT21431-7)、AFKDEDTQ-AMPFR(Lot. NO:JT-60961)以及同位素标记特异肽段HG[13C-15N-L]DNYR(Lot. NO:GT21431-8)、FESN[13C-15N-F]NTQATNR(Lot. NO:GT21604-26)、GTDVQAW[13C-15N-I]R(Lot. NO:GT21604-27)、KDSN[13C-15N-V]NWN-NLK(Lot. NO:JT-63615)、Y[13C-15N-F]GYTG-ALR(Lot. NO:JT-63614)、[13C-15N-I]RDLLER(Lot. NO:GT21431-10)、AFKDEDTQAMP[13C-15N-F]R(Lot. NO:JT-63616)、LTEWTSSN[13C-15N-V]MEER(Lot. NO:GT21431-13)、ISQA[13C-15N-V]HAAHAEINEAGR(Lot. NO:GT21431-14)纯度均>98%,由上海杰肽生物科技有限公司合成。
Tris-HCl溶液(200 mmol/L):准确移取1 mol/L Tris-HCl溶液20 ml置于100 ml容量瓶中,超纯水定容至100 ml;碳酸氢铵溶液(50 mmol/L):准确称取碳酸氢铵0.395 0 g置于100 ml容量瓶中,用超纯水溶解并定容至100 ml;碳酸氢铵溶液(50 mmol/L,含0.1% RapiGest):准确移取加入含有1 mg RapiGest SF试剂加入1 ml碳酸氢铵溶液(50 mmol/L)充分溶解;碘乙酰胺溶液(1 mol/L):准确称取碘代乙酰胺1.85 g于10 ml棕色容量瓶中,超纯水溶解并定容至10 ml,2~8 ℃避光保存;HCl溶液(0.1 mol/L):准确移取HCl(36%~38%)830 μl于1 000 ml容量瓶中,超纯水定容至100 ml;HCl溶液(1 mmol/L):准确移取HCl(0.1 mol/L)1 ml于100 ml容量瓶中,超纯水定容至100 ml;胰蛋白酶溶液(1 μg/μl):20 μg胰蛋白酶固体加入20 μl HCl(1 mmol/L)充分溶解,-80 ℃保存。
1.2方法
1.2.1标准储备液的配制
分别称取特异肽段标准品5.0 mg于5 ml容量瓶中,超纯水溶解并定容至刻度,分别配制成摩尔浓度为1.1 mmol/L(HGLDNYR)、0.7 mmol/L(FESNFNTQATNR)、1.0 mmol/L(GTDVQAWIR)、1.1 mmol/L(IRDLLER)、0.8 mmol/L(KDSNVNW-NNLK)、1.0 mmol/L(YFGYTGALR)、0.6 mmol/L(LTEWTSSNVMEER)、0.6 mmol/L(ISQAVHAAHAEI-NEAGR)、0.6 mmol/L(AFKDEDTQAMPFR)的储备液,分装后-80 ℃保存。分别称取同位素内标标准品5.0 mg于5 ml容量瓶中,超纯水溶解并定容至刻度,分别配制成摩尔浓度为1.1 mmol/L(HG[13C-15N-L]DNYR)、0.7 mmol/L(FESN[13C-15N-F]NTQATNR)、1.0 mmol/L(GTDVQAW[13C-15N-I]R)、1.1 mmol/L([13C-15N-I]RDLLER)、0.7 mmol/L(KDSN[13C-15N-V]NWNNLK)、0.9 mmol/L(Y[13C-15N-F]GYTGALR)、0.6 mmol/L(LTEWTSSN[13C-15N-V]MEER)、0.6 mmol/L(ISQA[13C-15N-V]HAAHAE-INEAGR)、0.6 mmol/L(AFKDEDTQAMP[13C-15N-F]R)的储备液,分装后-80 ℃保存。
1.2.2标准曲线的制作
分别移取一定量特异肽段及其同位素内标标准储备液,超纯水稀释后配制成浓度为1、2、5、10、20、50、100 nmol/L标准系列。其中同位素内标浓度为20 nmol/L。
1.2.3样品预处理
准确称取200 mg烘培食品样品于匀浆管中,加入1 ml 200 mmol/L Tris-HCl(pH=8.0)匀浆提取,匀浆仪中加入适量干冰。匀浆2~3次,每次20 s,14 000 r/min离心10 min,取上清液用Quick StartTM Bradford蛋白定量试剂盒和酶标仪测定总蛋白浓度,具体操作流程参照制造商说明。取500 μl总蛋白提取液于另一离心管中,加入1 μmol/L同位素内标20 μl混匀。取50 μl已加入同位素内标的提取液于1.5 ml离心管中,加入47 μl 50 mmol/L碳酸氢铵溶液(含0.1% RapiGest),混匀后加入0.5 μl 1 mol/L DTT溶液,37 ℃孵育60 min,冷却至室温后加入1.5 μl 1 mol/L IAA,室温避光放置30 min;按照胰蛋白酶与蛋白质的质量比为1∶50的比例加入酶液,37 ℃振摇酶解12 h。加入0.5 μl三氟乙酸,37 ℃振摇30 min,14 000 r/min离心10 min,取上清液分析。
1.2.4仪器条件
1.2.4.1UPLC-Q-TOF仪器条件
色谱:色谱柱:Waters ACQUITY UPLC BEH C18(2.1 mm × 100 mm,1.7 μm),进样体积为4 μl,流速为0.3 ml/min。流动相A:0.1%甲酸-乙腈,流动相B:0.1%甲酸-水,梯度洗脱:0.0~1.0 min 3%A;1.0~5.0 min 3%~15%A;5.0~20.0 min 15%~25%A;20.0~25.0 min 25%~50%A;25.0~25.1 min 50%~100%A;25.1~27.0 min 100%A;27.0~27.1 min 100%~3% A;27.1~30.0 min 3%A。质谱:电喷雾离子源(ESI+);毛细管电压为3 kV;锥孔电压为30 V;离子源温度为110 ℃;脱溶剂气流速为800 L/min,温度为400 ℃;提高碰撞能量的母离子扫描(MSE)模式采集数据,低碰撞电压为6 eV,高碰撞电压为25~45 eV;采用人血纤维蛋白肽B作为校正溶液。
1.2.4.2UPLC-MS/MS 仪器条件
色谱:色谱柱:Waters ACQUITY UPLC Peptide CSHTM C18(130 ,2.1 mm × 100 mm,1.7 μm);进样体积为10 μl;流速为0.3 ml/min;色谱柱温度为55 ℃。流动相A:0.1%甲酸-水,流动相B:0.1%甲酸-乙腈,梯度洗脱条件如表1所示。
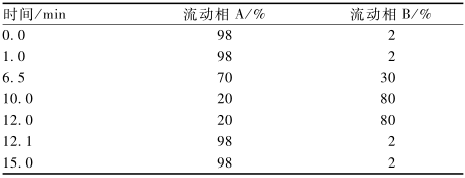
|
表1梯度洗脱程序 Table 1Binary solvent gradient |
2结果与分析
2.1特异水解肽段的筛选
本方法采用定量蛋白组学方法研究加工食品中的鸡蛋致敏蛋白,以蛋白水解肽段对蛋白进行定量,因此目标肽段的选择显得尤为重要。本方法综合考虑丰度、质谱离子响应强度、稳定性、特异性、修饰等因素,筛选合适的特异性蛋白水解肽段。对溶菌酶、卵转铁蛋白、卵白蛋白标准品进行胰蛋白酶酶解,运用UPLC-Q-TOF分析指纹肽谱,利用PLGS蛋白分析软件结合UniProt蛋白数据库检索肽段序列并筛选出几条高丰度、没有修饰的稳定肽段作为备选肽段,见图1。将备选肽段逐一用BLAST数据库检索确认特异水解肽段的特异性,最终筛选出3条目标蛋白的特异水解肽段。由表2可知,所有筛选出的9条肽段都只在鸡行目雉科动物的蛋
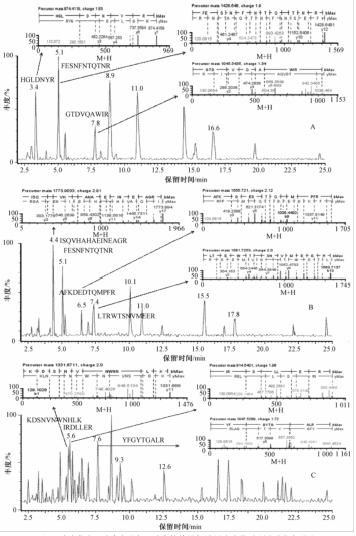
|
注:A为溶菌酶;B为卵白蛋白;C为卵转铁蛋白;大图为肽谱;小图为肽段序列图 图1鸡蛋致敏蛋白肽谱和肽段序列图 Figure 1MS spectra and peptide mapping of target proteins |
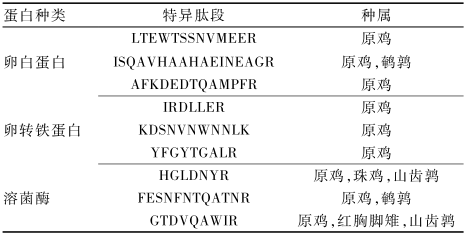
|
表2目标肽段BLAST检索结果 Table 2BLAST results of target peptides |
2.2仪器条件优化
CSHTM色谱柱在峰容量、峰形、灵敏度、载量等方面均优于BEH色谱柱,故本研究选用CSHTM肽分析专用柱。因目标肽段分子量均<2 kDa,130 即可满足使用。由于质谱使用正离子模式扫描,在流动相中添加少量甲酸可提供H+。比较甲酸和三氟乙酸对目标肽段色谱行为与质谱响应,结果显示含有甲酸的流动相体系目标肽段响应值和峰形明显优于三氟乙酸体系,因此选择0.1%甲酸-水和0.1%甲酸-乙腈作为流动相,各肽段及内标色谱图见图2。
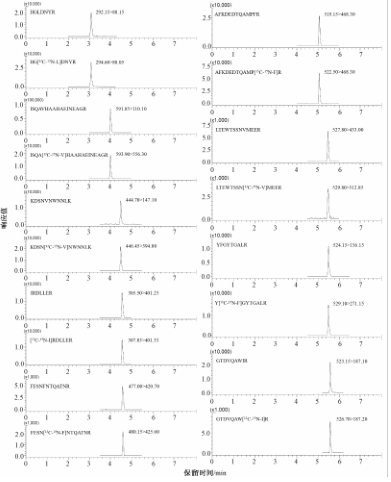
|
图2目标肽段及内标的色谱图 Figure 2UPLC-MS/MS chromatogram of target peptides |
2.3样品提取条件优化
稀盐溶液可促进蛋白质溶解,因此采用稀盐溶液提取蛋白。首先比较50 mmol/L碳酸氢铵(pH=9.0)[13-14]和200 mmol/L Tris-HCl(pH=8.0)[15]提取总蛋白的效果。取0.2 g样品于匀浆管中,分别加入1 ml上述2种提取液匀浆提取(n=5),酶标仪测总蛋白浓度,结果分别为(0.8±0.1)和(0.9±0.1)mg/ml,后者的提取效率明显优于前者,故选择Tris-HCl(pH=8.0)为提取液。
2.4酶解条件的选择
酶用量和酶解时间是影响酶解效率的重要因素,本研究对这两个因素进行了考察。将3种目标蛋白按蛋清中实际比例(54%卵白蛋白、12%卵转铁蛋白、3.5%溶菌酶)[16]配制成混合溶液后加入至空白基质样品后进行酶解,测定水解肽段的含量并计算实际酶解效率。结果如图3所示,定量肽段的酶解效率随时间的增加而升高并且在8 h后达到相对稳定的程度,而酶用量对酶解效率没有明显

|
表3目标肽段MRM参数 Table 3MRM conditions of target peptides 注:a表示定量肽段;b表示定量离子;+ +表示双电荷离子;+ + +表示三电荷离子 |
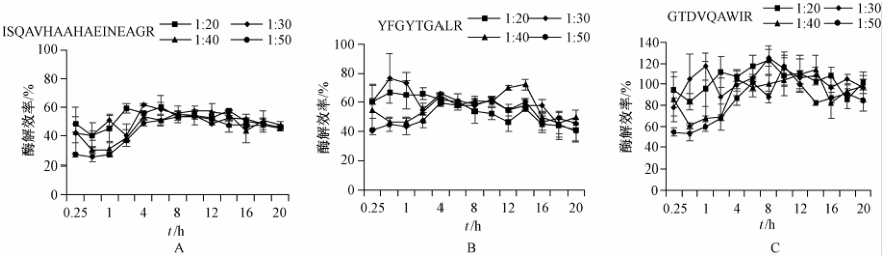
|
注:A为卵白蛋白;B为卵转铁蛋白;C为溶菌酶 图3酶解时间和酶用量对酶解效率的影响 Figure 3Influence of time and enzyme concentration on digestion efficiency |
2.5回收率和精密度
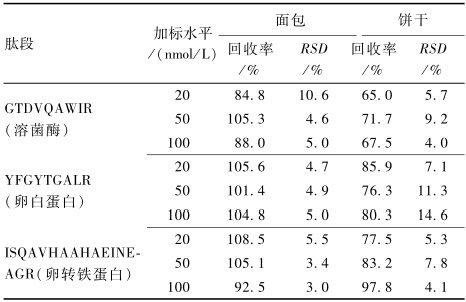
向面包和饼干空白基质中分别加入3个浓度水平(使目标肽段上机浓度为20、50、100 nmol/L)的3种蛋白标准品,每个浓度水平平行测6次。本方法定量肽段的回收率为65.0%~108.5%,相对标准偏差(RSD)<15.0%。3种鸡蛋致敏蛋白定量肽段的回收率和精密度见表4。
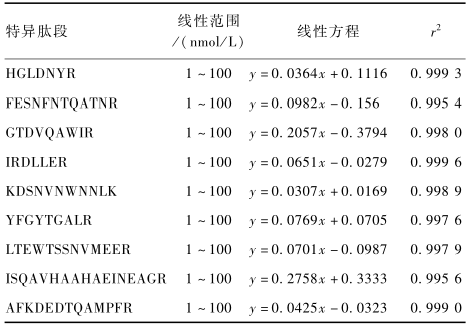
2.6线性关系、检出限(LOD)和定量限(LOQ)
在上述条件下,取适量标准储备液加入适量内标,配制成摩尔浓度分别为1、2、5、10、20、50、100 nmol/L,内标浓度为20 nmol/L的标准系列,UPLC-MS/MS分析,以峰面积y对相应的摩尔浓度x(nmol/L)作图,线性方程见表5,结果表明,所有肽段在1~100 nmol/L时对应的峰面积呈良好的线性关系,相关系数(r2)均>0.995。用上述标准曲线计算得到定量肽段的摩尔浓度(nx),再按照特异肽段与目标蛋白的摩尔比为1∶1的比例,计算目标蛋白的含量,公式为:
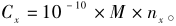
式中Cx为样品中目标蛋白的质量浓度,μg/g;
|
表4方法回收率结果和精密度(n=6) Table 4Results of recoveries and precision |
|
表5目标肽段的线性关系 Table 5Linear equations of target peptides |
|
表63种鸡蛋致敏蛋白的LOD及LOQ(μg/g) Table 6LOD and LOQ of target protein |
2.7实际样品的检测
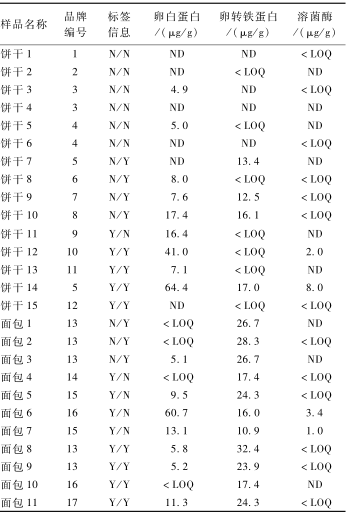
从北京某超市购得面包、饼干样品共26份,按本方法处理样品并检测,结果见表7。26份样品中,有过敏原标签标识提示的15份样品和含鸡蛋成分配料信息但缺乏过敏原标识信息的5份样品中均检出鸡蛋过敏原。6份缺乏过敏原标签标识和鸡蛋成分配料信息的饼干样品中也有5份样品检出鸡蛋过敏原,由此可见,这些没有过敏原标识的食品增加了过敏患者误食的风险。有必要建立相关检测标准,进一步加强加工食品的过敏原监管。
|
表7烘培食品中鸡蛋致敏蛋白含量 Table 7Contents of egg allergen proteins in 26 kinds of roasted food 注:N/N表示配料信息中没有列出鸡蛋,且没有过敏原标签提示;N/Y表示配料信息中没有列出鸡蛋,但是有过敏原标签提示;Y/N表示配料信息中有列出鸡蛋,但是没有有过敏原标签提示;Y/Y表示配料信息中有列出鸡蛋,同时有过敏原标签提示;ND表示未检出 |
3小结
本研究筛选了鸡蛋中3种致敏蛋白(溶菌酶、卵白蛋白、卵转铁蛋白)的特异肽段,合成了其标准品及同位素内标。建立了超高效液相色谱-串联质谱检测方法,并对烘培食品中3种致敏蛋白进行了检测。该技术将蛋白质组学和质谱技术结合起来,其特异性强、灵敏度高、可精确定量。方法经过改进优化可应用至其他致敏蛋白的检测,可为我国食品过敏原监测和监管提供技术支持。
参考文献
[1]WANG J, SAMPSON H A. Food allergy: recent advances in pathophysiology and treatment[J]. Allergy Asthma and Immunology Research, 2009, 1(1):19-29.
[2]MANEA I, AILENEI E, DELEANU D. Overview of food allergy diagnosis[J]. Clujul Medical, 2016, 89(1):5-10.
[3]BRANUM A M, LUKACS S L. Food allergy among U.S. children: trends in prevalence and hospitalizations[J]. Nchs Data Brief, 2008, 10(10):1-7.
[4]HU Y, CHEN J, LI H Q. Comparison of food allergy prevalence among Chinese infants in Chongqing, 2009 versus 1999[J]. Pediatrics International, 2010, 52(5):820-824.
[5]POMS R E, KLEIN C L, ANKLAM E. Methods for allergen analysis in food: a review[J]. Food Additives and Contaminants, 2004, 21(1):1-31.
[6]胡贻椿, 王睿, 朴建华,等. 中国城市3~12岁儿童IgE介导的食物过敏研究[J]. 卫生研究, 2015, 44(1):60-63.
[7]黄琼. 食物过敏性疾病的流行病学研究进展[J]. 国外医学(卫生学分册), 2009,36(6):374-377.
[8]ALLEN K J, TURNER P J, PAWANKAR R, et al. Precautionary labelling of foods for allergen content: are we ready for a global framework?[J]. World Allergy Organization Journal, 2014, 7(1):10-23.
[9]中华人民共和国卫生部. 食品安全国家标准 预包装食品标签通则:GB 7718—2011 [S]. 北京:中国标准出版社,2011.
[10]XI M, PENG S, HE P L, et al. Development of monoclonal antibodies and a competitive ELISA detection method for glycinin, an allergen in soybean[J]. Food Chemistry, 2010, 121(2):546-551.
[11]HEICK J, FISCHER M, PPPING B. First screening method for the simultaneous detection of seven allergens by liquid chromatography mass spectrometry[J]. Journal of Chromatography A, 2011, 1218(7):938-943.
[12]PILOLLI R, ANGELIS E D, MONACI L. Streamlining the analytical workflow for multiplex MS/MS allergen detection in processed foods[J]. Food Chemistry, 2017, 221(10):1747-1753.
[13]AZARNIA S, BOYE J I, MONGEON V, et al. Detection of ovalbumin in egg white, whole egg and incurred pasta using LC-ESI-MS/MS and ELISA[J]. Food Research International, 2013, 52(2):526-534.
[14]CHEN Q, ZHANG J S, KE X, et al. Quantification of bovine β-casein allergen in baked foodstuffs based on ultra-performance liquid chromatography with tandem mass spectrometry[J]. Food Additives and Contaminants Part A Chemistry Analysis Control Exposure and Risk Assessment, 2015, 32(1):25-34.
[15]PLANQUE M, ARNOULD T, DIEU M, et al. Advances in ultra-high performance liquid chromatography coupled to tandem mass spectrometry for sensitive detection of several food allergens in complex and processed foodstuffs[J]. Journal of Chromatography A, 2016, 1464(8):115-123.
[16]MINE Y. Recent advances in the understanding of egg white protein functionality[J]. Trends in Food Science and Technology, 1995, 6(7):225-232.
[2]MANEA I, AILENEI E, DELEANU D. Overview of food allergy diagnosis[J]. Clujul Medical, 2016, 89(1):5-10.
[3]BRANUM A M, LUKACS S L. Food allergy among U.S. children: trends in prevalence and hospitalizations[J]. Nchs Data Brief, 2008, 10(10):1-7.
[4]HU Y, CHEN J, LI H Q. Comparison of food allergy prevalence among Chinese infants in Chongqing, 2009 versus 1999[J]. Pediatrics International, 2010, 52(5):820-824.
[5]POMS R E, KLEIN C L, ANKLAM E. Methods for allergen analysis in food: a review[J]. Food Additives and Contaminants, 2004, 21(1):1-31.
[6]胡贻椿, 王睿, 朴建华,等. 中国城市3~12岁儿童IgE介导的食物过敏研究[J]. 卫生研究, 2015, 44(1):60-63.
[7]黄琼. 食物过敏性疾病的流行病学研究进展[J]. 国外医学(卫生学分册), 2009,36(6):374-377.
[8]ALLEN K J, TURNER P J, PAWANKAR R, et al. Precautionary labelling of foods for allergen content: are we ready for a global framework?[J]. World Allergy Organization Journal, 2014, 7(1):10-23.
[9]中华人民共和国卫生部. 食品安全国家标准 预包装食品标签通则:GB 7718—2011 [S]. 北京:中国标准出版社,2011.
[10]XI M, PENG S, HE P L, et al. Development of monoclonal antibodies and a competitive ELISA detection method for glycinin, an allergen in soybean[J]. Food Chemistry, 2010, 121(2):546-551.
[11]HEICK J, FISCHER M, PPPING B. First screening method for the simultaneous detection of seven allergens by liquid chromatography mass spectrometry[J]. Journal of Chromatography A, 2011, 1218(7):938-943.
[12]PILOLLI R, ANGELIS E D, MONACI L. Streamlining the analytical workflow for multiplex MS/MS allergen detection in processed foods[J]. Food Chemistry, 2017, 221(10):1747-1753.
[13]AZARNIA S, BOYE J I, MONGEON V, et al. Detection of ovalbumin in egg white, whole egg and incurred pasta using LC-ESI-MS/MS and ELISA[J]. Food Research International, 2013, 52(2):526-534.
[14]CHEN Q, ZHANG J S, KE X, et al. Quantification of bovine β-casein allergen in baked foodstuffs based on ultra-performance liquid chromatography with tandem mass spectrometry[J]. Food Additives and Contaminants Part A Chemistry Analysis Control Exposure and Risk Assessment, 2015, 32(1):25-34.
[15]PLANQUE M, ARNOULD T, DIEU M, et al. Advances in ultra-high performance liquid chromatography coupled to tandem mass spectrometry for sensitive detection of several food allergens in complex and processed foodstuffs[J]. Journal of Chromatography A, 2016, 1464(8):115-123.
[16]MINE Y. Recent advances in the understanding of egg white protein functionality[J]. Trends in Food Science and Technology, 1995, 6(7):225-232.
