DOi:10.13590/j.cjfh.2017.01.010
检测诺如病毒的罗氏LightMix Kit方法与行业标准方法(SN/T 2626—2010)的比较研究
(1.中国食品药品检定研究院,北京100050; 2.罗氏诊断试剂上海有限公司, 上海201101; 3.吉林省长春市食品药品检验中心,吉林 长春130012)
作者简介: 骆海朋男副主任检验技师研究方向为食品微生物学 E-mail:haipengluo123@ sina.com
通信作者: 崔生辉男研究员研究方向为食品微生物学及食品分子生物E-mail:cuishenghui@aliyun. com
收稿日期: 2016-12-27
摘要:目的 结合不同标准和规范方法,对罗氏LightMix Kit诺如病毒检测试剂盒(以下简称罗氏方法)进行评价。方法通过对217份门诊腹泻病人粪便标本和158份市场零售贝类样品中诺如病毒核酸平行检测,对比罗氏方法与我国SN/T 2626—2010《国境口岸诺如病毒检测方法》中逆转录-聚合酶链反应检测诺如病毒核酸方法(以下简称SN/T方法)对粪便标本与贝类样品中诺如病毒核酸检测结果的差异。结果粪便标本的罗氏方法检测阳性率为27.2%(59/217),而SN/T方法检测阳性率为17.5%(38/217),两方法结果一致率为85.7%,检出率差异有统计学意义(P<0.05)。贝类样品的罗氏方法检测阳性率为32.9%(52/158),SN/T方法检测阳性率为30.4%(48/158),两方法对诺如病毒检测结果的一致率为87.3%,检出率差异无统计学意义(P>0.05)。结论市场零售贝类样品中诺如病毒污染率较高,罗氏方法以其快速、简便、灵敏、可靠的优点值得在食品微生物检测行业推广。
关键词:
诺如病毒; 逆转录-聚合酶链反应; 粪便; 贝类; 检测方法; 比较; 食品安全
中图分类号: R155 文献标识码:A 文章编号:1004-8456(2017)01-0047-05
A comparative study of Roche LightMix Kit and the industry
standard method(SN/T 2626-2010) for the detection of Norovirus
standard method(SN/T 2626-2010) for the detection of Norovirus
(1.National Institute of Food and Drug Control,Beijing 100050,China; 2.Roche Diagnostics(Shanghai)Limited, Shanghai 201101, China; 3.Jilin Province Inspection Center for Food and Drug, Jilin Changchun 130012, China)
Abstract: Objective To compare LightMix Kit Norovirus detection kit from Roche diagnostics company(hereinafter referred to as “Roche method”) with different methods of standards and norms. MethodsTwo hundred and twenty-seven stool samples of diarrhea patients and 158 shellfish samples from retail markets were detected by Roche method and SN/T 2626-2010 detection of Norovirus at frontier port reverse transcription polymerase chain reaction to detect Norovirus method(hereinafter referred to as SN/T method). By parallel detection, the differences between the two methods were compared. ResultsFor stool samples, about 27.2%(59/217)stool samples were positive by Roche method, while 17.5% (38/217) samples were positive by SN/T method. The consistence between the two methods was 85.7% and the detection rate of Roche methods was significantly higher than that of SN/T method(P<0.05). For shellfish samples, about 32.9%(52/158)shellfish samples were positives by Roche method and 30.4%(48/158)samples were positive by SN/T method. The consistence between the two methods was 87.3% and the detection rate had no significant difference(P>0.05).ConclusionThe Norovirus contamination of shellfish samples from retail market was high. Roche method was rapid, simple, sensitive and reliable to detect Norovirus, and was worthy to promote in food microbiology testing industry.
Key words:
Norovirus; reverse transcription polymerase chain reaction; stool; shellfish; detection method; comparison; food safety
诺如病毒(Norovirus,NoV)是全球范围内主要的腹泻病原体之一,每年感染病例数远超沙门菌、弯曲菌等常见致病细菌,在学校、饭店、医院等人员密集场所时有感染暴发的报道[1-2]。诺如病毒属于杯状病毒科中诺如病毒属的原型代表株,依据病毒衣壳蛋白VP1序列的差异,诺如病毒可分为GI~GV五个基因群,其中引起人类感染的主要是GI和GII群[3]。 目前诺如病毒的检测方法主要有分子生物学和免疫学方法两大类,其中分子生物学方法中的逆转录-聚合酶链式扩增反应(reversed transcript polymerase chain reaction,RT-PCR)方法相对较特异、灵敏,在食品污染物检测中应用广泛[4]。国内和国际诺如病毒检验规范中,均有以RT-PCR原理为基础的标准检验方法[5-8]。鉴于诺如病毒在食品安全中的重要地位,不同检测试剂公司也开发了一系列针对诺如病毒的检测试剂盒。
本试验主要参考欧盟ISO/TS 15216《Microbiology of food and animal feed-horizontal method for determi-nation of hepatitis A virus and Norovirus in food using real-time PCR》[7]方法中的前处理方法,比较罗氏LightMix Kit(以下简称罗氏方法)与SN/T 2626—2010《国境口岸诺如病毒检测方法》[5]中RT-PCR检测诺如病毒核酸方法(以下简称SN/T方法)对门诊腹泻病人粪便标本和零售贝类样品中诺如病毒检测结果的异同。
蛋白酶K、recombinant、PCR Grade、High pure viral RNA Kit、Lightcycler 480 RNA Master Hydr-olysis Probes和 LightMix Kit Norovirus均购自罗氏公司,磷酸盐缓冲液,本研究所使用的PAGE级PCR引物由上海英俊公司合成,诺如病毒阳性质控样品(中国食品药品检定研究院),One-step RT-PCR试剂盒(大连宝生物公司)。
贝类样品病毒RNA提取: 参照ISO/TS 15216方法,取5个贝类样品解剖,将分离的消化腺和肠道组织混合均质,称取均质液(2.0±0.1) g,加入2 ml磷酸盐溶液和0.2 mg蛋白酶K,37 ℃振荡1 h后,60 ℃水浴15 min,3 000×g离心5 min,取上清200 μl,用High pure viral RNA提取试剂盒提取RNA,将提取物-80 ℃保存备用。
罗氏方法: 采用荧光定量RT-PCR方法,可以检测GI和GII;扩增的区域为ORF1和ORF2链接区域,扩增产物大小为94 bp,使用荧光DNA水解探针,检测阳性则在530 nm通道检测有信号增强;使用MS2噬菌体RNA片段作为内控,对该片段进行扩增,在610 nm通道检测;使用特异性探针与扩增产物片段杂交,在670 nm通道检测,如果有溶解曲线信号出现,则认为是GII型诺如病毒检出,如没有溶解曲线的出现则是GI型诺如病毒检出。由于涉及该公司的技术保密问题,具体的引物和探针的序列没有详细的公开。参照该试剂盒的说明书,对从上述标本和样品中提取的RNA进行诺如病毒检测,如检出诺如病毒,则使用Lightcycler 480SW1.5.1软件对扩增产物进行分析,判断诺如病毒的具体型别,具体判断标准见表1。同时还使用了诺如病毒质控对病毒RNA的提取过程进行监测,如外部质控没有检出,可能在RNA提取过程存在问题。
检验结果一致率=[(两种方法均确证为阳性样品数量+两种方法均确证为阴性样品数量)/样品检测总数)]×100%
本试验主要参考欧盟ISO/TS 15216《Microbiology of food and animal feed-horizontal method for determi-nation of hepatitis A virus and Norovirus in food using real-time PCR》[7]方法中的前处理方法,比较罗氏LightMix Kit(以下简称罗氏方法)与SN/T 2626—2010《国境口岸诺如病毒检测方法》[5]中RT-PCR检测诺如病毒核酸方法(以下简称SN/T方法)对门诊腹泻病人粪便标本和零售贝类样品中诺如病毒检测结果的异同。
1材料与方法
1.1材料
1.1.1样品来源
2014年10月—2015年2月,从中国人民解放军总医院腹泻门诊收集腹泻病人粪便标本217份;2015年10月—2016年2月,从北京市市场采集贝类样品158份,其中:生蚝57份、牡蛎33份、海虹34份、扇贝15份、蛤蜊19份,均用于本方法验证研究。
1.1.2主要仪器与试剂
Lightcycler 480荧光定量PCR仪(罗氏公司)、普通PCR仪(美国伯乐)、碎花制冰机、高速冷冻离心机、恒温混匀器、电子天平、生物安全柜。蛋白酶K、recombinant、PCR Grade、High pure viral RNA Kit、Lightcycler 480 RNA Master Hydr-olysis Probes和 LightMix Kit Norovirus均购自罗氏公司,磷酸盐缓冲液,本研究所使用的PAGE级PCR引物由上海英俊公司合成,诺如病毒阳性质控样品(中国食品药品检定研究院),One-step RT-PCR试剂盒(大连宝生物公司)。
1.2方法
1.2.1样品前处理
粪便标本中病毒RNA提取: 取约0.1 g软便或0.1 ml稀便标本,加入1 ml磷酸盐溶液(pH=7.4),涡旋振荡混匀,5 000×g离心5 min,取上清200 μl,用High pure viral RNA 提取试剂盒,按使用说明提取病毒RNA,将提取物-80 ℃保存备用。贝类样品病毒RNA提取: 参照ISO/TS 15216方法,取5个贝类样品解剖,将分离的消化腺和肠道组织混合均质,称取均质液(2.0±0.1) g,加入2 ml磷酸盐溶液和0.2 mg蛋白酶K,37 ℃振荡1 h后,60 ℃水浴15 min,3 000×g离心5 min,取上清200 μl,用High pure viral RNA提取试剂盒提取RNA,将提取物-80 ℃保存备用。
1.2.2诺如病毒RT-PCR检测
SN/T方法: 采用常规RT-PCR方法,上游引物JV12:ATACCACTATGATGCAGATTA,下游引物JV13:TCATCATCACCATAGAAAGAG,其扩增的区域为诺如病毒RNA聚合酶区域,目的片段大小为326 bp。用上述标本和样品中提取的RNA进行诺如病毒检测,如电泳后出现标准中指定的诺如病毒预期产物,且阴性对照未检出,阳性对照检出则判断诺如病毒检测结果为阳性。然后对扩增产物进行序列测定,使用Mega5软件,将测得的序列与GenBank中权威参考诺如病毒序列进行比对分析,判断诺如病毒的具体型别。罗氏方法: 采用荧光定量RT-PCR方法,可以检测GI和GII;扩增的区域为ORF1和ORF2链接区域,扩增产物大小为94 bp,使用荧光DNA水解探针,检测阳性则在530 nm通道检测有信号增强;使用MS2噬菌体RNA片段作为内控,对该片段进行扩增,在610 nm通道检测;使用特异性探针与扩增产物片段杂交,在670 nm通道检测,如果有溶解曲线信号出现,则认为是GII型诺如病毒检出,如没有溶解曲线的出现则是GI型诺如病毒检出。由于涉及该公司的技术保密问题,具体的引物和探针的序列没有详细的公开。参照该试剂盒的说明书,对从上述标本和样品中提取的RNA进行诺如病毒检测,如检出诺如病毒,则使用Lightcycler 480SW1.5.1软件对扩增产物进行分析,判断诺如病毒的具体型别,具体判断标准见表1。同时还使用了诺如病毒质控对病毒RNA的提取过程进行监测,如外部质控没有检出,可能在RNA提取过程存在问题。
1.3统计学分析
使用SPSS 19.0软件中卡方检验程序,对诺如病毒检验结果的差异进行分析。按如下公式,对检验结果一致性进行分析:检验结果一致率=[(两种方法均确证为阳性样品数量+两种方法均确证为阴性样品数量)/样品检测总数)]×100%
2结果
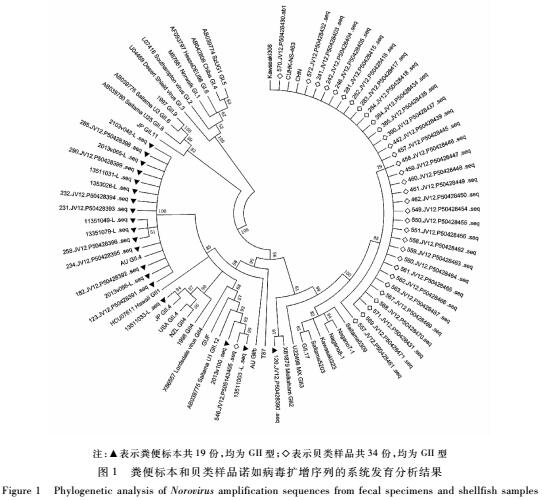
2.1粪便标本和贝类样品诺如病毒扩增序列的系统发育分析
使用Mega5软件对粪便标本和贝类样品SN/T方法成功测序的序列与GenBank中已有的诺如病毒序列进行比对分析,结果见图1。

|
表1Lightcycler 480SW1.5.1检测结果的判定标准
Table 1Criteria for determination of test results by Lightcycler 480SW1.5.1注:FAM为5-羧基荧光素
|
|
注:▲表示粪便标本共19份,均为GII型;◇表示贝类样品共34份,均为GII型
图1粪便标本和贝类样品诺如病毒扩增序列的系统发育分析结果
Figure 1Phylogenetic analysis of Norovirus amplification sequences from fecal specimens and shellfish samples
|
2.2门诊腹泻病人粪便标本中诺如病毒检测
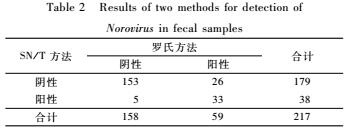
217份粪便标本中,用罗氏方法检测,诺如病毒阳性率为27.2%(59/217),而用SN/T方法检测,诺如病毒阳性率为17.5%(38/217),两方法结果一致率为85.7%,罗氏方法对诺如病毒的检出率高于SN/T方法,差异有统计学意义(P<0.05),详见表2。
|
表2两种方法对粪便标本中诺如病毒的检测结果(份)
Table 2Results of two methods for detection of
Norovirus in fecal samples
|
通过对扩增产物溶解曲线分析发现,罗氏方法检出的59份阳性粪便标本中,57份为GII型,2份为GI型;对SN/T方法检测出的38份阳性标本 扩增产物进行测序分析,其中19份标本PCR产物测序成功,经与GenBank中已有病毒序列比对发现均为GII型,用SN/T方法未检出GI型诺如病毒。
2.3贝类样品中诺如病毒检测
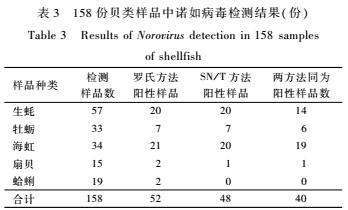
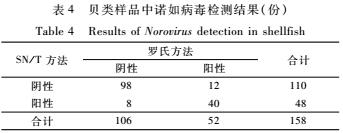
对158份贝类样品采用罗氏方法和SN/T方法进行检验,具体种类及详细检测结果见表3。158份贝类样品中,用罗氏方法进行检测,诺如病毒检出率为32.9%(52/158),而用SN/T方法的检出率为30.4%(48/158),两方法对诺如病毒检测结果的一致率为87.3%,检出率差异无统计学意义(P>0.05),详见表4。
|
表3158份贝类样品中诺如病毒检测结果(份)
Table 3Results of Norovirus detection in 158 samples
of shellfish
|
|
表4贝类样品中诺如病毒检测结果(份)
Table 4Results of Norovirus detection in shellfish
|
通过对扩增产物溶解曲线分析发现,罗氏方法检出的52份阳性样品中,49份为GII型,3份为GI型;对SN/T方法检测出的48份阳性样品扩增产物进行测序分析,其中34份样品测序成功,经与GenBank中已有序列进行比对,发现均为GII型,用SN/T方法未检出GI型诺如病毒。
3讨论
本研究平行使用罗氏和SN/T方法,对217份门诊腹泻病人粪便标本和158份市场采集的贝类样品中诺如病毒检测进行了对比测试分析,结果显示罗氏方法对粪便标本中诺如病毒的检出率高于SN/T方法,差异有统计学意义(P<0.05),而对贝类样品,两方法的检出率差异无统计学意义(P>0.05)。此结果提示,罗氏方法使用的引物和探针对腹泻病人粪便标本和贝类样品中的诺如病毒均有较好的覆盖性,可分别适用于两类样本的检测,此结果为今后食品病毒检测用分子试剂盒的比对分析提供了参考数据。
本研究结果显示,针对粪便标本,两方法诺如病毒的检出率存在明显差异,而对贝类样品,两方法的检出率差异较小。根据对粪便和贝类诺如病毒阳性分型结果,粪便标本中的诺如病毒型别较多,而贝类样品中诺如病毒型别较单一,这可能是两方法所使用引物对不同病毒种类的覆盖性不同造成的。首先,罗氏方法的扩增位点为GI和 GII诺如病毒ORF1和ORF2链接区域[9-10],结合溶解曲线分析可区分I和II型诺如病毒,而SN/T方法扩增的区域为ORF1区域中的RNA依赖的聚合酶片段[11],这一检测靶点的差异可能对检测结果造成一定影响。另外,本研究使用的粪便标本来自门诊腹泻病人,阳性标本中病毒序列的多样性可能高于来源相对集中的近海养殖的贝类样品。罗氏方法为增强覆盖性,引物和探针使用了简并序列,这可能也是造成与SN/T方法检出阳性率差异的原因之一。
在方法设计上,罗氏方法存在一定的优越性。该方法使用噬菌体MS2 RNA作为RT-PCR扩增反应的内部阳性质控,而SN/T方法是采用传统的PCR扩增和电泳方法,未设置内部质控,不能识别RNA提取物中是否存在对RT-PCR扩增过程的抑制剂。其次,罗氏方法结合溶解曲线分析,可直接区分I和II型诺如病毒,而SN/T方法则需要对扩增产物进行测序,才能区分诺如病毒的具体型别,鉴于PCR扩增产物的浓度时常较低,如本研究结果显示,较容易出现测序失败。
综上,本研究显示,北京冬季市场采集的贝类样品中,诺如病毒污染率较高,SN/T方法和罗氏方法均可用于贝类样品中诺如病毒的检测,而罗氏方法以其快速、方便,且准确性与SN/T方法相当的特点值得在食品微生物检测行业推广。
参考文献
[1]GUO Z N,HUANG J W,SHI G Q,et al.A food-borne outbreak of gastroenteritis caused by Norovirus GII in a university located in Xiamen City,China[J].International Journal of Infectious Diseases,2014,28(6):101-106.
[2]Maritschnik S,Kanitz E E,Simons E,et al.A food handler-associated,foodborne Norovirus GII.4 Sydney 2012-outbreak following a wedding dinner,Austria,October 2012[J].Food and Environmental Virology,2013,5(4):220-225.
[3]Verhoef L,Hewitt J,Barclay L,et al.Norovirus genotype profiles associated with foodborne transmission, 1999-2012[J].Emerging Infectious Diseases,2015,21(4):592-599.
[4]Vinje J.Advances in laboratory methods for detection and typing of Norovirus[J].Journal of Clinical Microbiology,2015,53(2):373-381.
[5]中华人民共和国国家质量监督检验检疫总局.SN/T 2626—2010 国境口岸诺如病毒检测方法[S].北京:中国标准出版社,2010.
[6]Alain H,Danielle L,Elyse P,et al.Detection of Norovirus genogfroups I and II using the conventional and real-time reverse-transcriptase polymerase chain reaction[EB/OL].(2010-03-20)[2016-07-26].https://www.researchgate.net/publication/234130767.
[7]International Organization for Standardization.ISO/TS 15216-1 Microbiology of food and animal feed-horizontal method for determination of hepatitis A virus and Norovirus in food using real-time PCR[S/OL].(2013-03-15)[2016-07-26].http://www.iso.org/iso/catalogue_detail.htm?csnumber=55382.
[8]中华人民共和国国家质量监督检验检疫总局.SN/T 1635—2005 贝类中诺沃克病毒检测方法 普通RT-PCR方法和实时荧光RT-PCR方法[S].北京:中国标准出版社,2005.
[9]Hoehne M,Schreier E.Detection of Norovirus genogroup I and II by multiplex real-time RT-PCR using a 3′-minor groove binder-DNA probe[J].BMC Infectious Disease,2006,6(1):69.
[10]Dreier J,Stormer M,Maede D,et al.Enhanced reverse transcription-PCR assay for detection of Norovirus genogroup I[J].J Clin Microbiol,2006,44(8):2714-2720.
[11]Jan V,Marion P K.Molecular detection and epidemiology of small round-structured viruses in outbreaks of gastroenteritis in the Netherlands[J].The Journal of Infectious Diseases,1996,174(3):610-615.
[2]Maritschnik S,Kanitz E E,Simons E,et al.A food handler-associated,foodborne Norovirus GII.4 Sydney 2012-outbreak following a wedding dinner,Austria,October 2012[J].Food and Environmental Virology,2013,5(4):220-225.
[3]Verhoef L,Hewitt J,Barclay L,et al.Norovirus genotype profiles associated with foodborne transmission, 1999-2012[J].Emerging Infectious Diseases,2015,21(4):592-599.
[4]Vinje J.Advances in laboratory methods for detection and typing of Norovirus[J].Journal of Clinical Microbiology,2015,53(2):373-381.
[5]中华人民共和国国家质量监督检验检疫总局.SN/T 2626—2010 国境口岸诺如病毒检测方法[S].北京:中国标准出版社,2010.
[6]Alain H,Danielle L,Elyse P,et al.Detection of Norovirus genogfroups I and II using the conventional and real-time reverse-transcriptase polymerase chain reaction[EB/OL].(2010-03-20)[2016-07-26].https://www.researchgate.net/publication/234130767.
[7]International Organization for Standardization.ISO/TS 15216-1 Microbiology of food and animal feed-horizontal method for determination of hepatitis A virus and Norovirus in food using real-time PCR[S/OL].(2013-03-15)[2016-07-26].http://www.iso.org/iso/catalogue_detail.htm?csnumber=55382.
[8]中华人民共和国国家质量监督检验检疫总局.SN/T 1635—2005 贝类中诺沃克病毒检测方法 普通RT-PCR方法和实时荧光RT-PCR方法[S].北京:中国标准出版社,2005.
[9]Hoehne M,Schreier E.Detection of Norovirus genogroup I and II by multiplex real-time RT-PCR using a 3′-minor groove binder-DNA probe[J].BMC Infectious Disease,2006,6(1):69.
[10]Dreier J,Stormer M,Maede D,et al.Enhanced reverse transcription-PCR assay for detection of Norovirus genogroup I[J].J Clin Microbiol,2006,44(8):2714-2720.
[11]Jan V,Marion P K.Molecular detection and epidemiology of small round-structured viruses in outbreaks of gastroenteritis in the Netherlands[J].The Journal of Infectious Diseases,1996,174(3):610-615.
 骆海朋,康敏华,于海瑶,高飞,任秀,余文,崔生辉.检测诺如病毒的罗氏LightMix Kit方法与行业标准方法(SN/T 2626—2010)的比较研究[J].中国食品卫生杂志,2017,29(1):47-51.
骆海朋,康敏华,于海瑶,高飞,任秀,余文,崔生辉.检测诺如病毒的罗氏LightMix Kit方法与行业标准方法(SN/T 2626—2010)的比较研究[J].中国食品卫生杂志,2017,29(1):47-51.