DOi:10.13590/j.cjfh.2017.02.003
食源性沙门菌毒力岛基因分布及特征研究
(1.白求恩国际和平医院传染肝病科,河北 石家庄050082; 2.石家庄市疾病预防控制中心微生物检验所,河北 石家庄050011)
作者简介: 牛莉娅女主治医师研究方向为感染性疾病的临床诊治E-mail:83040073@qq.com
通信作者: 郭玉梅女主管技师研究方向为病原菌分子分型与耐药E-mail:guokexin2199@163.com
2017-02-04
摘要:目的 研究食源性沙门菌毒力岛的分布特征及其与食物中毒的关系。方法收集市售食品、市售生鸡肉、食物中毒标本沙门菌分离株,进行血清学分型,并应用聚合酶链式反应方法检测沙门菌毒力岛(Salmonella pathogenicity island,SPI)基因SPI1~SPI5,进行统计学分析。结果152株沙门菌菌株中,检出16种血清型,以肠炎沙门菌为优势血清型,不同来源的该血清型菌株的毒力岛谱型有差异。SPI1在食物中毒菌株中检出率最高,市售生鸡肉SPI1的携带率高于市售食品。结论沙门菌的毒力岛谱型分布与菌株的不同来源相关,其中SPI1与沙门菌食物中毒呈正相关,市售生鸡肉有引起沙门菌食物中毒的潜在风险。
关键词:
食源性致病菌; 沙门菌; 毒力岛; 分布; 特征; 食物中毒
文章编号:1004-8456(2017)02-0131-05 中图分类号: R155 文献标识码:A
Distribution and characteristics of the pathogenicity island of foodborne Salmonella
(1.Department of Infectious and Liver disease, Bethune International Peace Hospital,Hebei Shijiazhuang 050082,China; 2.Shijiazhuang Center for Disease Control and Prevention, Hebei Shijiazhuang 050011,China)
2017-02-04
Abstract:Objective To study the distribution characteristics and correlation of the pathogenicity island of the foodborne Salmonella.MethodsThe Salmonella isolates were collected from commercial food, commercial raw chicken, and food poisoning samples. The serotype of Salmonella was determined by serology agglutinating method. SPI gene core protein genes SPI1-SPI5 of Salmonella were detected by polymerase chain reaction. The data were statistically analyzed. ResultsAmong the 152 isolates, Salmonella enteritidis was the most common serotype. There were different pathogenicity island type spectrums from different sources. The highest rate of SPI1 was detected in food poisoning strains. SPI1 carrying rate of raw chicken isolates was significantly higher than other commercially foods.ConclusionSalmonella pathogenicity island type spectrum distribution related to the strain of different sources, pathogenicity island gene SPI1 was positively correlated with the food poisoning caused by Salmonella. There is a potential risk of food poisoning caused by raw chicken.
Key words:
Foodborne pathogens; Salmonella; pathogenicity island; distributed; feature; food poisoning
沙门菌属(Salmonella)是一类无芽胞革兰阴性杆菌,是重要的肠道致病菌,广泛存在于自然界,经常污染食品、水体和土壤,引起动物和人类的感染[1]。由于沙门菌不分解蛋白质,受污染的食品通常没有明显的感官性状变化,所以其危害更大[2]。进出口食品安全检测监控项目中,沙门菌属于不得检出的微生物种类。沙门菌引起的食物中毒主要表现为呕吐、腹痛、腹泻、发热等急性胃肠炎症状,有一定的病死率[3]。沙门菌感染宿主是一个复杂的过程[4],其中对宿主引起致病的毒力基因主要集中在沙门菌毒力岛(Salmonella pathogenicity island,SPI)上[5-6]。因此近年来,SPI日益成为国际研究的热点。
毒力岛是一簇毒力基因相对集中的一段基因,它编码各种毒力因子,具有明显的致病遗传元素,在沙门菌入侵肠道上皮细胞过程中扮演重要角色[7]。通过对外文现有文献的总结,已有23个SPI(SPI1~SPI23)被鉴定出来[8],其中对SPI1~SPI5研究较为深入[9]。国内对沙门菌致病力的研究多集中在血清型和毒力基因方面,对SPI的研究较少。考虑到鸡是沙门菌最大的储存宿主[10-12],本研究对各市售食品、市售生鸡肉中沙门菌的污染情况进行了调查,与食物中毒及医院腹泻患者标本分离株进行对比,探讨毒力岛基因的携带情况与食物中毒的相关性。
1材料与方法
1.1.2主要仪器与试剂
BD Phoenix 100全自动细菌鉴定及药敏系统(美国BD)、veriti型PCR扩增仪(美国AB)、xcel型全自动毛细管电泳仪(德国Qiagen)。
亚硒酸盐胱氨酸增菌液、尿素酶生化管、SS琼脂、HE琼脂均购自北京陆桥技术股份有限公司,沙门显色培养基(法国科马嘉),API 20E(法国梅里埃),沙门菌属诊断血清(宁波天润生物药业有限公司),5×Buffer、Taq酶、dNTP、PCR引物均购自大连宝生物工程有限公司。
通过统计学分析,食物中毒株与其他两类菌株中SPI2+SPI3+SPI4+SPI5谱型差异有统计学意义(P<0.05),食物中毒株未检出该谱型。食物中毒株与生鸡肉分离株中仅携带SPI1谱型差异有统计学意义(P<0.05),生鸡肉分离株中未检出该谱型。
目前已发现沙门菌2 000余种,血清多达2 500多种[19],其引起的食物中毒与沙门菌株的SPI相关。已鉴定出的23个SPI,均为国外报道[20],随着分子生物学方法不断更新,是否还有未知毒力岛存在,仍是目前的研究热点。国内对沙门菌毒力岛的研究目前仍处于起步阶段,仅有少数报道[14,20-21],其中研究早且较为深入的是SPI1~SPI5。
2013—2016年石家庄地区沙门菌的血清型种类非常多,以肠炎沙门菌为优势血清型,另外还有15种散发血清型。本研究显示,同一血清型沙门菌可以出现不同的毒力岛谱型,沙门菌的毒力岛谱型分布与菌株的不同来源相关,与国外报道[22]一致。
本研究对152株沙门菌的5个主要毒力岛核心蛋白基因进行检测的结果,与田质高[14]的研究结果略有差异,其中SPI1~SPI4检出率大致符合,而SPI5检出率略低,这可能与采集的样品不同有关。本研究发现,携带SPI1与沙门菌食物中毒呈正相关,而携带SPI3、SPI4、SPI5与沙门菌食物中毒无相关性。SPI1与沙门菌食物中毒关系密切,与国外报道结果[23-26]符合,SPI1编码与侵袭力有关的Ⅲ型分泌系统1(type Ⅲ secretion system 1,T3SS1)。而SPI3、SPI4、SPI5与食物中毒无关,据报道[7,27],SPI3可能与沙门菌在巨噬细胞内存活有关,可参与沙门菌在肠道的长期定植机制;SPI4编码的T1SS为沙门菌在小牛及其他一些哺乳动物体内定植所需,但其功能还未明确[7];SPI5编码pipA、pipB、pipC、pipD等基因[7]。与王晶钰等[20]的研究相比,不同的是,本研究未发现SPI2与食物中毒有关;而相同的是,也未发现其他毒力岛谱型与沙门菌食物中毒有关。目前人们普遍认为SPI2是沙门菌在细胞内存活和发挥毒力的重要毒力岛,它如何调控炎性反应已成为目前研究的热点[28-29]。
本研究中市售生鸡肉SPI1的携带率高于市售食品,有引起食物中毒的潜在风险,因此,食品卫生监管应加强对市售生鸡肉的冷链储存及运输等环节监管,防止沙门菌污染食品引起食源性疾病的暴发。
毒力岛是一簇毒力基因相对集中的一段基因,它编码各种毒力因子,具有明显的致病遗传元素,在沙门菌入侵肠道上皮细胞过程中扮演重要角色[7]。通过对外文现有文献的总结,已有23个SPI(SPI1~SPI23)被鉴定出来[8],其中对SPI1~SPI5研究较为深入[9]。国内对沙门菌致病力的研究多集中在血清型和毒力基因方面,对SPI的研究较少。考虑到鸡是沙门菌最大的储存宿主[10-12],本研究对各市售食品、市售生鸡肉中沙门菌的污染情况进行了调查,与食物中毒及医院腹泻患者标本分离株进行对比,探讨毒力岛基因的携带情况与食物中毒的相关性。
1材料与方法
1.1材料
1.1.1菌株来源
152株沙门菌菌株分离自2013—2016年石家庄地区的市售食品、市售生鸡肉、食物中毒标本。其中95株分离自市售生鸡肉样品,22株分离自其他市售食品,35株分离自食物中毒标本(包括中毒食品及临床腹泻患者吐泻标本)。1.1.2主要仪器与试剂
BD Phoenix 100全自动细菌鉴定及药敏系统(美国BD)、veriti型PCR扩增仪(美国AB)、xcel型全自动毛细管电泳仪(德国Qiagen)。
亚硒酸盐胱氨酸增菌液、尿素酶生化管、SS琼脂、HE琼脂均购自北京陆桥技术股份有限公司,沙门显色培养基(法国科马嘉),API 20E(法国梅里埃),沙门菌属诊断血清(宁波天润生物药业有限公司),5×Buffer、Taq酶、dNTP、PCR引物均购自大连宝生物工程有限公司。
1.2方法
1.2.1菌株血清型测定
参照GB 4789.4—2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》[13]进行血清学分型。
1.2.2细菌DNA模板的制备
采用煮沸法提取细菌的DNA模板,刮取纯培养菌落至200 μl无菌纯水中制成菌悬液,100 ℃煮沸10 min,冰浴5 min,4 ℃ 10 000 r/min离心5 min,取上清液作为DNA模板,-20 ℃保存备用。
1.2.3PCR反应体系与反应条件
SPI1~SPI5基因序列合成引物见表1。PCR反应体系为25 μl:5×Buffer 5.0 μl、dNTP 2.0 μl、Taq酶(5 U/μl)0.25 μl、上下游引物各0.5 μl、DNA模板0.5 μl,无菌纯水16.25 μl。PCR反应条件参照文献[14]。
1.2.4PCR产物分析
将毛细管电泳出现阳性条带的PCR产物纯化后,部分送上海生工双向测序,结果在GenBank进行在线比对。
1.3统计学分析
检出率的比较用卡方检验,P<0.05为差异有统计学意义。
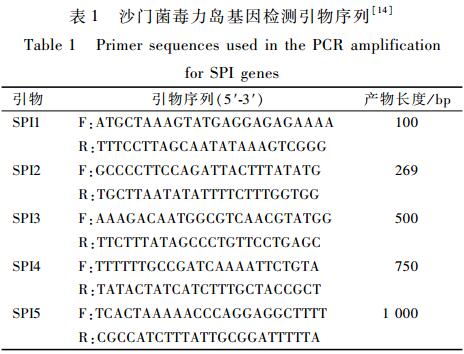
|
表1沙门菌毒力岛基因检测引物序列[14] Table 1Primer sequences used in the PCR amplification for SPI genes2结果 |
2.1各类样品/标本沙门菌血清型分布结果
152株沙门菌共分为16个血清型,肠炎沙门菌为优势血清型,各血清型检出情况见表2。其中食品株沙门菌共分为7个血清型,分别为肠炎沙门菌、印第安纳沙门菌、圣保罗沙门菌、甲型副伤寒沙门菌、都柏林沙门菌、阿贡纳沙门菌和雷特巴沙门菌;食物中毒株沙门菌共分为6个血清型,分别为肠炎沙门菌、圣保罗沙门菌、都柏林沙门菌、鼠伤寒沙门菌、乙型副伤寒沙门菌、易迈克沙门菌;生鸡肉株沙门菌共分为9个血清型,以肠炎沙门菌、印第安纳沙门菌、山夫登堡沙门菌为主,其中,山夫登堡沙门菌、肯塔基沙门菌、Rissen沙门菌、Fillmore沙门菌、Redba沙门菌、鸡-雏沙门菌为鸡肉株特有血清型。

|
表2各类样品/标本沙门菌血清型分布(株) Table 2All samples of Salmonella serotype distribution |
2.2肠炎沙门菌毒力岛及其谱型分布
以3种来源都有的优势血清型肠炎沙门菌为例,83株肠炎沙门菌中SPI1、SPI2、SPI3、SPI4、SPI5均有检出,毒力岛总检出率分别为91.6%、95.2%、92.8%、80.7%、77.1%。经过统计学分析,肠炎沙门菌SPI4检出率仅在食物中毒株和食品株间差异有统计学意义(P<0.05),其余毒力岛在各类样品/标本中的检出率均差异无统计学意义(P>0.05),见表3。|
|
表3不同来源的肠炎沙门菌毒力岛的检出率(%) Table 3Detection rate of virulence island in Salmonella enteriditis strains from differet sources |

|
图183株不同来源的肠炎沙门菌毒力岛谱型分布 Figure 1Distribution of pathogenicity islands of Salmonella enteriditis strains isolated from different sources |
2.3不同来源样品/标本沙门菌毒力岛检出结果
SPI1、SPI2、SPI3、SPI4、SPI5均有检出,检出率分别为80.3%、94.7%、92.8%、78.3%、75.7%。SPI1在食物中毒株中检出率最高,SPI2、SPI3在食品株及生鸡肉株中检出率最高。通过统计学分析,SPI1在食品与食物中毒株、食品与生鸡肉分离株中的检出率差异有统计学意义(P<0.05)。SPI3在食物中毒株与食品株、食物中毒株与生鸡肉分离株中的检出率差异有统计学意义(P<0.05),结果见表4。
2.4沙门菌食物中毒分离株毒力岛谱型
食物中毒沙门菌分离株毒力岛谱型分为9个,其中优势谱型为SPI1+SPI2+SPI3+SPI4+SPI5,占比48.6%(17/35),见图2。
2.5沙门菌市售食品分离株毒力岛谱型
市售食品沙门菌分离株毒力岛谱型分为7个,其中优势谱型为SPI1+SPI2+SPI3+SPI4+SPI5,占比36.4%(8/22),见图3。|
|
表4SPI1~SPI5基因检出情况 Table 4Detection of Salmonella SPI1-SPI5 genes from different sources |

|
图2沙门菌食物中毒分离株毒力岛谱型分布 Figure 2Distribution of pathogenicity islands of Salmonella strains isolated from poisoning food |

|
图3沙门菌市售食品分离株毒力岛谱型分布 Figure 3Distribution of pathogenicity islands of Salmonella strains isolated from commercial food |
2.6沙门菌市售生鸡肉分离株毒力岛谱型
市售生鸡肉沙门菌分离株毒力岛谱型分为7个,其中优势谱型为SPI1+SPI2+SPI3+SPI4+SPI5,占比66.3%(63/95),见图4。

|
图4沙门菌生鸡肉分离株毒力岛谱型分布 Figure 4Distribution of pathogenicity islands of Salmonella strains isolated from raw chicken |
2.7不同来源样品/标本中沙门菌毒力岛谱型结果比较
3种菌株来源均有的谱型为SPI1+SPI2+SPI3、SPI1+SPI2+SPI3+SPI4、SPI1+SPI2+SPI3+SPI4+SPI5。食物中毒株和生鸡肉分离株中均有的谱型为均未检出型、SPI1+SPI2+SPI3+SPI5。食物中毒株和食品株中均有的谱型为SPI1、SPI2+SPI3。生鸡肉分离株和食品株中均有的谱型为SPI2+SPI3+SPI4+SPI5。通过统计学分析,食物中毒株与其他两类菌株中SPI2+SPI3+SPI4+SPI5谱型差异有统计学意义(P<0.05),食物中毒株未检出该谱型。食物中毒株与生鸡肉分离株中仅携带SPI1谱型差异有统计学意义(P<0.05),生鸡肉分离株中未检出该谱型。
3讨论
沙门菌是近年来导致食源性疾病的最主要病原体之一,是导致食源性疾病暴发的最主要原因。在欧洲和澳大利亚地区,沙门菌病仍占有很大比例[15-16]。而在美国,沙门菌引起的疾病数量要超过其他食源性病原菌[17-18]。尽管我国目前尚无权威的数据公开指明沙门菌病的严峻形势,但若致力于提高食品安全和保障消费者健康,沙门菌病是必须彻底解决的关键问题。目前已发现沙门菌2 000余种,血清多达2 500多种[19],其引起的食物中毒与沙门菌株的SPI相关。已鉴定出的23个SPI,均为国外报道[20],随着分子生物学方法不断更新,是否还有未知毒力岛存在,仍是目前的研究热点。国内对沙门菌毒力岛的研究目前仍处于起步阶段,仅有少数报道[14,20-21],其中研究早且较为深入的是SPI1~SPI5。
2013—2016年石家庄地区沙门菌的血清型种类非常多,以肠炎沙门菌为优势血清型,另外还有15种散发血清型。本研究显示,同一血清型沙门菌可以出现不同的毒力岛谱型,沙门菌的毒力岛谱型分布与菌株的不同来源相关,与国外报道[22]一致。
本研究对152株沙门菌的5个主要毒力岛核心蛋白基因进行检测的结果,与田质高[14]的研究结果略有差异,其中SPI1~SPI4检出率大致符合,而SPI5检出率略低,这可能与采集的样品不同有关。本研究发现,携带SPI1与沙门菌食物中毒呈正相关,而携带SPI3、SPI4、SPI5与沙门菌食物中毒无相关性。SPI1与沙门菌食物中毒关系密切,与国外报道结果[23-26]符合,SPI1编码与侵袭力有关的Ⅲ型分泌系统1(type Ⅲ secretion system 1,T3SS1)。而SPI3、SPI4、SPI5与食物中毒无关,据报道[7,27],SPI3可能与沙门菌在巨噬细胞内存活有关,可参与沙门菌在肠道的长期定植机制;SPI4编码的T1SS为沙门菌在小牛及其他一些哺乳动物体内定植所需,但其功能还未明确[7];SPI5编码pipA、pipB、pipC、pipD等基因[7]。与王晶钰等[20]的研究相比,不同的是,本研究未发现SPI2与食物中毒有关;而相同的是,也未发现其他毒力岛谱型与沙门菌食物中毒有关。目前人们普遍认为SPI2是沙门菌在细胞内存活和发挥毒力的重要毒力岛,它如何调控炎性反应已成为目前研究的热点[28-29]。
本研究中市售生鸡肉SPI1的携带率高于市售食品,有引起食物中毒的潜在风险,因此,食品卫生监管应加强对市售生鸡肉的冷链储存及运输等环节监管,防止沙门菌污染食品引起食源性疾病的暴发。
参考文献
[1]BHUNIA A.基础食品微生物学[M].江汉湖,译.北京:中国轻工业出版社,2014.
[2]石永琼.沙门氏菌的研究进展[J].世界最新医学信息文摘:连续型电子期刊,2016,16(25):37-38.
[3]SCALLAN E,HOEKSTRA R M,ANGULO F J,et al.Foodborne illness acquired in the United States-major pathogens[J].Emerging Infectious Diseases,2011,17(1):7-15.
[4]DANDEKAR T,FIESELMANN A,FISCHER E,et al.Salmonella-how a metabolic generalist adopts an intracellular lifestyle during infection[J].Front Cell Infect Microbiol,2014,4:191.
[5]沈伟伟,裘丹红,盛莹,等.台州市食源性沙门菌耐药性、毒力因子及分子分型研究[J].中国食品卫生杂志,2013,25(4):315-319.
[6]HAUTEFORT I,THOMPSON A,ERIKSSON-YGBERG S,et al.During infection of epithelial cells Salmonella enterica serovar Typhimurium undergoes a time-dependent transcriptional adapt-ation that results in simultaneous expression of three type 3 secretion systems[J].Cell Microbiol,2008,10(4):958-984.
[7]薛颖,郭荣显,钱珊珊,等.沙门菌毒力岛的研究进展[J].微生物与感染,2015,10(6):381-389.
[8]FOOKES M,SCHROEDER G N,LANGRIDGE G C,et al.Salmonella bongori provides insights into the evolution of the Salmonellae[J].PLoS Pathog,2011,7(8):e1002191.
[9]陈俊,蒋文灿,谭天,等.沙门氏菌毒力岛及Ⅲ型分泌系统研究进展[J].中国人兽共患病学报,2015,31(4):371-376.
[10]石颖,杨保伟,师俊玲,等.陕西关中畜禽肉及凉拌菜中沙门氏菌污染分析[J].西北农业学报,2011,20(7):22-27.
[11]KUANG X H,HAO H H,DAI M H,et al.Serotypes and antimicrobial susceptibility of Salmonella spp. isolated from farm animals in China[J].Front Microbiol,2015,6:602.
[12]LAI J,WU C M,WU C B,et al.Serotype distribution and antibiotic resistance of Salmonella in food-producing animals in Shandong Province of China, 2009 and 2012[J].Int J Food Microbiol,2014,180:30-38.
[13]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 沙门氏菌检验:GB 4789.4—2010[S]北京:中国标准出版社,2010.
[14]田质高.蛋源沙门氏菌毒力岛的检测及标志基因的研究[D].扬州:扬州大学,2009.
[15]European Food Safety Authority,European Centre for Disease Prevention and Control.The European union summary report on trends and sources of zoonoses, zoonotic agents and foodborne outbreaks in 2013[J].EFSA Journal,2015,13(1):3991.
[16]OzFoodNet Working Group.Monitoring the incidence and causes of diseases potentially transmitted by food in Australia:annual report of the OzFoodNet network, 2011[J].Communicable Diseases Intelligence Quarterly Report,2015,39(2):236-264.
[17]ADAMS D A,GALLAGHER K M,JAJOSKY R A,et al.Summary of notifiable diseases-United States, 2011[J].Morbidity and Mortality Weekly Report,2013,60(53):1-117.
[18]CDC.Foodborne diseases active surveillance network (FoodNet):FoodNet surveillance report for 2012 (final report)[M].Atlanta,Georgia:U.S. Department of Health and Human Services,CDC,2014:2-36.
[19]张小平,吴忠华,魏莹.食品中沙门菌检测技术研究进展[J].中国国境卫生检疫杂志,2016,39(1):72-75.
[20]王晶钰,董睿,王利勤,等.市售鲜鸡蛋中沙氏门菌的分离鉴定及毒力岛基因检测[J].食品科学,2012,33(16):154-158.
[21]吕雪莲.肠炎沙门氏菌三种主要毒力岛基因缺失株的构建及其免疫效力研究[D].黑龙江:黑龙江八一农垦大学,2015.
[22]SNCHEZJIMNEZ M M,CARDONACASTRO N M,CANU N,et al.Distribution of pathogenicity islands among Colombian isolates of Salmonella[J].Journal of Infection in Developing Countries,2010,4(9):555-559.
[23]EGAN F,BARRET M,OGARA F.The SPI1-like type III secretion system:more roles than you think[J].Front Plant Sci,2014,5(3):34.
[24]QUE F X,WU S Y,HUANG R.Salmonella pathogenicity island 1 (SPI1) at work[J].Current Microbiology,2013,66(6):582-587.
[25]ESPINOSA E,CASADESS J.Regulation of Salmonella enterica,pathogenicity island 1 (SPI1) by the LysR-type regulator LeuO[J].Molecular Microbiology,2014,91(6):1057-1069.
[26]HARAGA A,OHLSON M B,MILLER S I.Salmonellae interplay with host cells[J].Nature Reviews Microbiology,2008,6(1):53-66.
[27]DORSEY C W,LAARAKKER M C,HUMPHRIES A D,et al.Salmonella enterica serotype Typhimurium MisL is an intestinal colonization factor that binds fibronectin[J].Molecular Microbiology,2005,57(1):196-211.
[28]CHAKRABORTY S,MIZUSAKI H,KENNEY L J.A FRET-based DNA biosensor tracks OmpR-dependent acidification of Salmonella during macrophage infection[J].PLoS Biology,2015,13(4):e1002116.
[29]BRAUKMANN M,METHNER U,BERNDT A.Immune reaction and survivability of Salmonella typhimurium and Salmonella infantis after infection of primary avian macrophages[J].PLoS One,2014,10(3):e0122540.
[2]石永琼.沙门氏菌的研究进展[J].世界最新医学信息文摘:连续型电子期刊,2016,16(25):37-38.
[3]SCALLAN E,HOEKSTRA R M,ANGULO F J,et al.Foodborne illness acquired in the United States-major pathogens[J].Emerging Infectious Diseases,2011,17(1):7-15.
[4]DANDEKAR T,FIESELMANN A,FISCHER E,et al.Salmonella-how a metabolic generalist adopts an intracellular lifestyle during infection[J].Front Cell Infect Microbiol,2014,4:191.
[5]沈伟伟,裘丹红,盛莹,等.台州市食源性沙门菌耐药性、毒力因子及分子分型研究[J].中国食品卫生杂志,2013,25(4):315-319.
[6]HAUTEFORT I,THOMPSON A,ERIKSSON-YGBERG S,et al.During infection of epithelial cells Salmonella enterica serovar Typhimurium undergoes a time-dependent transcriptional adapt-ation that results in simultaneous expression of three type 3 secretion systems[J].Cell Microbiol,2008,10(4):958-984.
[7]薛颖,郭荣显,钱珊珊,等.沙门菌毒力岛的研究进展[J].微生物与感染,2015,10(6):381-389.
[8]FOOKES M,SCHROEDER G N,LANGRIDGE G C,et al.Salmonella bongori provides insights into the evolution of the Salmonellae[J].PLoS Pathog,2011,7(8):e1002191.
[9]陈俊,蒋文灿,谭天,等.沙门氏菌毒力岛及Ⅲ型分泌系统研究进展[J].中国人兽共患病学报,2015,31(4):371-376.
[10]石颖,杨保伟,师俊玲,等.陕西关中畜禽肉及凉拌菜中沙门氏菌污染分析[J].西北农业学报,2011,20(7):22-27.
[11]KUANG X H,HAO H H,DAI M H,et al.Serotypes and antimicrobial susceptibility of Salmonella spp. isolated from farm animals in China[J].Front Microbiol,2015,6:602.
[12]LAI J,WU C M,WU C B,et al.Serotype distribution and antibiotic resistance of Salmonella in food-producing animals in Shandong Province of China, 2009 and 2012[J].Int J Food Microbiol,2014,180:30-38.
[13]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 沙门氏菌检验:GB 4789.4—2010[S]北京:中国标准出版社,2010.
[14]田质高.蛋源沙门氏菌毒力岛的检测及标志基因的研究[D].扬州:扬州大学,2009.
[15]European Food Safety Authority,European Centre for Disease Prevention and Control.The European union summary report on trends and sources of zoonoses, zoonotic agents and foodborne outbreaks in 2013[J].EFSA Journal,2015,13(1):3991.
[16]OzFoodNet Working Group.Monitoring the incidence and causes of diseases potentially transmitted by food in Australia:annual report of the OzFoodNet network, 2011[J].Communicable Diseases Intelligence Quarterly Report,2015,39(2):236-264.
[17]ADAMS D A,GALLAGHER K M,JAJOSKY R A,et al.Summary of notifiable diseases-United States, 2011[J].Morbidity and Mortality Weekly Report,2013,60(53):1-117.
[18]CDC.Foodborne diseases active surveillance network (FoodNet):FoodNet surveillance report for 2012 (final report)[M].Atlanta,Georgia:U.S. Department of Health and Human Services,CDC,2014:2-36.
[19]张小平,吴忠华,魏莹.食品中沙门菌检测技术研究进展[J].中国国境卫生检疫杂志,2016,39(1):72-75.
[20]王晶钰,董睿,王利勤,等.市售鲜鸡蛋中沙氏门菌的分离鉴定及毒力岛基因检测[J].食品科学,2012,33(16):154-158.
[21]吕雪莲.肠炎沙门氏菌三种主要毒力岛基因缺失株的构建及其免疫效力研究[D].黑龙江:黑龙江八一农垦大学,2015.
[22]SNCHEZJIMNEZ M M,CARDONACASTRO N M,CANU N,et al.Distribution of pathogenicity islands among Colombian isolates of Salmonella[J].Journal of Infection in Developing Countries,2010,4(9):555-559.
[23]EGAN F,BARRET M,OGARA F.The SPI1-like type III secretion system:more roles than you think[J].Front Plant Sci,2014,5(3):34.
[24]QUE F X,WU S Y,HUANG R.Salmonella pathogenicity island 1 (SPI1) at work[J].Current Microbiology,2013,66(6):582-587.
[25]ESPINOSA E,CASADESS J.Regulation of Salmonella enterica,pathogenicity island 1 (SPI1) by the LysR-type regulator LeuO[J].Molecular Microbiology,2014,91(6):1057-1069.
[26]HARAGA A,OHLSON M B,MILLER S I.Salmonellae interplay with host cells[J].Nature Reviews Microbiology,2008,6(1):53-66.
[27]DORSEY C W,LAARAKKER M C,HUMPHRIES A D,et al.Salmonella enterica serotype Typhimurium MisL is an intestinal colonization factor that binds fibronectin[J].Molecular Microbiology,2005,57(1):196-211.
[28]CHAKRABORTY S,MIZUSAKI H,KENNEY L J.A FRET-based DNA biosensor tracks OmpR-dependent acidification of Salmonella during macrophage infection[J].PLoS Biology,2015,13(4):e1002116.
[29]BRAUKMANN M,METHNER U,BERNDT A.Immune reaction and survivability of Salmonella typhimurium and Salmonella infantis after infection of primary avian macrophages[J].PLoS One,2014,10(3):e0122540.
 牛莉娅,秦丽云,徐保红,王燕,杨新英,孙殿兴,郭玉梅.食源性沙门菌毒力岛基因分布及特征研究[J].中国食品卫生杂志,2017,29(2):131-135.
牛莉娅,秦丽云,徐保红,王燕,杨新英,孙殿兴,郭玉梅.食源性沙门菌毒力岛基因分布及特征研究[J].中国食品卫生杂志,2017,29(2):131-135.